身につけるべきスキル
- 原子の中で電子がどのようにグループ化されているかを説明する。
これまで、原子内の素粒子の一般的な配置について説明してきましたが、電子が原子核の周りの空間をどのように占めているかについてはほとんど説明してきませんでした。
電子の振る舞いに関する現代の理論は量子力学と呼ばれています。
- 原子の中の電子は、ある特定のエネルギーしか持つことができません。
- 電子はそのエネルギーに応じて殻と呼ばれる集合に整理されます。 一般的に殻のエネルギーが高いほど、核から(平均的に)離れています。
- 殻はさらにサブシェルと呼ばれる電子の集合に分けられます。 第1の殻には1つのサブシェルしかなく、第2の殻には2つのサブシェルがあり、第3の殻には3つのサブシェルがある、という具合です。
- サブシェルによって保持できる電子の最大数が異なります。 sサブシェルは最大2個の電子を、pスーパーシェルは最大6個の電子を、dサブシェルは最大10個の電子を、fサブシェルは最大14個の電子を保持できます。
化学的性質に最も影響を与えるのは電子の殻への配置なので、ここでは主に殻に焦点を当てて説明します。 原子核に最も近く、最もエネルギーの低い電子を持つ第1の殻が第1殻です。 この第1殻には副殻(1sと表示)が1つだけあり、最大で2個の電子を保持することができます。
第1殻には最大2個の電子しか入らないため、3番目の電子は第2殻に入らなければなりません。 したがって、合計3個の電子を持つリチウム(Li)は、第1の殻に2個の電子、第2の殻に1個の電子を持つことになります。
第2殻には2つの副殻(2sと2pと表示されています)があります。 2sの副殻は最大2個の電子を保持し、2pの副殻は最大6個の電子を保持します。 つまり、第2殻には最大8個の電子が入ることになる(2+6=8)。
反応(獲得、喪失、共有)しやすいのは、最も外側のVALENCE殻と呼ばれる殻の電子だけです。 2つの原子がぶつかったとき、最初に相互作用するのは外側の電子であることが想像できるかもしれません。
- 水素は第1殻に1個の電子を持っています(つまり、価電子は1個)。
- リチウムは3つの電子を持っています—第一の殻に2つ、第二の殻に1つ(つまり価電子は1つ)
- ベリリウムは4つの電子を持っています—第一の殻に2つ、第二の殻に2つ(つまり価電子は2つ)
- ボロンは5個の電子を持っています—第一の殻に2個、第二の殻に3個(つまり価電子は3個)です。
- 炭素は6個の電子を持っています—第一の殻に2個、第二の殻に4個(つまり4価の電子)です。
- 窒素は7個の電子を持っています・・・第一の殻に2個、第二の殻に5個(つまり5価の電子)
- 酸素は8個の電子を持っています・・・第一の殻に2個、第二の殻に6個(つまり6価の電子)。
- フッ素は9個の電子を持っています・・・第一の殻に2個、第二の殻に7個(つまり7価の電子)
- ネオンは10個の電子を持っています・・・第一の殻に2個、第二の殻に8個(つまり8価の電子)。
以下の図2.6.1に主な元素の原子番号を示します。 原子番号は、各原子の原子核内の陽子の数を定義しています。 中性原子の場合、正の陽子の数は負の電子の総数と同じになります(正味の電荷はゼロ)。 例えば、臭素(Br)は陽子が35個、電子の総数が35個です。

図2.6.1.1 – 各主群元素の原子番号
各主群元素の価電子の数は、周期表のどの列(群)を占めているかによって決まります。 以下の表2.6.2は、主群元素の各列の価電子数をまとめたものです。 例えば,1列目(IAと表記されることもある)の元素は,すべて1個の価電子を持っています。 第2列(IIA)は2個の価電子を持っています。 真ん中の10個の元素の短いブロックは、サブシェルが順番に埋まっていく場所なので省略します。 IIIA列、IVA列、VA列、VIA列、VIIA列、VIIIA列*の元素は、それぞれ3個、4個、5個、6個、7個、8個*の価電子を持っています。
*ヘリウム(He)は価電子を2個しか持っていないことに注意してください。
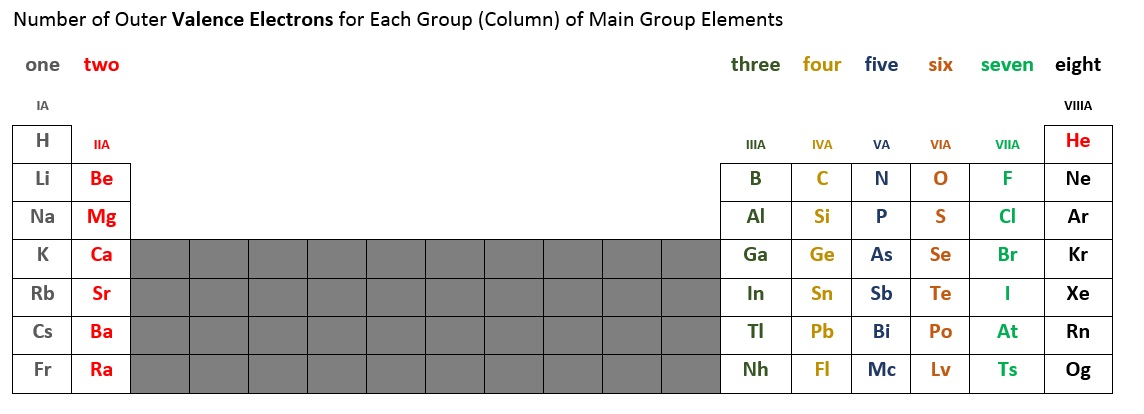
Figure 2.6.2 – Main Group ElementsのValence Electrons Number
Example ˶‾᷅˵‾᷅˵: リン原子の電子について
中性のリン原子の総電子数と価電子数は何個ですか
解答
中性のリン原子の総電子数は15個です。 第1の殻に2個、第2の殻に8個、第3の殻に5個の電子が入ります。
各殻の電子数は、使用される副殻の数が増えたり、殻の順番が狂ったりして電子が増えるほど複雑になります。 原子番号が20より大きい元素(カルシウム以外)については、各殻の数ではなく、総電子数と価電子数に注目します。 外殻の電子を価電子と呼ぶと述べました。
Example(サンプル) ━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━ ! キセノン原子の総電子と価電子を数える
中性のキセノン原子には、総電子、価電子、コア電子が何個あるでしょうか?
解答
キセノンには総電子数54個、価電子数8個、内殻電子数46個の電子があります。
回答
- 電子は原子核の周りの殻やサブシェルに組織されています。
- 第一の殻には最大2個、第二の殻には最大8個の電子が入ることができます。
- 価電子は最も番号の大きい(外)殻にあり、その他の電子はすべて内殻電子です。
Key Takeaway
- 電子は原子核を中心に殻と副殻に分かれています。
Contributors
-
Anonymous