複素環アミンの塩基性
窒素原子が芳香環に直接組み込まれている場合、その塩基性は結合の状況に依存する。 例えば、ピリジン環では、窒素のローンペアはsp2ハイブリッド軌道を占め、芳香族6重奏の一部ではなく、本質的にはイミン窒素である。

対照的に、ピロール環では、窒素ローンペアは芳香族6重項の一部です。 つまり、これらの電子は、その場所(芳香族系の中)で非常に安定しており、プロトンと結合できる可能性は非常に低いのです(もしプロトンを拾ったとしても、芳香族系は破壊されます)。

アニリン、ピリジン、ピロールの例は、より複雑な環系(自然界には非常に多様なものが存在します)における窒素原子の反応性を予測するための良いモデルです。


ニトリルの窒素上の単独ペア電子は、spハイブリッド軌道に含まれています。
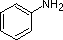
酸と塩基の基本的な概念を復習しておくと、以下の議論に役立ちます。 アンモニアと同様、ほとんどのアミンはブレンステッド塩基およびルイス塩基ですが、その塩基性は置換基によって大きく変化します。 塩基性の定量的な比較には、pKbではなく共役の酸のpKaを用いるのが一般的です。 pKa + pKb = 14なので、pKaが高いほど塩基性が強いことになり、通常のpKaと酸性度の逆の関係とは対照的です。 ほとんどの単純なアルキルアミンのpKaは9.5~11.0の範囲にあり、その水溶液は塩基性である(濃度に応じてpHが11~12になる)。
最後の5つの化合物(色のついたセル)は、3つの要因により、著しく弱い塩基となります。
最後の5つの化合物(色のついたセル)は、3つの要因によって著しく弱い塩基となります。 ピリジンでは窒素がsp2混成されており、ニトリル(最後のエントリ)ではsp混成された窒素が三重結合の一部となっています。 これらの化合物(赤の斜線)では、非結合電子ペアは窒素原子に局在していますが、s字を増やすと窒素核に近づき、プロトンと結合する傾向が弱まります。
|
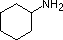
化合物 |
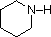 |
 |
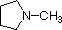 |
NH3 |  |
 |
 |
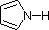 |
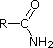 |
CH3C≡N |
|---|---|---|---|---|---|---|---|---|---|---|
| pKa | 11.0 | 10.7 | 10.7 | 9.3 | 5.2 | 4.6 | 1.0 | 0.0 | -1.0 | -10. |
一般的なアミンの塩基性(共役アンモニウムイオンのpKa)
最後に、ピロール(青の斜線)の非常に低い塩基性は、芳香環に組み込まれた窒素電子対の例外的な非局在化を反映しています。 インドール(pKa = -2)とイミダゾール(pKa = 7.0)も同様に複素環式の芳香環を持つ。
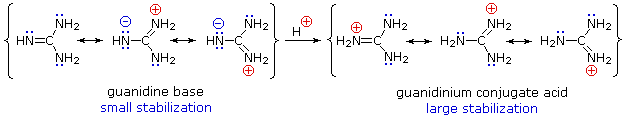
一般に、共鳴非局在化はアミンの塩基性を低下させますが、その逆の劇的な例がグアニジン(pKa = 13.6)という化合物に見られます。 ここでは以下のように、塩基の共鳴安定化は電荷分離により小さく、共役の酸は電荷の非局在化により強く安定化しています。