
現在の原子構造のモデルは、量子力学モデルです。 伝統的な化学は、素粒子、原子、分子、物質、金属、結晶、その他の物質の集合体の研究から始まります。 物質は、固体、液体、気体、プラズマの状態で、単独で、あるいは組み合わせて研究することができます。 化学で学ぶ相互作用、反応、変換は、通常、原子間の相互作用の結果であり、原子を結合している化学結合の再編成につながります。
化学実験室では、様々な形の実験用ガラス器具を使用するのが一般的です。
化学実験室では、典型的に様々な形の実験用ガラス器具を使用しますが、ガラス器具は化学の中心的なものではなく、実験化学や応用化学、工業化学の多くはガラス器具を使わずに行われています。

化学反応とは、ある物質が1つまたは複数の異なる物質に変化することです。 このような化学変化の基礎となるのは、原子間の化学結合における電子の再配置です。 これを象徴的に表すのが化学反応式で、通常は原子を主語にします。 化学変化の式では、左と右の原子の数は等しい。 左右の原子の数が異なる場合は、核反応や放射性崩壊などと呼ばれる)。
エネルギーとエントロピーの考慮は、ほとんどすべての化学研究において常に重要である。
エネルギーとエントロピーの考察は、ほとんどすべての化学研究において重要です。化学物質は、その構造、相、化学組成によって分類されます。 化学物質は、その構造や相、化学組成によって分類され、分光法やクロマトグラフィーなどの化学分析手段を用いて分析される。 化学物質の研究に従事する科学者は化学者と呼ばれる。 ほとんどの化学者は、1つ以上の専門分野を持っている。
物質 の研究には、いくつかの概念が必要です。 物質
化学において物質とは、静止した質量と体積(空間を占める)を持ち、粒子で構成されているものと定義されます。 物質を構成する粒子は静止質量も持っていますが、光子のようにすべての粒子が静止質量を持っているわけではありません。 物質は純粋な化学物質であることもあれば、物質の混合物であることもあります。
原子

原子は化学の基本単位です。 原子は、原子核と呼ばれる高密度の核と、それを取り囲む電子雲の空間から構成されています。 原子核は正の電荷を持つ陽子と電荷を持たない中性子(これらを総称して核子と呼ぶ)で構成され、電子雲は原子核の周りを回る負の電荷を持つ電子で構成されています。 中性原子では、負の電荷を帯びた電子が陽子の正の電荷と釣り合っている。
また、原子は、電気陰性度、イオン化ポテンシャル、好ましい酸化状態、配位数、好ましい結合の種類(金属結合、イオン結合、共有結合など)など、元素の化学的性質を保持することが想定される最小の存在である。
元素
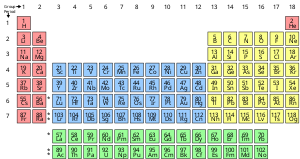
化学元素とは、原子核に含まれる陽子の数で特徴づけられる1種類の原子から構成される純粋な物質で、原子番号と呼ばれ、記号Zで表されます。 1つの元素に属するすべての原子の原子核は同じ原子番号であるが、質量数は必ずしも同じではなく、質量数が異なる元素の原子を「同位体」と呼ぶ。
化学元素の標準的な表示方法は、元素を原子番号順に並べた周期表である。
化学元素の標準的な表示方法は、原子番号順に並んだ周期表である。
化合物

化合物とは、2つ以上の元素からなる純粋な化学物質のことです。 化合物の特性は、その元素の特性とほとんど類似していません。 化合物の標準的な命名法は、国際純正・応用化学連合(IUPAC)によって定められています。 有機化合物は、有機命名法に基づいて命名される。 無機化合物の名称は、無機命名法に基づいて作成される。 化合物が複数の成分を持つ場合は、電気陽性成分と電気陰性成分の2つのクラスに分けられる。 また、Chemical Abstracts Serviceは、化学物質を索引する方法を考案した。
Molecule

分子とは、固有の化学的性質を持つ純粋な化学物質の最小の不可分な部分であり、他の物質と一定の化学反応を起こす可能性があることを意味しています。 しかし、この定義は、分子で構成されている物質に対してのみ有効であり、多くの物質に当てはまるわけではない(以下参照)。
つまり、分子はイオンとは異なり、電気的に中性な単位として存在します。
このように、分子はイオンとは異なり、電気的に中性な単位として存在しています。この規則を破って「分子」に電荷を与えると、分子イオンや多原子イオンと呼ばれることがあります。 しかし、分子の概念が分離したものであることから、通常、分子イオンは、質量分析計の真空中の指向性ビームのように、十分に分離された形でのみ存在する必要がある。 固体中に存在する電荷を帯びた多原子集合体(例えば、一般的な硫酸イオンや硝酸イオンなど)は、一般的に化学的には「分子」とはみなされない。 分子の中には、1つ以上の不対電子を含んだラジカルが存在する。 ほとんどのラジカルは比較的反応性が高いのですが、一酸化窒素(NO)のように安定しているものもあります。

「不活性」または「希ガス」の元素(ヘリウム、ネオン、アルゴン、クリプトン、キセノン、その他)。
「不活性」または希ガス元素(ヘリウム、ネオン、アルゴン、クリプトン、キセノン、ラドン)は、最小の個別単位である単独の原子から構成されていますが、その他の孤立した化学元素は、分子または何らかの方法で互いに結合した原子のネットワークから構成されています。 しかし、すべての物質や化学化合物が個別の分子から構成されているわけではなく、地球の固体である地殻、マントル、コアを構成する固体物質のほとんどは、分子を持たない化学化合物です。 イオン化合物やネットワーク固体などの物質は、それ自体には分子が存在しないように構成されています。 イオン化合物やネットワーク固体などの物質は、それ自体では分子が存在しないように構成されており、物質内の最小の繰り返し構造である式単位や単位胞で表現される。
分子の大きな特徴の1つは、その構造と呼ばれる形状です。
物質と混合物






純粋な化学物質の例です。 左から順に、元素のスズ(Sn)とイオウ(S)、炭素の同素体であるダイヤモンド、純粋な砂糖であるスクロース、イオン化合物である塩化ナトリウム(塩)と炭酸水素ナトリウム(重曹)。
化学物質とは、一定の組成と特性を持つ一種の物質で、複数の物質の集まりを混合物といいます。
モルと物質の量
モルとは物質の量(化学量ともいう)を表す単位です。 1モルはちょうど6.02214076×1023個の粒子(原子、分子、イオン、電子)を含むと定義され、1モルあたりの粒子の数はアボガドロ定数と呼ばれます。 モル濃度は、溶液の体積あたりの特定の物質の量であり、一般的にmol/dm3で表されます。
相

異なる化学分類を区別する特定の化学的特性に加えて、化学物質はいくつかの相で存在することができます。 ほとんどの場合、化学物質の分類はこれらのバルク相の分類とは独立していますが、よりエキゾチックな相の中には特定の化学特性と相容れないものもあります。
密度や屈折率などの物理的特性は、その相に特徴的な値に収まる傾向があります。
物質の相は、相転移によって定義されます。相転移とは、システムに入れられたエネルギーや取り出されたエネルギーが、バルク条件を変えるのではなく、システムの構造を組み替えることです。
最も身近な相の例としては、固体、液体、気体があります。 また、多くの物質は複数の固相を示します。
最も身近な例としては、固体、液体、気体などがありますが、多くの物質は複数の固相を示し、例えば、固体の鉄には温度と圧力によってα、γ、δの3つの相があります。 固相の主な違いは、結晶構造、つまり原子の配列である。
身近なところでは、プラズマ、ボーズ-アインシュタイン凝縮やフェルミオン凝縮、磁性体の常磁性相や強磁性相などがある。
結合

分子や結晶の中でくっついている原子は、お互いに結合しているといいます。 化学結合は、原子核の正電荷とその周りを振動する負電荷の多極バランスとして視覚化することができます。
化学結合には、共有結合、イオン結合、水素結合のほか、ファンデルワールス力によるものもあります。
化学結合には、共有結合、イオン結合、水素結合、ファンデルワールス力などがあります。 これらのポテンシャルは、分子や結晶の中で原子を結合させる相互作用を生み出します。
イオン結合は、金属が1つ以上の電子を失って正電荷のカチオンになり、その電子を非金属原子が獲得して負電荷のアニオンになることで形成されます。 逆に帯電した2つのイオンは互いに引き合うので、イオン結合は両者の間の静電力による引力となる。 例えば、金属であるナトリウム(Na)は電子を1つ失ってNa+のカチオンとなり、非金属である塩素(Cl)はこの電子を得てCl-となる。

共有結合では、1つ以上の価電子のペアが2つの原子で共有され、その結果、結合した原子の電気的に中性なグループは分子と呼ばれます。 原子は、それぞれの原子が希ガスの電子配置(最外殻に8個の電子がある状態)になるように価電子を共有する。 それぞれの原子が価電子を8個持つように結合する傾向がある原子は、オクテットルールに従うと言われている。 しかし、水素やリチウムのように、最外殻に2個の電子があれば安定した配置になる元素もあり、このような原子はデュエット則と呼ばれ、最外殻に2個の電子を持つ希ガスであるヘリウムの電子配置に近づいていると考えられる。
同様に、古典物理学の理論は、多くのイオン構造の予測に用いることができます。しかし、金属錯体のような複雑な化合物では、価電子結合理論は適用しにくく、一般的には分子軌道理論のような別のアプローチが用いられます。
エネルギー
化学の文脈では、エネルギーは、原子、分子、または集合体の構造の結果としての物質の属性です。 化学変化はこれらの種類の構造の1つ以上の変化を伴うので、必ず関係する物質のエネルギーの増加または減少を伴うことになります。
反応の最終状態が初期状態よりもエネルギー尺度で低い場合、反応はエクセルゴニックであると言われ、エンデルゴニック反応の場合はその逆である。
化学反応は、反応物が活性化エネルギーと呼ばれるエネルギー障壁を乗り越えない限り、必ず起こりえない。
化学反応は反応物が活性化エネルギーというエネルギー障壁を越えなければ成立しない。化学反応の速度(温度T)は活性化エネルギーEとボルツマンの人口係数e – E / k Tにより関係する。

– これは、与えられた温度Tにおいて、分子がE以上のエネルギーを持つ確率であり、この反応速度の温度に対する指数依存性はアレニウス方程式として知られています。
関連概念である自由エネルギーは、エントロピーを考慮したもので、化学熱力学において、反応の実行可能性を予測したり、化学反応の平衡状態を決定したりするのに非常に有効な手段である。 化学反応は、ギブス自由エネルギーの変化量が負である場合にのみ成立する。
電子、原子、分子のエネルギー状態は限られたものしか存在しません。
電子、原子、分子のエネルギー状態は限られています。これは、束縛された系のエネルギーの量子化を必要とする量子力学のルールによって決定されます。 より高いエネルギー状態にある原子・分子は励起されているという。
物質の位相は、必ずその物質のエネルギーと周囲のエネルギーによって決まります。
物質の相は、その物質のエネルギーと周囲のエネルギーによって決定され、分子間力が周囲のエネルギーに打ち勝てない場合は、水(H2O)のように常温では分子が水素結合で結ばれているため液体や固体のような秩序のある相になります。
ある化学物質から別の化学物質へのエネルギーの移動は、ある物質から放出されるエネルギー量子の大きさに依存する。
ある化学物質から別の化学物質へのエネルギーの移動は、その物質から放出されるエネルギー量子の大きさに依存します。しかし、物質の振動および回転エネルギーレベルを担うフォノンは、電子エネルギー移動のために呼び出される光子よりもはるかに少ないエネルギーしか持たないため、熱エネルギーはほとんどすべての物質から別の物質へと容易に移動します。 このように、振動および回転エネルギーレベルは、電子エネルギーレベルよりも間隔が狭いため、光や他の形態の電子エネルギーに比べて、熱は物質間でより容易に伝達されます。
化学物質ごとに特徴的なエネルギー準位が存在することは、スペクトル線の分析による化学物質の識別に役立ちます。
化学分光法では、赤外、マイクロ波、NMR、ESRなど、さまざまな種類のスペクトルが使用されます。 また、分光法は、星や遠方の銀河のような遠隔地にある物体の組成を、その放射スペクトルを分析することによって識別するためにも使用されます。

化学エネルギーという言葉は、化学物質が化学反応によって変質する可能性や、他の化学物質を変換する可能性を示すためによく使われます。
反応

化学物質が他の物質やエネルギーと相互作用して変化することを「化学反応」といいます。 したがって、化学反応とは、ある物質が混合物や溶液として他の物質と密接に接触したり、何らかのエネルギーにさらされたり、あるいはその両方を受けたりしたときの「反応」に関する概念です。
化学反応は、分子の生成や解離、すなわち、分子が分解して2つ以上の分子になったり、分子内や分子間で原子が再配列されたりすることで起こります。 化学反応は、通常、化学結合の形成または破壊を伴う。 酸化、還元、解離、酸塩基の中和、分子の再配列などが一般的な化学反応です。
化学反応は、化学式によって象徴的に表すことができます。非核化学反応では、化学式の両側の原子の数と種類は同じですが、核反応では、陽子と中性子という核粒子だけがそうなります。
化学反応の過程で化学結合の再編成が行われる一連のステップは、そのメカニズムと呼ばれます。
化学反応の過程で、化学結合の再編成が行われている可能性がある一連のステップをメカニズムと呼びます。 そのため、反応の過程では、安定性の異なる多くの反応中間体が想定される。 反応の速度や生成物の構成を説明するために、反応機構が提案される。 物理化学者の多くは、さまざまな化学反応のメカニズムを探求し、提案することを専門としている。
IUPACのゴールドブックによると、化学反応とは「化学種の相互変換をもたらすプロセス」であるとされています。 したがって、化学反応は、素反応であったり、段階的な反応であったりします。 さらに、この定義には、コンフォーマーの相互変換が実験的に観察可能な場合も含まれるという注意点がある。 このような検出可能な化学反応は、通常、この定義で示されているように、一連の分子実体を含みますが、単一の分子実体を含む変化 (すなわち、「微視的な化学事象」) にもこの用語を使用することは、概念的に便利なことが多いです。
イオンと塩

イオンとは、原子や分子の中で、1つ以上の電子を失ったり獲得したりした電荷種のことです。 原子が電子を失い、電子よりも陽子の方が多い場合、その原子は正電荷を帯びたイオンまたは陽イオンとなります。 原子が電子を得て、陽子よりも電子の方が多い場合、その原子は負電荷を帯びたイオンまたは陰イオンとなります。 カチオンとアニオンは、塩化ナトリウム(NaCl)を形成するNa+イオンとCl-イオンのように、中性塩の結晶格子を形成することができます。
プラズマは、ガス状の物質が高温で完全にイオン化されたものです。
酸性と塩基性

物質はしばしば酸と塩基に分類されます。 酸-塩基反応を説明する理論にはいくつかの種類があります。 最も単純なのはアレニウス理論で、酸とは水に溶けるとヒドロニウムイオンを生成する物質、塩基とは水に溶けると水酸化物イオンを生成する物質であるとしています。 ブレンステッド-ローリー酸塩基理論では、酸は化学反応で他の物質に正の水素イオンを与える物質であり、その水素イオンを受け取る物質が塩基であるとされている。
3つ目の一般的な理論は、新しい化学結合の形成に基づくルイス酸塩基理論です。 この理論では、交換される重要なものは電荷である。
酸の強さは一般的に2つの方法で測定されます。 1つはアレニウスの定義に基づくpHで、これは溶液中のヒドロニウムイオン濃度を負の対数で表したものです。 このため、pHが低い溶液はヒドロニウムイオン濃度が高く、酸性度が高いと言える。 もう1つの測定方法は、ブレンステッド-ローリーの定義に基づく酸解離定数(Ka)であり、ブレンステッド-ローリーの定義に基づく酸として作用する物質の相対的な能力を測定するものである。 つまり、Kaの値が大きい物質は、Kaの値が小さい物質に比べて、化学反応において水素イオンを供与する可能性が高いということです。
Redox
酸化還元反応とは、原子が電子を得たり(還元)、電子を失ったり(酸化)して、その酸化状態を変化させる化学反応全般を指します。 他の物質を酸化させる能力を持つ物質は酸化的であると言われ、酸化剤、オキシダント、オキシダイザーと呼ばれている。 酸化剤は、他の物質から電子を取り除きます。 同様に、他の物質を還元する性質を持つ物質を還元性といい、還元剤、還元剤、還元者などと呼ばれています。
還元剤は電子を他の物質に移動させ、それ自体が酸化されます。また、電子を「提供」することから、電子供与剤とも呼ばれます。 酸化と還元は、正しくは酸化数の変化を意味し、実際には電子の移動は起こらないかもしれません。
Equilibrium
平衡の概念は科学の分野で広く使われていますが、化学の文脈では、例えば、互いに反応しうる複数の化学化合物の混合物や、ある物質が2種類以上の相に存在しうる場合など、化学組成の異なる状態がいくつも考えられる場合に生じるものです。
平衡状態にある化学物質のシステムは、たとえ組成が変わらないとしても、ほとんどの場合、静的なものではなく、物質の分子は互いに反応し続けるため、動的な平衡状態が生じます。
化学法則
化学反応は一定の法則に支配されており、これは化学の基本的な概念となっています。 そのいくつかをご紹介しましょう。
- アボガドロの法則
- ビール・ランバートの法則
- ボイルの法則(1662, 圧力と体積の関係)
- シャルルの法則(1787年、体積と温度の関係)
- フィックの拡散の法則
- ゲイ-リュサックの法則(1809年。 圧力と温度の関係)
- ル・シャトリエの原理
- ヘンリーの法則
- ヘスの法則
- エネルギー保存の法則は、平衡、熱力学、動力学の重要な概念につながるものである。
- 質量保存の法則は、現代物理学においても、孤立した系で保存され続けています。 しかし、特殊相対性理論では、質量とエネルギーの等価性により、非物質的な「エネルギー」(熱、光、運動エネルギー)が非孤立系から取り除かれると、それに伴っていくらかの質量が失われることが示されています。
- 確定組成の法則、ただし多くの系(特に生体高分子や鉱物)では比率に大きな数字を必要とする傾向があり、しばしば分数で表されます。
- 倍数比の法則
- ラウルの法則