質量分析計とは、試料をイオン化して電荷を帯びた分子にし、その質量と電荷の比(m/z)を測定する分析手法である。
MALDI
MALDIは、低分子のマトリックスにレーザーを当てることで、分析対象の分子を断片化したり分解したりせずに気相に移行させるソフトなイオン化です。 生体分子の中には大きすぎて加熱すると分解してしまうものがあり、従来の技術では高分子を断片化したり破壊したりしてしまいます。 MALDIは、ペプチド、脂質、糖類、その他の有機高分子のような生体分子の分析に適しています。
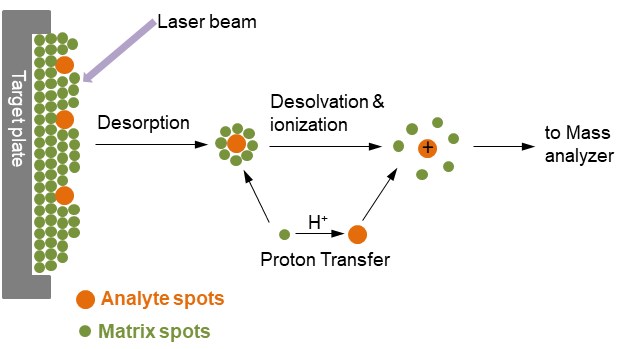
図1. MALDIによる分析対象物のイオン化
- MALDIの原理
図1では、分析対象物は、ターゲットと呼ばれる固体表面に蒸着された非常に過剰なマトリックス化合物の中に埋め込まれています。 非常に短いレーザーパルスが照射されると、照射されたスポットは急速に加熱され、振動励起される。 サンプルの表面からエネルギー的にアブレーションされたマトリックス分子は、レーザーエネルギーを吸収し、分析対象分子を気相にも運びます。 アブレーションの過程で、分析対象分子は通常、近くのマトリックス分子とプロトン化またはデプロトン化してイオン化される。
- MALDIでよく使われるレーザーの種類
紫外線(UV)と赤外線(IR)の両方の波長のレーザーが使用されていますが、分析MALDIでは紫外線レーザーが圧倒的に重要な光源となっています。 その中でも、窒素レーザーや、周波数を3倍または4倍にしたNd:Yagレーザーが多くのアプリケーションで活躍しています。
- 一般的に使用されるMALDIマトリックス物質
本質的にマトリックスの最初の機能は、分析対象分子を希釈して互いに分離することだと考えられています。 これは、溶媒の蒸発とそれに伴う固溶体の形成時に起こります。 そして、レーザー照射時には、エネルギー吸収の媒介物として機能します。 適切なマトリックスの選択は、MALDIの成功の鍵となる。 一般的に、極性の高い分析対象物は極性の高いマトリックスとの組み合わせがよく、非極性の分析対象物は非極性のマトリックスとの組み合わせが望ましい。 表1に示すように、さまざまなマトリックスが求められ、広く使用されてきた。 現在、最もよく使用されているマトリックスは、α-シアノ-4-ヒドロキシ桂皮酸、2,5-ジヒドロキシ安息香酸、3,5-ジメトキシ-4-ヒドロキシ桂皮酸、2,6-ジヒドロキシアセトフェノンである。 UV-MALDIマトリクス(Gross J. H, 2006)
| 化合物 | 頭字語 | 用途 に |
|---|---|---|
| ニコチン酸 | NA | ペプチド。 タンパク質 |
| ピコリン酸 | PA | オリゴヌクレオチド。 DNA |
| 3-Hydroxypicolinic acid | HPA, 3-HPA | Oligonucleotides, DNA |
| 3-Aminopicolinic acid | 3-APA | オリゴヌクレオチド, DNA |
| 6-Aza-2-thiothymine | ATT | オリゴヌクレオチド。 DNA |
| 2,5-Dihydroxybenzoic acid | DHB | Proteins, オリゴ糖 |
| DHBベースの混合物 | DHB/XYとスーパーDHB | 蛋白質, オリゴ糖 |
| 3-アミノキノリン | 3-AQ | オリゴ糖 |
| α-シアノ-4-ヒドロキシ桂皮酸 | α-CHC, α-CHCA、4-HCCA。 CHCA | ペプチド、小さなタンパク質、トリアシルグリセロール。 その他多数の化合物 |
| 4-クロロ-α-シアノ-?cinnamic acid | ClCCA | Peptides |
| 3,5-Dimethoxy-4-hydroxycinnamic acid | SA | Proteins |
| 2-(4-Hydroxyphenylazo) benzoic acid | HABA | Peptides, タンパク質、糖タンパク質、ポリスチレン |
| 2-メルカプトベンゾチアゾール | MBT | ペプチド類。 タンパク質、合成ポリマー |
| 5-クロロ-2-メルカプトベンゾチアゾール | CMBT | グリコペプタイド、ホスホペプタイド。 およびタンパク質 |
| 2,6-Dihydroxyacetophenone | DHAP | Glycopeptides, ホスホペプチド、タンパク質 |
| 2,4,6-トリヒドロキシアセトフェノン | THAP | 固体担持オリゴヌクレオチド |
| ジフラノール(1,8,9-アントラセントリオール) | なし | 合成ポリマー |
| 9-ニトロアントラセン | 9-NA | フラーレン及びその誘導体 |
| ベンゾピレン | None | Fullerenes and derivatives |
| 2-マロニトリル | DCTB | オリゴマー。 ポリマー、デンドリマー 低分子 |
飛行時間(TOF)分析装置
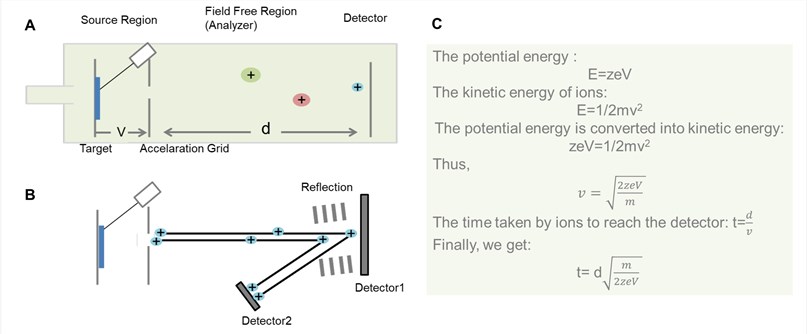
図2. TOF分析装置の一般的な回路図。
- TOFの原理
図2に示すように、TOFの基本原理は、異なるm/zのイオンが既知の長さの無電界ドリフトパスに沿って飛行する間に時間的に分散されるというものです。
- ライナーTOF分析器とリフレクトロンTOF分析器
理論的には、すべてのイオンに同じ初期運動エネルギーが与えられているので、無電界領域を漂った後、同じm/zのイオンが同時に検出器に到達することになります。 しかし、実際には、すべてのイオンが同じ強度のパルスを感じることはできず、同じm/z値のすべてのイオンが理想的な速度に到達するわけではありません。 この問題を修正するために、ドリフトゾーンの端にリフレクターを適用することが多い。
異なる運動エネルギーのイオンは、リフレクトロンから反対方向に放出される前に、異なる深さまでリフレクトロンを透過します。
運動エネルギーの異なるイオンは、リフレクトロンを透過して異なる深さに到達した後、リフレクトロンから逆方向に排出されます。運動エネルギーの大きい高速イオンは、低速イオンよりも長い経路を通るため、リフレクトロン内での滞在時間が長くなります。 このようにして、検出器は同じ質量のイオンを(ほぼ)同時に受け取ることができます。 このようにして、TOF質量分析計の分解能を大幅に向上させることができた。
MALDI-TOF質量分析法のプロセス
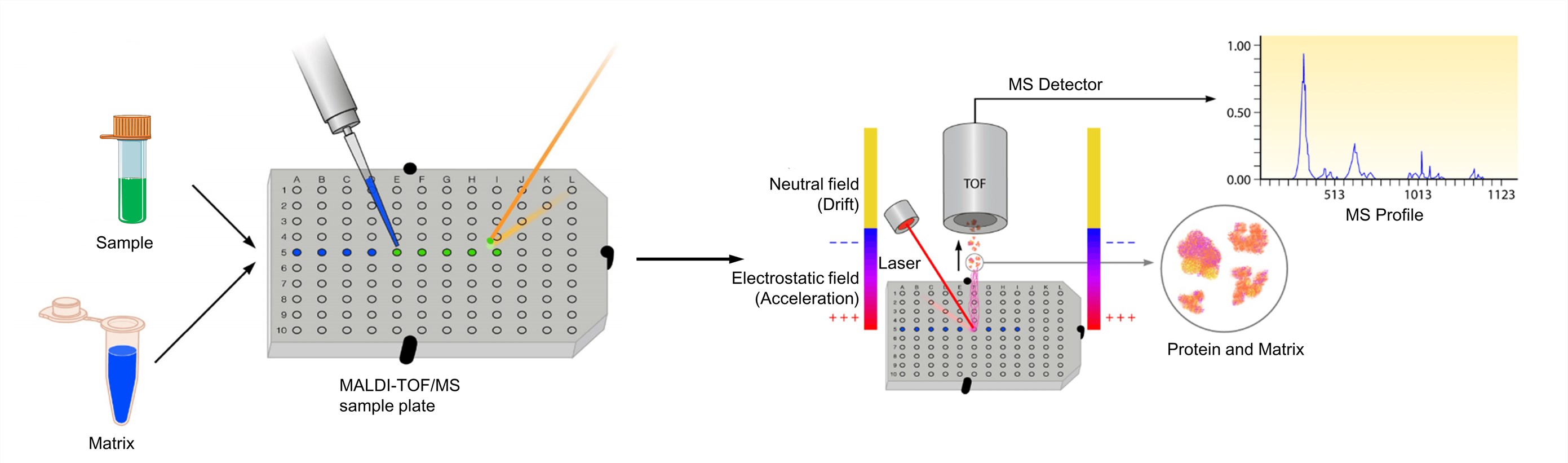
図3. MALDI-TOF質量分析のプロセス(Clark A. E., et al.; 2013)
分析対象物は、何らかの溶媒に少なくとも約0.1mg/mlまで溶解している必要があります。 そして、マトリックスを溶解して、飽和溶液または約10mg/mlの濃度のいずれかを得る。 そして、分析対象物の溶液とマトリックスの溶液を混ぜ合わせます。 最適なMALDIスペクトルを得るために、マトリックスと分析物のモル比は、通常、1000:1から100,000:1の範囲になるように調整される。 そして、その混合物を金属製のターゲットプレートにスポットして分析します。 乾燥後、サンプルとマトリックスの混合物は共結晶化し、マトリックスに埋め込まれたサンプルの固体堆積物を形成する。 その後、プレートはMALDI-TOF装置に装填され、それぞれのシステムに関連するソフトウェアによって分析される。 MALDIによって、サンプルとマトリックスの両方が昇華し、イオン化します。 これらの生成されたイオンは、TOF分析器によってm/zに応じて分離され、これらのイオンのスペクトル表現が生成され、MSソフトウェアによって分析され、MSプロファイルが生成されます。
MALDI-TOF質量分析の応用
- インタクトマスの決定
インタクトマスの決定は、タンパク質の正しい分子量がそのままの構造を示すことができるため、タンパク質の特性評価にとって基本的かつ重要です。 ソフトなイオン化法であるMALDIは、他のイオン化法では壊れやすく断片化しやすいタンパク質に適しています。 MALDI-TOF MSの性能は、緩衝剤、洗剤、汚染物質などの影響を受けにくい。 さらに、MALDI-TOF MSは、配列の検証に十分な精度(500ppm以下)で、インタクトなタンパク質の質量を測定することができます。
- Peptide mass fingerprinting (PMF)
MALDI-TOF質量分析法は、操作が簡単で、質量精度が高く、分解能や感度も高いため、広く普及しています。 そのため、プロテオミクスの分野では、ペプチドマスフィンガープリンティングと呼ばれる方法で、単純な混合物からタンパク質を同定する方法が広く使われています。この方法は、二次元ゲル電気泳動(2-DE)と一緒に使われることが多いです。 この方法では、対象となるタンパク質をトリプシンなどの配列特異的な酵素で消化してペプチドを生成します。 そして、MALDI-TOF質量分析計でペプチドを分析し、ペプチドの質量を求めます。
- Post Source Decay (PSD) MALDI-TOF分析
リフレクターを搭載したMALDI-TOF質量分析計では、飛行中に自然分解したプリカーサーイオンから生成したフラグメントイオンを分析することができます。 このようなイオンは一般的にメタスタブルイオンと呼ばれ、イオン源とリフレクトロンの間の無電界領域での分解プロセスは一般的にPSDと呼ばれます。 PSDのフラグメントイオンは、リフレクトロンに入る前の無電界領域で形成される。 PSDフラグメントイオンは、リフレクトロンの電圧を連続的に変化させることで、検出器上で分離、収集、記録され、PSDマススペクトルを形成します。PSDマススペクトルは、ペプチドやタンパク質の一次構造に関する非常に豊富で効果的な構造情報を提供します。 プロテオミクス研究では、2DEで分離したタンパク質サンプルの中には、PMFで同定できないものや、同定結果が明確でないものがあります。 このようなタンパク質の同定には、PSDシークエンス機能が適用できます。
- オリゴヌクレオチド解析
分子生物学技術やアンチセンス核酸医薬品技術の発展に伴い、プライマーやプローブ、アンチセンス医薬品として使用されるオリゴヌクレオチド断片が次々と合成されています。 これらの断片を迅速に検出して、合成が完了したかどうか、合成された配列が正しいかどうかを判断することが全く必要である。 そのためには、MALDI-TOF-MSをはじめとする質量分析計が圧倒的に優れている。 MALDI-TOF-MSを用いたオリゴヌクレオチド分析は、シンプルで迅速、正確かつ高感度であり、完全なオリゴヌクレオチドの配列を決定するために使用することができます。
- MALDIイメージング
MALDI-TOFは、MALDIイメージング質量分析法(MALDI-IMS)として知られる、薄い組織切片から直接タンパク質をプロファイリングおよびイメージングする際に使用することができます。 また、MALDI-TOFは、MALDI imaging mass spectrometry (MALDI-IMS)として知られています。
MALDI-TOF質量分析計は、ペプチド、タンパク質、炭水化物、オリゴヌクレオチドなどの多種多様な生体分子を分析することができ、1回の測定で複数の未知の化合物を同時に分析することができます。 形成されたイオンは内部エネルギーが低いため、ソフトイオン化の過程で、イオン化した分子をほとんど断片化せずに観察することができ、混合物の中でも分析対象物の分子イオンを同定できることが、MALDI-TOFの大きな利点です。 また、高速でデータを取得できるため、使用やメンテナンスが容易です。 MALDI-TOF質量分析を成功させるためには、適切なマトリックス物質を選択することが重要です。
Creative Proteomicsでは、先進的なMALDI-TOF質量分析プラットフォームをベースに、以下のような様々なサービスを提供しています。
- Molecular Mass Determination
- Peptide Mass Fingerprinting (PMF)
- Imaging Mass Spectrometry (IMS)
1. Gross J H. Mass Spectrometry: a textbook. & Business Media, 2006.
2.Boesl U. Time – of – flight mass spectrometry: 基礎の紹介。 Mass spectrometry reviews, 2017, 36(1): 86-109.
3.Guerrera I C, Kleiner O.Application of mass spectrometry in proteomics. Bioscience Reports, 2005, 25(1-2): 71-93.
4.Fuchs B, Schiller J.Application of MALD – TOF mass spectrometry in lipidomics.
4.Fuchs B, Schiller J. The Application of MALD – TOF mass spectrometry in Lipidomics.2009, 111(1): 83-98.
5. このようにして得られた結果をもとに、今後の研究に役立てていきたいと思います。
6.Kenny D J, Brown J M, Palmer M E, et al. A parallel approach to post source decay MALDI-TOF analysis.
div