エチレン化またはケト-エノール互変異性は、ケトンまたはアルデヒドを、対応するエノール(酸性条件)またはエノラート(塩基性条件)に変換するプロセスである。 このプロセスは、エステルでも発生します。 しかし、この記事ではアルデヒドとケトンに焦点を当てているので、詳細やニュアンスを伝えすぎないようにしています。
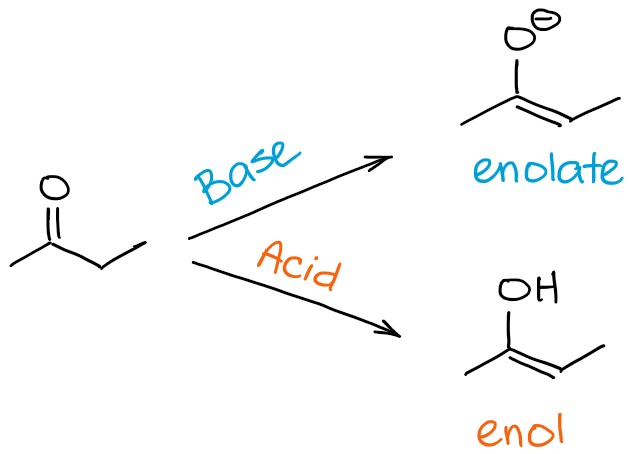
では。 エノール化とケト-エノール互変異性化のプロセスの違いは何でしょうか? 簡単に言うと、特にありません😊
エノラリゼーションというと、特にケトンやアルデヒドからエノールやエノラートになるプロセスを指します。 ケト-エノール互変異性というと、一般的には平衡状態を意味します。 したがって、私の分子がケト-エノール互変異性化を起こすと言うことで、プロセスの方向性を暗示することはあっても、それ自体を指摘することは一般的にはありません。 しかし、ケト-エノール互変異性化の方向性は、多くの場合、反応の文脈から推測することができます。
端的に言えば、分子「A」がエノール化すると言えば、「A」がエノールまたはエノラートになることを意味します。
塩基触媒によるエノラート化
エノラート化は塩基性でも酸性でも起こりますが、塩基触媒によるエノラート化の方が一般的な反応です。 したがって、まず基本的な条件でのエノール化について説明するのが良いと思います。
塩基性条件では、ケトンやアルデヒドがブレンステッド酸として働き、溶液中の塩基にα-炭素からプロトンを供与します。

この平衡状態ではカルボニルが酸として作用するので、プロトンを与えるためには十分な酸性である必要があります。 あるいは、この平衡を生成物に向かわせるためには、塩基が十分に強い必要があります。
α-炭素上の水素はどの程度酸性なのか
エノラートアニオンは共鳴的に安定化した種であるため、共鳴的安定化の程度がカルボニル化合物の酸性度に非常に重要な役割を果たします。 共役塩基の共鳴寄与者が多ければ多いほど、安定性が増すことがわかっています。 そして、共役塩基の安定性が高いほど、元の酸の酸性度は高くなります。 したがって、2つのC=O結合の間にある水素は、1つだけのC=Oの隣にある水素よりも著しく酸性になります。
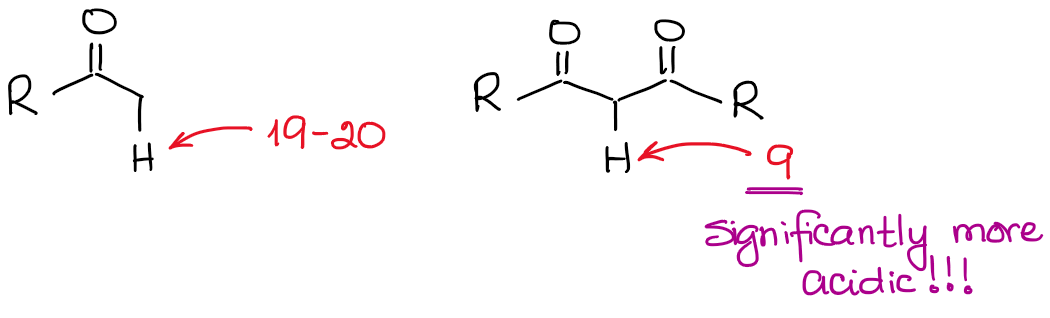
両方のケースで共役塩基を比較すると、ジカルボニル化合物のpKa値が大きいことがわかります。
両方のケースで共役塩基を比較すると、ジカルボニルの方が、より拡張された共役系によって負電荷の共鳴安定化が優れていることがわかります。
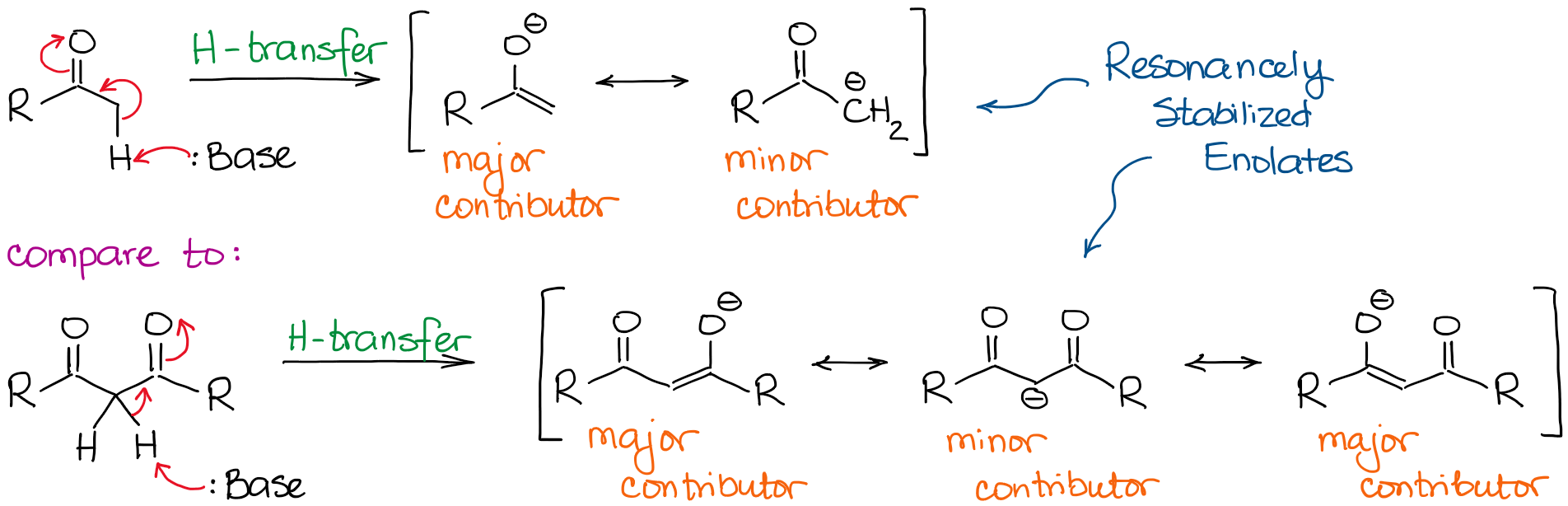
ジカルボニルアニオンの主要な共鳴寄与因子が加わることで、分子は約1億倍も酸性になります。
Effect of a Base on the Enolization Equilibrium
塩基の強さは非常に異なります。 そのため、平衡を完成に導きたい場合には、塩基の選択が重要になります。 ここでは、有機化学反応でよく見られるいくつかの塩基を見てみましょう。
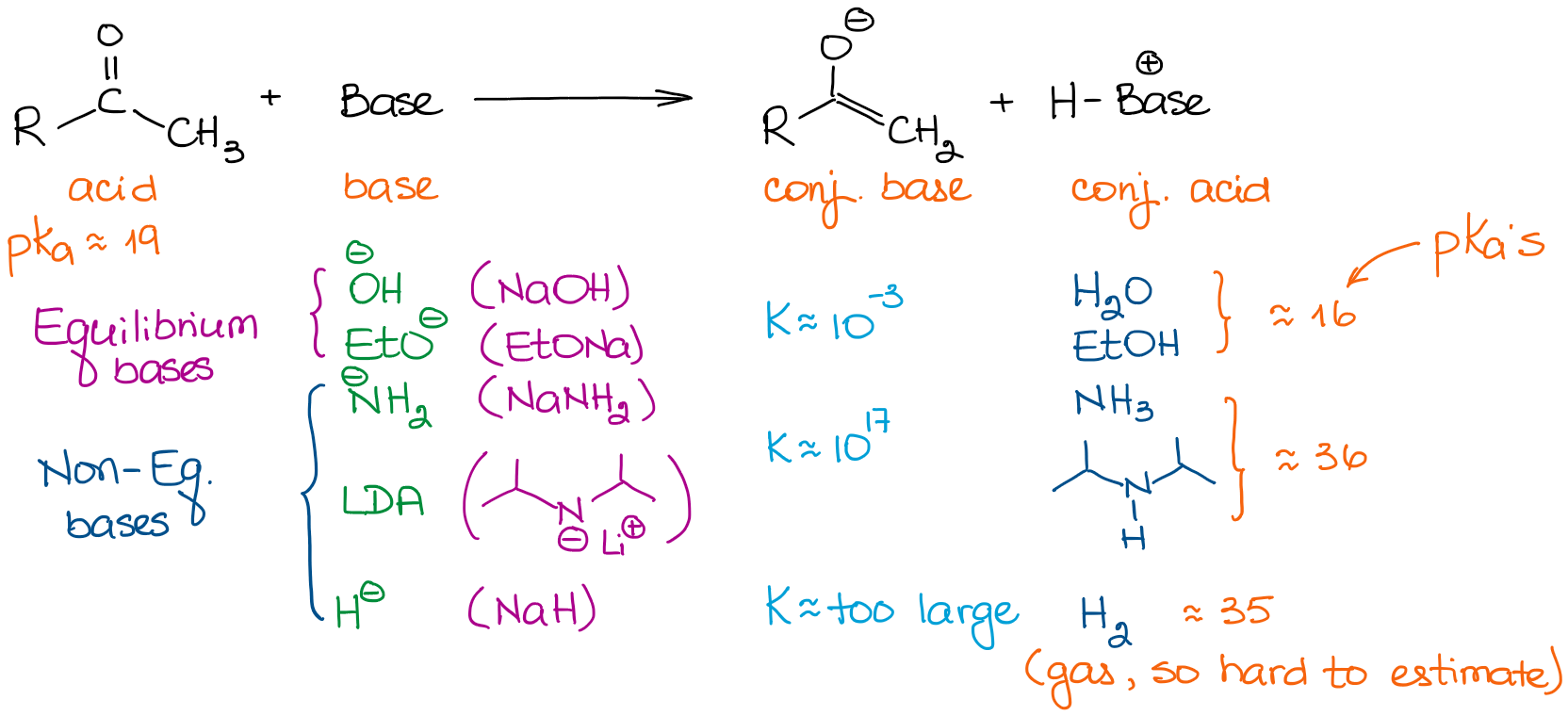
単純なアルデヒドやケトンを扱う場合,すべての塩基を2つに分類することができます。 すべての塩基を2つのカテゴリーに分類することができます。 平衡塩基と非平衡塩基です。 平衡塩基は比較的弱い。 つまり、非常に小さな範囲でしか平衡を動かすことができません。 そのため、溶液中のエノラートの実際の濃度は非常に小さくなります。 また、反応は出発物質とエノラートの間で一定の平衡状態になります。 これらの塩基は、熱力学的に安定したエノラートの形成に有利である。 これらのエノラートは熱力学的エノラートと呼ばれます。
しかし、非平衡塩基は非常に強力です。 そのため、非常に大きな平衡定数を持つプロトン移動(酸-塩基)反応が起こります。 平衡定数が103を超えると、平衡はかなりの確率で生成物の方にシフトします。 つまり、LDAのような塩基を用いたエノール化では、実質的に100%のエノール化が得られます。
C=O結合を1つ持つカルボニルとβ-ジカルボニルの比較
先に述べたように、β-ジカルボニルは通常のアルデヒドやケトンよりもかなり酸性です。 次の2つの場合の平衡定数を見てみましょう。
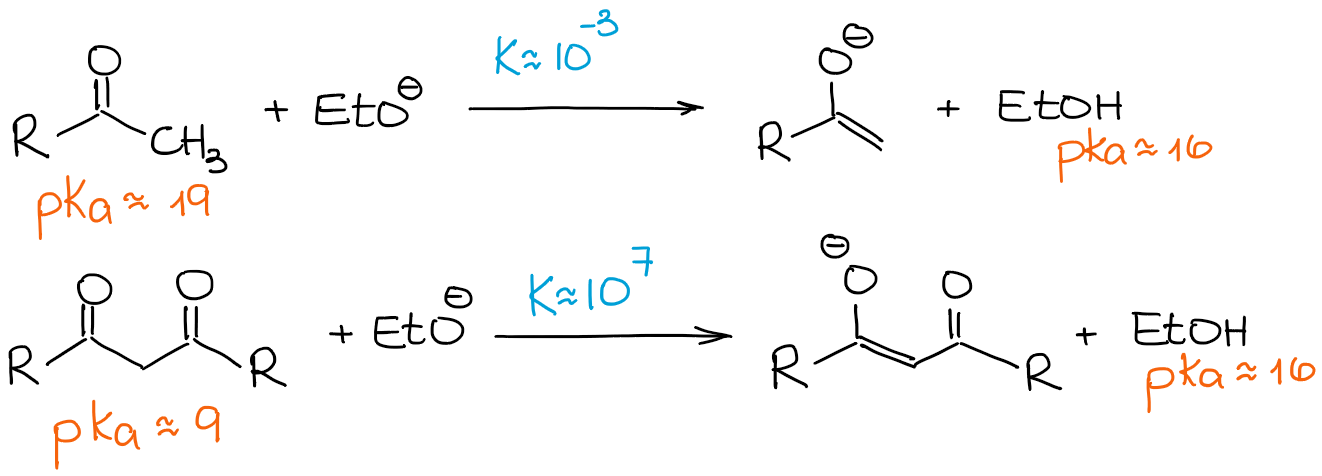
β-ジカルボニルは通常のアルデヒドやケトンに比べて非常に酸性が強いので 弱い塩基であっても、100%のエノラート化をもたらす生成物に向かって平衡が進みます。 そのため、塩基に関係なく、β-ジカルボニルのエノラート化反応を100%エノラートと0%の出発物質のプロセスとして見ることにします。
なぜ塩基の選択が重要なのか
反応の中には、溶液中の物質や反応物の濃度に非常に敏感なものがあります。 例えば、アルデヒドは求電子的で、エノラートは求核的です。 そのため、出発物質の多くを溶液中に残すような弱い非平衡塩基を使用した場合、エノラートと最初のアルデヒドとの間に望ましくない反応が起こり始めるかもしれません。 一般的に、弱い平衡塩基が使用されるのは、可能な生成物間の競合があまり期待できない場合に限られます。
大きい塩基と小さい塩基
分子内の複数のエノール化可能な位置が競合する場合、塩基のサイズはエノール化プロセスの決定要因となります。
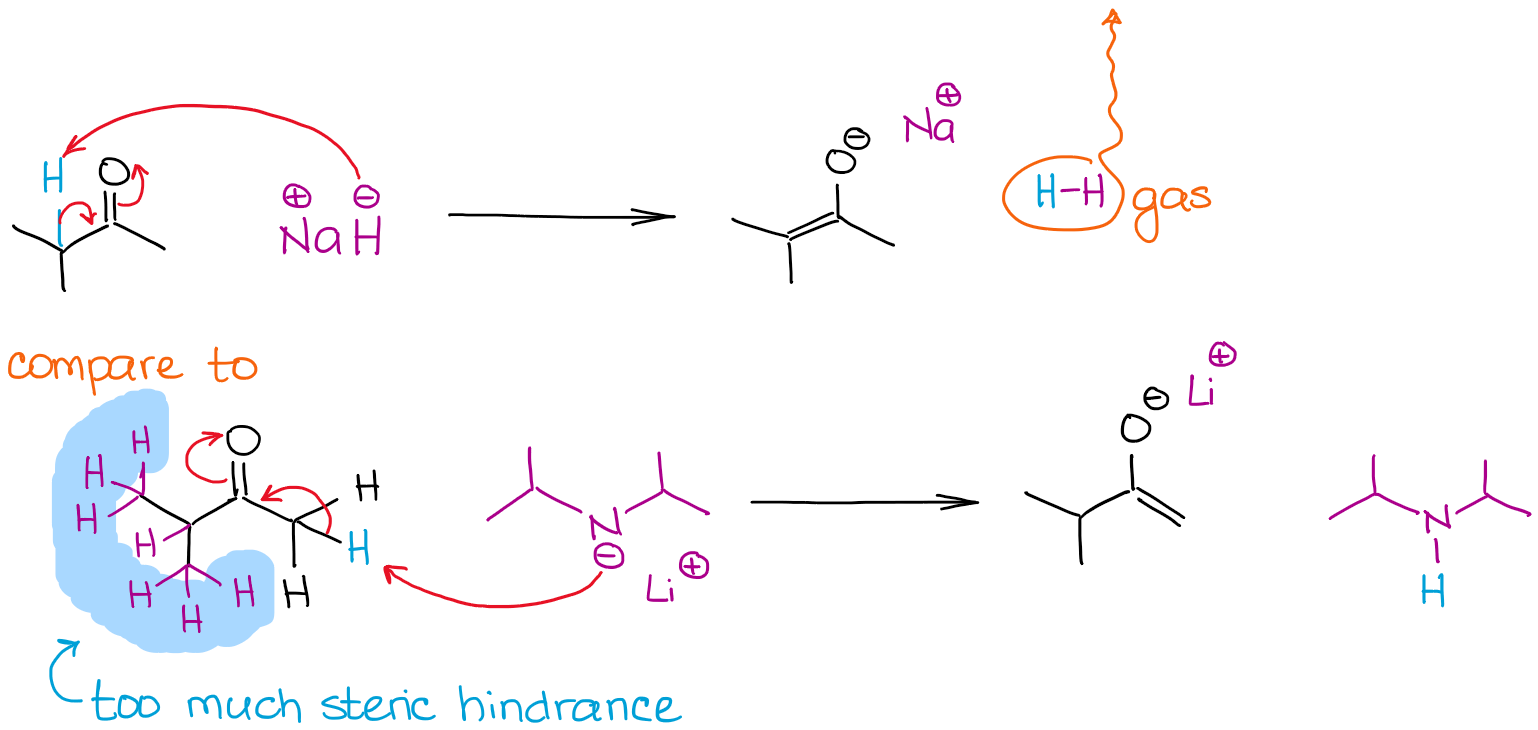
2つの反応は、非常に強い非平衡塩基を使用しているため、100%のエノール化が得られます。 しかし、水素化ナトリウム(NaH)との反応では、より熱力学的に安定なエノラートが得られます。 LDAと異なり、水素化物アニオンは非常に小さいため、より立体的に妨げられたプロトンに容易に到達し、熱力学的に安定なエノラートを与えることができます。 LDAは非常に大きな分子であるため、立体障害に対して非常に敏感です。
LDAとの反応のように、熱力学的に安定していないエノラートを、動力学的エノラートと呼んでいます。 また、ここで試薬の添加順序が関係してきます。 運動性エノラートを得るためには、必ず塩基にカルボニルを加える必要があり、その逆はありません。
熱力学的エノラートと動力学的エノラート
これまでに何度か熱力学的エノラートと動力学的エノラートについて述べてきましたが、もう少し詳しく説明したほうがいいかもしれません。
エノラートの主な共鳴寄与者は、酸素原子に負の電荷を持ち、C=C結合が二重になっています。
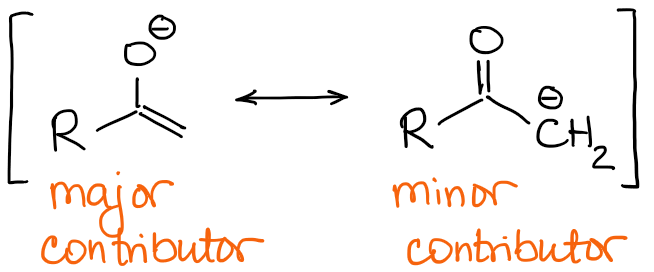
従って、二重結合の性質がエノラートの主な違いとなります。 先ほどの2-メチルブタノンの例を振り返ってみると、2つの可能なエノラートが質的に異なる二重結合を持っていることがわかります。

常に二重結合上の置換基の数に注目しましょう。 二重結合上の置換基の数が多いほど、より安定しています。 したがって、熱力学的エノラートは常に最も忙しい二重結合を持つことになります。
動力学的エノラートは、より早く形成されるものです。 LDAとの反応を考えてみましょう。 LDAは非常に強い非平衡塩基です。 プロトンを奪うとすぐにそれを返すことはできません。 また、LDAは非常にかさばる塩基で、分子の真ん中から水素をつかむことはできません。 そのため、より立体的にアクセスしやすいものを狙うことになります。
運動性エノラートを作るために、塩基にカルボニルを加えることが重要なのはなぜですか?
運動性エノラートを作りたい場合、塩基は常に過剰でなければなりません。 エノラートは塩基そのものです。 ですから、カルボニルが過剰であれば、エノラートはすぐにそれと平衡を保つことができます。
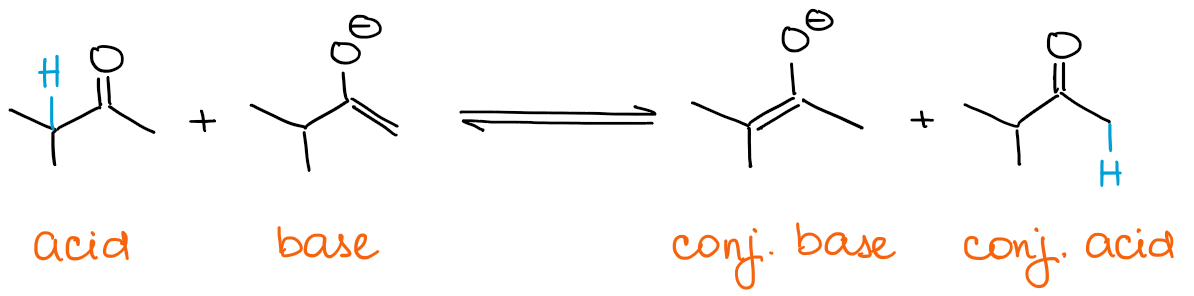
どのような平衡であっても、熱力学的に安定した種が常に有利になります。
弱くて小さい強塩基=熱力学的エノラート
大きい強塩基=運動学的エノラート
この単純な経験則を使用すると、反応でどのエノラートを持つことになるか、または作る必要があるかを決定するのに役立ちます。
酸触媒によるエノラート化
この記事の最初の方で、エノラート化は酸性の条件でも可能であると述べました。 アルデヒドやケトンは特に塩基性ではないので、このプロセスを触媒するには非常に強い酸を使用する必要があります。 一般的には、硫酸やトシル酸を触媒として使用します。
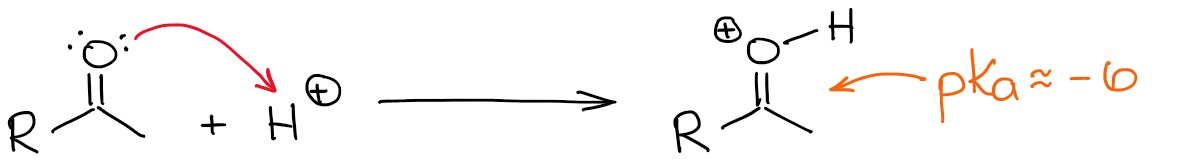
プロトン化したカルボニルの中で最も酸性の水素は、もちろん酸素の上にある水素です。 しかし、C=O結合にプロトンを付加して極性を高めると、α位も酸性になります。 そのため、α位を脱プロトン化してエノールを作ることが多少容易になったのです。
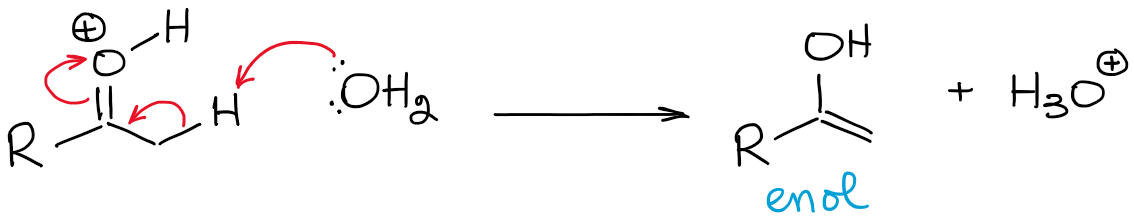
この平衡は非常に不利で、全体的にカルボニルに有利です。
すべての可能なエノール生成物が生成される一方で、この反応は常に熱力学的エノールの生成を好むことになります。
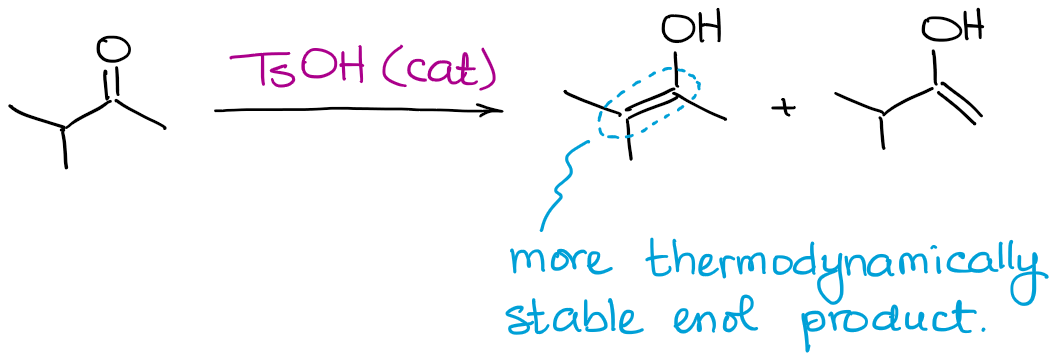
エノラートの場合と同じです。 熱力学的に安定したエノールとは、二重結合に多くの置換基を持つものです。
酸触媒によるエノラート化に影響を与える要因
エノラートをより安定させることができるものはすべて、平衡を助けることになります。 最も一般的な要因は、水素結合と拡張共役です。
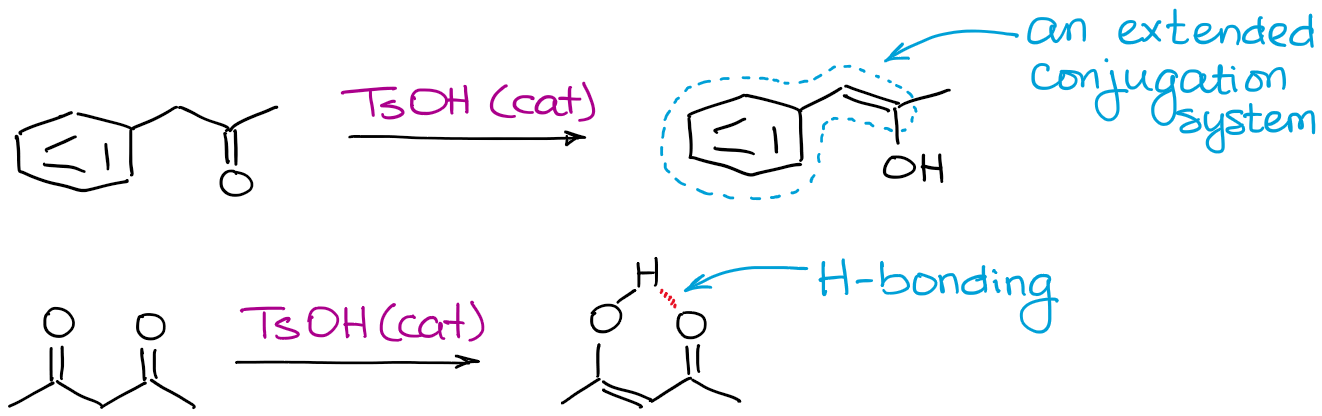
なぜわざわざ酸触媒によるエノール化をするのか?
酸触媒によるエノール化には多くの問題がありますが、なぜわざわざ行うのでしょうか?
あなたの化合物は塩基に弱いかもしれません。 また、複数のステップが同じ条件で起こる場合は、組み合わせた方が簡単かもしれません。 私たちは、酸触媒によるエノラート化を、同じく酸性条件で起こる反応の他のステップと組み合わせることがよくあります。
ただし、カルボニルの近くに電子吸引性の基があると、カルボニルの塩基性度がさらに低くなることに留意しなければなりません。 ですから、例えばα位にハロゲンがある場合、エノールの形成を強制するのは本当に難しいでしょう。

エノールの生成を想定する前に、必ずα位にEWGがあるかどうかを確認してください。の位置にEWGがあるかどうかを必ず確認してください!エノール形成を想定する前に。
What to Expect on the Exam?
教授がエノールやエノラートの生成を直接ターゲットにした質問をすることはほとんどありません。 エノール化の問題は、常に何か他のものを装って出題されます。
- 次の分子の中で最も酸性の水素を見つけてください…または
- 生成物を描いてください…(反応は中間体としてエノールまたはエノラートを持つことになります)
もちろん、直接質問されることもあるでしょう。 しかし、私の経験では、ケト-エノールの互変異性化やエノラート化は、たいていの場合、ある質問を駆動する基礎的な概念となっています。