Motilität ist die Fähigkeit eines Organismus, sich mittels propellerartiger Geißeln, die es nur bei Bakterien gibt, oder mittels spezieller Fibrillen, die eine gleitende Form der Motilität erzeugen, selbst zu bewegen. Motile Bakterien bewegen sich mit Hilfe von Geißeln, fadenförmigen Fortbewegungsanhängseln, die sich von der Plasmamembran und der Zellwand nach außen erstrecken, entweder mit einem einzelnen Flagellum oder mit mehreren Geißeln. Motilität ist seit langem als wichtiges taxonomisches Werkzeug und biologisches Merkmal von Mikroorganismen anerkannt. Das Vorhandensein von Geißeln tritt hauptsächlich bei Bazillen auf, aber es gibt auch einige wenige gegeißelte Kokken, so dass Motilität ein sehr wichtiges Mittel zur Identifizierung in der Familie der Enterobacteriaceae ist. Seit den Anfängen der Mikrobiologie wird die Fähigkeit von Bakterien, sich zu bewegen, als Mittel zur Differenzierung und Klassifizierung von Organismen verwendet.
Zielsetzung
- Die Motilität von Bakterien zu bestimmen.
- Zwischen motilen und nicht motilen Bakterien zu unterscheiden.
Prinzip
Motilität von Bakterien wird meist in einem halbfesten Agarmedium nachgewiesen. In halbfesten Agarmedien „schwärmen“ bewegliche Bakterien und zeigen ein diffuses, sich ausbreitendes Wachstum, das mit bloßem Auge leicht zu erkennen ist.
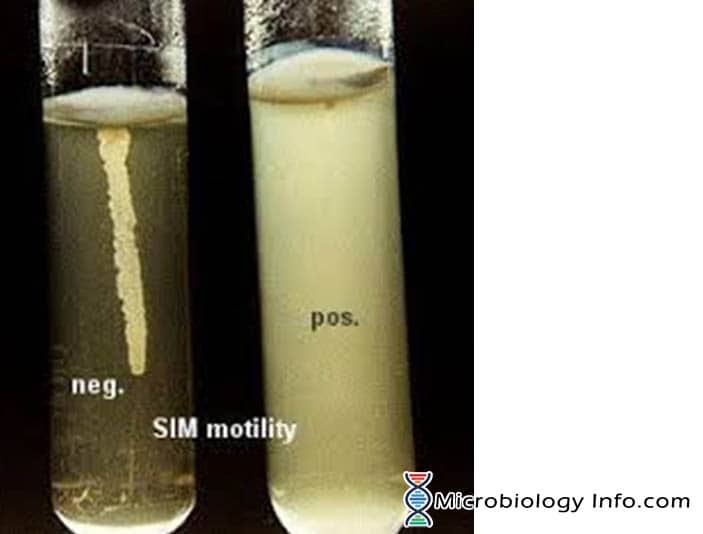
Das Medium, das hauptsächlich für diesen Zweck verwendet wird, ist das SIM-Medium (Sulphide Indole Motility Medium), ein Kombinations-Differenzialmedium, das drei verschiedene Parameter testet: Schwefelreduktion, Indolproduktion und Motilität. Dieses Medium hat eine sehr weiche Konsistenz, die es den beweglichen Bakterien ermöglicht, leicht hindurchzuwandern und eine Trübung zu verursachen. Das Inokulum wird in die Mitte eines halbfesten Agars tief eingestochen. Die bakterielle Motilität zeigt sich durch eine diffuse Wachstumszone, die sich von der Inokulationslinie aus erstreckt. Einige Organismen wachsen auf dem gesamten Medium, während andere kleine Bereiche oder Knötchen zeigen, die von der Inokulationslinie auswachsen. Die unbeweglichen Bakterien wachsen nur in der weichen Agarröhre und nur in dem Bereich, in dem sie beimpft werden.
Medien:
SIM Medium
Pankreatischer Verdau von Kasein 20,0g, Peptischer Verdau von tierischem Gewebe 6,1g, Agar 3,5g, Fe(NH4)2(SO4)2-6H2O 0.2g, Na2S2O3-5H2O 0.2g, pH 7.3 ± 0.2 bei 25°C
Methode
- Stechen Sie mit einer geraden Nadel in eine Kolonie einer jungen (18- bis 24-stündigen) Kultur, die auf Agarmedium wächst.
- Stechen Sie einmal bis zu einer Tiefe von nur 1/3 bis ½ Zoll in der Mitte des Röhrchens. Achten Sie darauf, die Nadel in der gleichen Linie zu halten, in die sie eingedrungen ist, wenn sie aus dem Medium entfernt wird.
- Inkubieren Sie bei 35°-37°C und untersuchen Sie täglich für bis zu 7 Tage.
- Achten Sie auf eine diffuse Wachstumszone, die sich von der Inokulationslinie ausbreitet.
Erwartete Ergebnisse
- Positiv: Diffuses, trübes Wachstum, das sich im gesamten Medium ausbreitet und es leicht undurchsichtig macht.
- Negativ: Wachstum, das auf die Stechlinie beschränkt ist, mit scharf definierten Rändern und das umgebende Medium klar transparent lassend.
Anwendungen
- Er wird zur Differenzierung von Mikroorganismen auf der Basis der Motilität in einer Laborumgebung verwendet.
- Er wird durchgeführt, um Organismen eine taxonomische Klassifizierung zuzuordnen.
- Motilitätstests sind wichtig bei der Charakterisierung von Krankheitserregern.
- Die Tests werden häufig in Identifizierungsprotokollen in der Familie Enterobacteriaceae eingesetzt
- Motilitätstest wird auch für die Artdifferenzierung von grampositiven Kokken, Enterokokken verwendet. Enterococcus faecium und E. faecalis sind unbeweglich, während E. gallinarum und E. casseliflavus/E. flavescens im Allgemeinen beweglich sind.
Grenzwerte
- Einige Organismen zeigen in diesem Medium kein ausreichendes Wachstum, um eine genaue Bestimmung vorzunehmen, und es sind zusätzliche Folgetests erforderlich.
- Es wird empfohlen, für eine vollständige Identifizierung biochemische, immunologische, molekulare oder massenspektrometrische Tests an Kolonien aus Reinkulturen durchzuführen.
- Falsch-negative Reaktionen können auftreten, wenn bakterielle Geißeln durch Erhitzen, Schütteln oder andere Traumata beschädigt werden. Ein solcher Umgebungsschock macht den Organismus unbeweglich.
- Organismen, die schwach beweglich sind, können zu falsch-negativen Reaktionen führen.
- Beim Beim Beimpfen von halbfesten Medien ist es wichtig, dass die Beimpfnadel genau entlang der Linie entfernt wird, die zum Beimpfen des Mediums verwendet wurde. Eine auffächernde Bewegung kann zu einem Wachstum entlang der Einstichlinie führen, was zu einer falsch-positiven Interpretation führen kann.
- Tille, P. M., & Forbes, B. A. (2014). Bailey & Scott’s diagnostic microbiology (Thirteenth edition.). St. Louis, Missouri: Elsevier.
- Cappuccino J.G. und Sherman N. 2008. Microbiology: A Laboratory Manual, 8th ed. Pearson Benjamin Cummings, San Francisco, CA, USA.
- vlab.amrita.edu/?sub=3&brch=73&sim=697&cnt=1
- www.asmscience.org/content/education/protocol/protocol.3658
- https://catalog.hardydiagnostics.com/cp_prod/Content/hugo/MotilityTestMedia.htm