N-Bromsuccinimid (NBS) ist ein Bromierungs- und Oxidationsmittel, das als Quelle für Brom in radikalischen Reaktionen (z.B.: allylische Bromierungen) und verschiedenen elektrophilen Additionen verwendet wird. Die NBS-Bromierung von Substraten wie Alkoholen und Aminen, gefolgt von der Eliminierung von HBr in Gegenwart einer Base, führt zu den Produkten der Nettooxidation, in die kein Brom eingebaut wurde.
Benannte Reaktionen
Wohl-Ziegler-Reaktion
Aktuelle Literatur

Ein effizientes undfreundliches Verfahren wurde für die oxidative Entschützung von Tetrahydropyranyl (THP)-Ethern mitN-Bromsuccinimid (NBS) unter Verwendung von β-Cyclodextrin (β-CD) in Wasser entwickelt. Eine Reihe von Tetrahydropyranylethern wurde bei Raumtemperatur in beeindruckenden Ausbeuten oxidativ deprotektiert.
M. Narender, M. S. Reddy, K. R. Rao, Synthesis, 2004,1741-1743.

N-Alkoxyamide liefern in Gegenwart von NBS in Toluol über oxidative Homokupplung und anschließende thermische Denitrogenierung bequem die entsprechenden Carbonsäureester. Selbst Substrate, die einen sperrigen oder langkettigen Substituenten tragen, lieferten bei diesem bequemen und ökonomischen Ansatz zur direkten Umwandlung einer Alkoxyamid-Einheit in die Carbonsäureesterfunktion Produkte in guten Ausbeuten.
N. Zhang, R. Yang, D. Zhang-Negrerie, Y. Du, K. Zhao, J. Org. Chem, 2013,78, 8705-8711.

Direkte Transformation von Ethylarenen in primäre aromatische Amide mit N-Bromsuccinimid und I2-wässrigem NH3
S. Shimokawa, Y. Kawagoe, K. Moriyama, H. Togo, Org. Lett. 2016, 18, 784-787.

Eine effiziente, metall- und basenfreie, chemoselektive Reaktion von Boronsäuren mit Cyanamidyl/Arylcyanamidyl-Radikalen liefert primäre Aryl-, Heteroaryl- und Alkylamine bei Raumtemperatur innerhalb von 1 h. Die Reaktion wird durch PIFA und NBS vermittelt.
N. Chatterjee, M. Arfeen, P. V. Bharatam, A. Goswami, J. Org. Chem., 2016,81, 5120-5127.
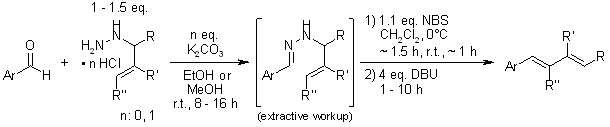
Die stereoselektive Synthese von Dienen aus Aldehyden und N-Allylhydrazin-Derivaten bietet eine hohe (E)-Stereoselektivität für eine Vielzahl von Substraten. Die Zugabe eines Dienophils zum Reaktionsgemisch ermöglicht eine Ein-Flaschen-Dien-Synthese-Cycloaddition-Sequenz.
D. A. Mundal, K. E. Lutz, R. J. Thomson, Org. Lett, 2009,11, 465-468.

Eine effiziente Eintopf-Transformation von β-Hydroxycarbonylverbindungen zu α-bromierten 1,3-Dicarbonylverbindungen wird mit MoO2Cl2 in Gegenwart von N-Bromsuccinimid erreicht. Alle Reaktionen wurden unter milden Bedingungen durchgeführt und liefern gute Ausbeuten. An benzylischen und allylischen Positionen tritt keine Bromierung auf.
K. Jeyakumar, D. K. Chand, Synthesis, 2009, 306-310.

K. Jeyakumar, D. K. Chand, Synthesis, 2009, 306-310.

Selektive Oxyhalogenierungen von Alkinen wurden in Wasser unter sehr milden Bedingungen in Gegenwart von kostengünstigen Halogenierungsreagenzien, wie N-Bromsuccinimid und N-Chlorsuccinimid, und FI-750-M als Amphiphil erreicht. Es wurde keine Halogenierung an den aromatischen Ringen nachgewiesen. Reaktionsmedium und Katalysator können recycelt werden.
L. Finck, J. Brals, B. Pavuluri, F. Gallou, S. Handa, J. Org. Chem. 2018, 83, 7366-7372.

Eine Triphenylphosphinoxid-katalysierte reduktive Halogenierung eines α,β-ungesättigten Ketons mit Trichlorsilan als reduzierendem Reagenz und einem N-Halogensuccinimid als elektrophiler Halogenquelle ermöglicht eine selektive Synthese von unsymmetrischen α-Halogenketonen.
Z. Lao, H. Zhang, P. H. Toy, Org. Lett. 2019, 21, 8149-8152.

Zuverlässige, operativ einfache, katalytische α-selektive Hydroaluminierungsreaktionen laufen in Gegenwart von Diisobutylaluminiumhydrid und (Ni(dppp)Cl2) ab und erzeugen, im Gegensatz zu unkatalysierten Transformationen, wenig oder keine Alkinylaluminium-Nebenprodukte. Die abgeleiteten α-Vinylhalogenide und Boronate können durch direkte Behandlung mit den entsprechenden Elektrophilen synthetisiert werden.
F. Gao, A. H. Hoveyda, J. Am. Chem. Soc., 2010, 132, 10961-10963.

Das intermolekulare Einfangen einer Diazospezies durch zwei unabhängige Ionenspezies im Tandem am Carbenzentrum installiert ein Elektrophil und ein Nukleophil am selben Kohlenstoff. Dieses metallfreie Konzept ermöglicht regioselektive Synthesen von verschiedenen Vinylhalogeniden, Vinylsulfonen und Alkinderivaten.
D. P. Ojha, K. R. Prabhu, Org. Lett., 2015,17, 18-21.

Ungesättigte Verbindungen wie Alkene, Alkine, Allene und Methylencyclopropane (MCP) können mit NBS und Lithiumbromid in THF bei Raumtemperatur innerhalb von Minuten in guten bis exzellenten Ausbeuten unter milden Bedingungen dibromiert werden.
L.-X. Shao, M. Shi, Synlett, 2006, 1269-1271.

L.-X. Shao, M. Shi, Synlett, 2006, 1269-1271.

L.-X. Shao, M. Shi, Synlett, 2006, 1269-1271.

Die Verwendung von N-Bromsuccinimid ermöglicht eine metallfreie Eintopfstrategie zur Synthese von pharmazeutisch wichtigen α-Aminoketonen aus leicht verfügbaren benzylischen sekundären Alkoholen und Aminen. Diese Reaktion verläuft über drei aufeinanderfolgende Schritte mit Oxidation der Alkohole, α-Bromierung der Ketone und nukleophiler Substitution der α-Bromketone zu α-Aminoketonen.
S. Guha, V. Rajeshkumar, S. S. Kotha, G. Sekar, Org. Lett. 2015,17, 406-409.

Die Kombination von N-Bromimid und DBU ermöglicht allylische Aminierungsreaktionen von Alkenen, bei denen sowohl interne als auch externe Stickstoff-Nukleophile direkt eingesetzt werden können. Die duale Aktivierung von NBS oder NBP durch DBU führt zu mehr elektrophilen Brom- und mehr nucleophilen Stickstoffatomen gleichzeitig. Dieses Protokoll bietet einen komplementären Zugang zur allylischen Aminierung unter milden Bedingungen.
Y. Wei, F. Liang, X. Zhang, Org. Lett. 2013,15, 5186-5189.

Eine komfortable und effiziente Methode zur Aminobromierung von Alkylidencyclopropanen wird berichtet. Dies wird am Beispiel der stereoselektiven Herstellung von N–p-Toluolsulfonamiden unter Verwendung von p-Toluolsulfonamid und N-Bromsuccinimid (NBS) als Stickstoff- bzw. Bromquelle gezeigt.
X. Huang, W.-J. Fu, Synthesis, 2006, 1016-1017.

In einem kontinuierlichen Durchflussprotokoll für die Bromierung von Benzylverbindungen mit nur einem geringen Überschuss an N-Bromsuccinimid wurden die Radikalreaktionen mit einer leicht erhältlichen Haushalts-Kompaktleuchtstofflampe (CFL) unter Verwendung eines einfachen Durchflussreaktordesigns auf der Basis von transparenten fluorierten Ethylenpolymerschläuchen aktiviert. Alle Reaktionen wurden mit Acetonitril als Lösungsmittel durchgeführt, wodurch gefährliche chlorierte Lösungsmittel wie CCl4 vermieden wurden.
D. Cantillo, O. de Frutos, J. A. Rincon, C. Mateos, C. O. Kappe, J. Org. Chem., 2014,79, 223-229.

Die Lewis-Base Trip-SMe (Trip = Triptycenyl) katalysiert eine elektrophile Halogenierung von nicht aktivierten aromatischen Verbindungen mit N-Halogensuccinimiden (NXS) bei Raumtemperatur in Gegenwart von AgSBF6 als Quelle eines nicht-koordinierenden Anions. Das π-System der Triptycenyl-Funktionalität übt eine entscheidende Rolle für die Verstärkung der Elektrophilie aus.
Y. Nishii, M. Ikeda, Y. Hayashi, S. Kawauchi, M. Miura, J. Am. Chem. Soc., 2020, 142, 1621-1629.

Eine hochregioselektive Bromierung aktivierter aromatischer Verbindungen wurde mit N-Bromsuccinimidein Tetrabutylammoniumbromid durchgeführt. Vorherrschende paraselektive Monobromierung von aktivierten Aromaten, Ratenbeschleunigung für weniger reaktive Substrate bei Zugabe von saurem Montmorillonit K-10-Ton, mit oder ohne Mikrowellenunterstützung, sind die bemerkenswerten Merkmale dieses Protokolls.
N. C. Ganguly, P. De. S. Dutta, Synthesis, 2005, 1103-1108.

Die Verwendung von Hexafluorisopropanol als Lösungsmittel ermöglicht eine milde und regioselektive Halogenierung eines breiten Spektrums von Arenen und Heterocyclen mit N-Halogensuccinimiden in guten Ausbeuten. Darüber hinaus wird die Vielseitigkeit der Methode durch die Entwicklung von sequenziellen Ein-Topf-Dihalogenierungen und Halogenierungs-Suzuki-Kreuzkupplungsreaktionen demonstriert.
R.-J. Tang, T. Milcent, B. Crousse, J. Org. Chem. 2018, 83, 930-938.

Eine hochparaselektive Halogenierung von Arenen, die elektronenspendende Koordinationsgruppen tragen, in Gegenwart eines Dimidazoliumsalzes führt zu p-Halogenoarenen in guten Ausbeuten. Ein plausibler Mechanismus für die katalytische Reaktion wird vorgeschlagen.
J. Chen, X. Xiong, Z. Chen, J. Huang, Synlett, 2015, 26, 2831-2834.

Hochgradig desaktivierte aromatische Verbindungen wurden durch Behandlung mit N-Bromsuccinimid (NBS) in konzentrierter Schwefelsäure reibungslos monobromiert. Milde Reaktionsbedingungen und einfache Aufarbeitung bieten einen praktischen und kommerziell nutzbaren Weg für die Synthese von Bromverbindungen deaktivierter Aromaten in guten Ausbeuten.
K. Rajesh, M. Somasundaram, R. Saiganesh, K. K. Balasubramanian, J. Org. Chem., 2007,72, 5867-5869.

N-Halogensuccinimide werden effizient in Trifluormethansulfonsäure und BF3-H2O aktiviert, was die Halogenierungen von deaktivierten Aromaten ermöglicht. BF3-H2O ist wirtschaftlicher, einfach herzustellen, nicht oxidierend und bietet eine ausreichend hohe Acidität.
G. K. S. Prakash, T. Mathew, D. Hoole, P. M. Esteves, Q. Wang, G. Rasul, G. A. Olah, J. Am. Chem. Soc., 2004,126, 15770-15776.

Aryl- und Heteroaryl-Boronsäuren reagieren mit N-Iodsuccinimid und N-Bromsuccinimid zu den entsprechenden Iod- und Brom-Arenen in guten bis sehr guten Ausbeuten. Die Reaktion ist in der Regel hoch regioselektiv und liefert nur das ipso-substituierte Produkt.
C. Thiebes, G. K. Surya Prakash, N. A. Petasis, G. A. Olah, Synlett, 1998, 141-142.

Eine hochausbeuterische, allgemeine und praktische ortho-Bromierungs- und Iodierungsreaktion verschiedener Klassen von aromatischen Verbindungen erfolgt durch Rh(III)-katalysierte C-H-Bindungsaktivierung.
N. Schröder, J. Wencel-Delord, F. Glorius, J. Am. Chem. Soc., 2012, 134, 8298-8301.

Unter Verwendung von Cyano als Leitgruppe ergab eine Palladium-katalysierte ortho-Halogenierungsreaktion (I, Br, Cl) gute bis ausgezeichnete Ausbeuten. Die Methode ist kompatibel zu Arylnitrilen mit entweder elektronenziehenden oder elektronenabgebenden Gruppen. Die vorliegende Methode wurde erfolgreich auf die Synthese der Vorstufen von Paucifloral F und Isopaucifloral F angewendet.
B. Du, X. Jiang, P. Sun, J. Org. Chem., 2013,78, 2786-2791.

Ein effizientes Protokoll für eine hoch stereoselektive Eintopfsynthese von (E)-β-Arylvinyliodiden und (E)-β-Arylvinylbromiden aus Styrolen basiert auf einer Ruthenium-katalysierten silylativen Kopplung gefolgt von einer N-Halogensuccinimid-vermittelten Halodesilylierungsreaktion.
P. Pawluć, G. Hreczycho, J. Szudkowska, M. Kubicki, B. Marciniec, Org. Lett., 2009,11, 3390-3393.

Unter Verwendung von Triethylamin als Katalysator in Hunsdiecker-Reaktionen mit N-Halogensuccinimiden als Br+- oder I+-Quelle werden Zimtsäuren und Propiolsäuren in guten isolierten Ausbeuten innerhalb von 1-5 min in die entsprechenden α-Halostyrole und 1-Halogen-1-Alkine überführt.
J. Prakash, S. Roy, J. Org. Chem., 2002, 67, 7861-7864.

J. Prakash, S. Roy, J. Org. Chem., 2002, 67, 7861-7864.

(E)-β-Arylvinylbromide wurden in kurzer Reaktionszeit (1-2 min) durch Mikrowellenbestrahlung der entsprechenden3-Arylpropensäuren in Anwesenheit von N-Bromsuccinimid und acatalytischer Menge Lithiumacetat leicht hergestellt.
C. Kuang, Q. Yang, H. Senboku, M. Tokuda, Synthesis, 2005,1319-1325.

Eine effiziente Synthese von α-Iod/Brom-α,β-ungesättigten Aldehyden/Ketonen direkt aus propargylischen Alkoholen wird gemeinsam durch Ph3PAuNTf2 und MoO2(acac)2 katalysiert, wobei Ph3PO als Additiv hilft, unerwünschte Enon/Enal-Bildung zu unterdrücken. Bemerkenswerte Merkmale dieser Methode sind geringe Katalysatorbeladungen, milde Reaktionsbedingungen und meist gute Diastereoselektivität.
L. Ye, L. Zhang, Org. Lett., 2009,11, 3646-3649.

Eine regio- und stereoselektive Iodierung, zusammen mit einigen Beispielen für Bromierung, von leicht verfügbaren Acrylamiden verläuft unter milden Bedingungen über einen Rh(III)-katalysierten C-H-Aktivierungs/Halogenierungs-Mechanismus. Die Reaktion stellt ein seltenes Beispiel für eine direkte Halogenierung von elektronenarmen Acrylsäurederivaten dar, um eine Vielzahl von unterschiedlich substituierten Z-Halogenacrylsäurederivaten zu erhalten.
N. Kuhl, N. Schröder, F. Glorius, Org. Lett., 2013,15, 3860-3863.

In einer NBS-geförderten Allyloxyl-Additions-Claisen-Umlagerungs-Dehydrobromierungs-Kaskadenreaktion wurden mehr als 20 substituierte Alkinylsulfonamide mit Allylalkoholen zu (2Z)-2,4-Dienamiden in guten Ausbeuten umgesetzt. Theoretische Berechnungen legten nahe, dass eine sigmatrope Umlagerung der geschwindigkeitslimitierende Schritt ist.
R. Ding, Y. Li, C. Tao, B. Cheng, H. Zhai, Org. Lett., 2015,17, 3994-3997.

Ein schnelles und bequemes Ein-Schritt-Verfahren ermöglicht die Umwandlung von α,β-ungesättigten Carbonylverbindungen in ihre entsprechenden Bromoenone bei Raumtemperatur unter sehr milden Bedingungen in hohen Ausbeuten mit NBS-Et3N – 3 HBr in Gegenwart von Kaliumcarbonat in Dichlormethan.
D. Jyothi, S. HariPrasad, Synlett, 2009, 2309-2311.

Eine milde Eintopf-Cyanoimidierung von Aldehyden unter Verwendung von Cyanamid als Stickstoffquelle und NBS als Oxidationsmittel wurde in hohen Ausbeuten ohne Zugabe eines Katalysators erreicht. Anschließend können die substituierten N-Cyanobenzimidat-Produkte auch eine Cyclisierungsreaktion zu 1,2,4-Triazol-Derivaten in hohen Ausbeuten eingehen.
P. Yin, W.-B. Ma, Y. Chen, W.-C. Huang, Y. Deng, L. He, Org. Lett., 2009,11, 5482-5485.

Sm(OTf)3 ist ein effektiver Katalysator für eine vielseitige und effiziente halogengeförderte hochregio- und stereoselektive Friedel-Crafts (F-C)-Alkylierung von elektronenreichen Arenen mit Alkenen und α,β-ungesättigten Carbonylverbindungen in Gegenwart von NBS oder I2 als Halogenquellen.
S. Haira, B. Maji, S. Bar, Org. Lett., 2007,9, 2783-2786.

Eine neue silberkatalysierte hochregio- und stereoselektive Difunktionalisierungsreaktion von einfachen terminalen Alkinen ergibt (Z)-β-Halogenolacetat-Derivate in guten Ausbeuten. Die resultierenden Produkte sind vielseitige Zwischenprodukte in der organischen Synthese.
Z. Chen, J. Li, H. Jiang, S. Zhu, Y. Li, C. Qi, Org. Lett., 2010,12, 3262-3265.

Ein neues Verfahren zur Aminobromierung von Olefinen liefert vicinale Bromoaminderivate in hohen Ausbeuten unter Verwendung von Cu-, Mn- oder V-Katalysatoren mitp-Toluolsulfonamid als Stickstoffquelle und N-Bromsuccinimid(NBS) als Bromquelle. Exzellente Regio- und Stereoselektivität wird sowohl für verschiedene olefinische Substrate als auch für Übergangsmetallkatalysatoren gezeigt.
V. V. Thakur, S. K. Talluri, A. Sudalai, Org. Lett. 2003,5, 861-864.

Eine bequeme und effiziente eisen-katalysierte Aminobromierung von Alkenen wurde unter Verwendung von preiswertem FeCl2 als Katalysator, Amiden/Sulfonamiden und NBS als Stickstoff- bzw. Bromquellen unter milden Bedingungen entwickelt.
Z. Wang, Y. Zhang, H. Fu, Y. Jiang, Y. Zhao, Synlett, 2008, 2667-2668.

Für eine effiziente, katalysator- und metallfreie Bromamidierung von nicht aktivierten Olefinen wurden 4-(Trifluormethyl)benzolsulfonamid und N-Bromsuccinimid als Stickstoff- bzw. Halogenquelle verwendet. Die Methodik ist sowohl für zyklische als auch für aliphatische Olefine anwendbar.
W. Z. Yu, F. Chen, Y. A. Cheng, Y.-Y. Yeung, J. Org. Chem., 2015,80, 2815-2821.

Eine effiziente katalysatorfreie radikalische Kreuzkupplungsreaktion zwischen aromatischen Aldehyden und Sulfoximinen fand in Gegenwart von N-Bromsuccinimid als Radikalinitiator unter Mikrowellenbestrahlung statt, um die entsprechenden acylierten Sulfoximine in guten Ausbeuten zu liefern.
K. K. Rajbongshi, S. Ambala, T. Govender, H. G. Kruger, P. I. Arvidsson, T. Naicker, Synthesis, 2020, 52, 1279-1286.

Eine neuartige elektrophile Eintopfreaktion eines Olefins, eines Cyanimids, eines Amins und N-Bromsuccinimid ermöglicht die Synthese einer Reihe von Guanidinderivaten mit sehr guten Ausbeuten – einschließlich eines rTRTVI-Vorläufers.
L. Zhou, J. Chen, J. Zhou, Y.-Y. Yeung, Org. Lett., 2011,13, 5804-5807.

Eine stereoselektive Arylierung und Vinylierung von Alkenen ohne Übergangsmetallkatalysatoren erfolgt durch eine interessante NBS-geförderte Semipinacol-Umlagerung unter milden Bedingungen und eine anschließende ungewöhnliche NaOH-vermittelte Grob-Fragmentierung.
D.-Y. Yuan, Y.-Q. Tu, C.-A. Fan, J. Org. Chem., 2008,73, 7797-7799.

Eine neuartige kationische Br-initiierte Eintopfsynthese unter Verwendung von Olefin, Nitril, Amin und N-Bromsuccinimid ergibt Imidazoline in guten Ausbeuten. Die olefinischen Substrate und die Nitrilpartner können flexibel variiert werden, um eine Reihe von Imidazolinderivaten zu erhalten.
L. Zhou, J. Zhou, C. K. Tan, J. Chen, Y.-Y. Yeung, Org. Lett., 2011,13, 2448-2451.

Eine N-Bromsuccinimid-vermittelte Direktsynthese von 2,5-Diaryloxazolen ausgehend von N-H-Ketoaziridinen verläuft über die in situ-Bildung von N-Bromoketoaziridinen gefolgt von der Erzeugung von Azomethin-Yliden.
H. S. Samimi, F. Dadvar, Synthesis, 2015, 47, 1899-1904.

3-Oxazolin-4-carboxylate als leicht verfügbare synthetische Zwischenprodukte können oxidiert werden, um Oxazol-4-carboxylate zu erhalten. Darüber hinaus ermöglicht die Derivatisierung von 3-Oxazolin-4-carboxylaten mit Grignard-Reagenzien eine einfache Herstellung von 4-Keto-Oxazol-Derivaten.
K. Murai, Y. Takahara, T. Matsushita, H. Komatsu, H. Fujioka, Org. Lett., 2010,12, 3456-3459.

2-Amino-4-alkyl- und 2-Amino-4-arylthiazol-5-carboxylate und ihre Selenazol-Analoga wurden durch α-Halogenierung von β-Ketoestern mit N-Bromsuccinimid und anschließende Cyclisierung mit Thioharnstoff bzw. Selenoharnstoff in Gegenwart von β-Cyclodextrin in Wasser bei 50°C synthetisiert.
M. Narender, M. S. Reddy, V. P. Kumar, B. Srinivas, R. Sridhar, Y. V. D. Nageswar, K. R. Rao, Synthesis, 2007, 3469-3472.
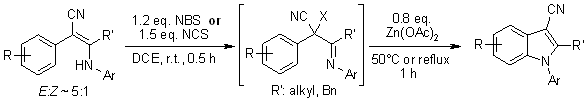
Verschiedene 2-Aryl-3-arylamino-2-alkenylnitrile ergeben N-Arylindol-3-carbonitrile in einer Eintopfmanier durch NBS- oder NCS-vermittelte Halogenierung, gefolgt von Zn(OAc)2-katalysierter intramolekularer Cyclisierung. Der Prozess beinhaltet die Bildung von Arylnitrenium-Ionen-Zwischenprodukten, die eine elektrophile aromatische Substitution durchlaufen, um die cyclisierten N-Arylindole zu ergeben.
Q. Yan, J. Luo, D. Zhang-Negrerie, H. Li, X. Qi, K. Zhao, J. Org. Chem., 2011,76, 8690-8697.

Tert-Butylsulfoxide können als Sulfinylquellen in einer intramolekularen Sulfinylierung von Sulfonamiden verwendet werden, gefolgt von einem all-heteroatomigen Wittig-Äquivalenzprozess, um Arylisothiazole in hohen Ausbeuten zu liefern.
F. Xu, Y. Chen, E. Fan, Z. Sun, Org. Lett. 2016, 18, 2777-2779.

Eine katalysatorfreie halogenative Cyclisierung von N-Aryldiazoamiden mit N-Halogensuccinimiden (NXS) liefert 3-Halogenoxindole in guten Ausbeuten durch einen carbenfreien Mechanismus unter milden und katalysatorfreien Bedingungen. Es wird vorgeschlagen, dass diese Transformation durch die Bildung von Diazonium-Ionen, gefolgt von einer intramolekularen Friedel-Crafts-Alkylierung, abläuft.
C. Ma, D. Xing, W. Hu, Org. Lett. 2016, 18, 3134-3137.

Eine neue Methodik für die Synthese von verschieden substituierten 2-Oxazolinen und einem Dihydrooxazin unter Verwendung von Aldehyden, Aminoalkoholen und N-Bromsuccinimid als Oxidationsmittel wird beschrieben. Diese Eintopfsynthese zeichnet sich durch milde Reaktionsbedingungen, große Bandbreite, hohe Ausbeuten und ihre präparative Einfachheit aus.
K. Schwekendiek, F. Glorius, Synthesis, 2006, 2996-3002.

Eine Gold-katalysierte Cyclisierung von β-Amino-Synon-Zwischenprodukten und Halodeaurierung ermöglicht eine schnelle und effiziente Ein-Schritt-Halopyridon-Synthese.
K. H. Nguyen, S. Tomasi, M. Le Roch, L. Toupet, J. Renault, P. Uriac, N. Gouault, J. Org. Chem., 2013,78, 7809-7815.

Eine vielseitige und hocheffiziente Zn(OTf)2-katalysierte Eintopfreaktion von Alkenen, NBS, Nitrilen und TMSN3 ergibt verschiedene 1,5-disubstituierte Tetrazole, die eine zusätzliche α-Bromfunktionalität des N1-Alkylsubstituenten enthalten.
S. Hajra, D. Sinha, M. Bhowmick, J. Org. Chem., 2007,72, 1852-1855.

Eine Eintopfsynthese von Arylsulfonen aus primären Alkoholen wird beschrieben. Alkohole wurden mit N-Bromsuccinimid und Triphenylphosphin behandelt, gefolgt von der Zugabe von Natriumarsulfinat mit einer katalytischen Menge von Tetrabutylammoniumiodid, um die Arylsulfone in guten bis hohen Ausbeuten zu erhalten.
T. Murakami, K. Furusawa, Synthesis,2002, 479-482.

Sulfoxide, die eine tert-Butylgruppe tragen, können mit N-Bromsuccinimid (NBS) unter sauren Bedingungen aktiviert werden. Die anschließende Behandlung mit verschiedenen Stickstoff-, Kohlenstoff- oder Sauerstoff-Nukleophilen ergibt eine breite Palette von Sulfinsäureamiden, neuen Sulfoxiden und Sulfinsäureestern.
J. Wei, Z. Sun, Org. Lett. 2015,17, 5396-5399.

Cyanid vermittelt eine in situ Erzeugung eines nukleophilen Sulfinat-Ions aus Vinylsulfonen. Eine anschließende in situ S-Alkylierung liefert Sulfone in hohen Ausbeuten. In Gegenwart von N-Bromsuccinimid wurden primäre und sekundäre Amine unter Sulfonamidbildung umgesetzt.
T. Roy, J.-W. Lee, Synlett, 2020, 31, 455-458.

Thiosulfonate, die durch kupferkatalysierte aerobe Dimerisierung synthetisiert werden, dienen als Substrat für einfache und hochausbeuterische Strategien zur Herstellung einer Vielzahl von Sulfonen und Sulfonamiden. Thiosulfinate sind stabile, ungiftige Alternativen zu Metallsulfinat-Salzen, die aus giftigem SO2 gewonnen werden.
P. K. Shyam, H.-Y. Jang, J. Org. Chem., 2017, 82, 1761-1767.

Die Synthese von N-Cyanosulfiliminen lässt sich leicht durch Umsetzung der entsprechenden Sulfide mit Cyanogenamin in Gegenwart einer Base und NBS oder I2 als Halogenierungsmittel erreichen. Durch Oxidation und anschließende Decyanierung erhält man synthetisch verwendbare Sulfoximine.
O. García Mancheño, O. Bistri, C. Bolm, Org. Lett., 2007,9, 3809-3811.

In einer Eintopf-Kaskaden-Transformation von Ketonen zu α-Imidoketonen stellt N-Bromsuccinimid (NBS) sowohl elektrophile Brom- als auch nucleophile Stickstoffquellen bereit, und Diazabicycloundec-7-en (DBU) fungiert als Base und nucleophiler Promotor für die Aktivierung von NBS. Die α-Bromierung wird als Schlüsselschritt im Prozess angenommen.
Y. Wei, S. Lin, F. Liang, Org. Lett., 2012,14, 4202-4205.