Apathie wordt gedefinieerd als een verminderde motivatie die niet toe te schrijven is aan een verminderd bewustzijn, cognitieve stoornissen of emotionele nood.1 Depressie gaat gepaard met aanzienlijke emotionele nood, wat blijkt uit tranen, droefheid, angst, agitatie, slapeloosheid, anorexia, gevoelens van waardeloosheid en hopeloosheid, en terugkerende gedachten aan de dood.2 De traditionele diagnostische nomenclatuur en maatstaven voor depressie, waaronder de DSM-IV2 en de Hamilton Rating Scale for Depression (Ham-D),3 behandelen apathie als een aspect van depressie, maar het kan een discrimineerbaar klinisch construct zijn dat bij sommige patiënten een andere benadering van de behandeling vereist.4-7
Marin et al.7 evalueerden patiënten met de ziekte van Alzheimer (AD), een beroerte en een zware depressie met behulp van de Apathy Evaluation Scale8 en de Ham-D. Zij vonden dat de relatie tussen apathie en depressie varieerde tussen de diagnosegroepen. Apathie en depressie waren significant gecorreleerd binnen groepen, hoewel absolute niveaus van apathie en depressie aanzienlijk varieerden. Patiënten met de ziekte van Alzheimer hadden vaak hoge apathie- en lage depressiescores, terwijl patiënten met een beroerte in de linker hersenhelft of een zware depressie vaak hoge depressiescores hadden met lage apathiescores. Patiënten met een beroerte in de rechter hersenhelft vormden de enige groep die gelijke niveaus van de twee symptomen hadden, en het was de enige groep waarbij apathie en depressie niet gecorreleerd waren. De auteurs suggereerden dat apathie en depressie klinisch verschillende neuropsychiatrische syndromen zijn.
Neurodegeneratieve stoornissen vergemakkelijken de studie van apathie en depressie omdat ze aantoonbare hersenpathologie veroorzaken en vaak geassocieerd worden met neuropsychiatrische symptomen.5,9-13 De Neuropsychiatric Inventory (NPI)14 is ontworpen om neuropsychiatrische symptomen bij dementerende ziekten te beoordelen en bevat aparte subschalen voor apathie en depressie. In twee eerdere studies vonden we dat patiënten met frontotemporale dementie (FTD) en progressieve supranucleaire parese (PSP) gedifferentieerd konden worden van patiënten met AD door hun ernstiger apathie en relatief minder depressie.9,11 Wij stelden de hypothese dat apathie of een gebrek aan emotie verschilt van depressie en speculeerden dat de twee symptomen door verschillende neuroanatomische of neurochemische substraten zouden kunnen worden geproduceerd en verschillend tot uiting zouden komen bij verschillende neurologische aandoeningen.
METHODEN
Onderwerpen
Er werden in totaal 154 patiënten in vier academische centra gezien. Voor deelname aan de studie was toestemming van zowel de patiënt als de verzorger vereist.
Dertig AD-patiënten en 28 FTD-patiënten meldden zich bij een dementiekliniek van de University of California in Los Angeles, University of California in Los Angeles-Harbor Medical Center, of West Los Angeles Veterans Affairs Medical Center. Alle 30 AD-patiënten en 22 van de FTD-patiënten zijn eerder beschreven.9 Vermoedelijke AD werd gediagnosticeerd op basis van criteria die zijn vastgesteld door het National Institute of Neurological and Communicative Disorders and Stroke en de Alzheimer’s Disease and Related Disorders Association (NINCDS-ADRDA).15 Frontotemporale dementie werd gediagnosticeerd op basis van criteria die zijn ontwikkeld door de Lund- en Manchester-groepen.16
Veertig patiënten met de ziekte van Parkinson (PD) werden verwezen naar een polikliniek voor bewegingsstoornissen van de Universiteit van Californië in Los Angeles voor een pallidotomie-operatie vanwege het aan-uit-syndroom, hardnekkige tremor, of bradykinesie bij maximale doses van anti-PD-medicijnen. De patiënten werden gescreend door twee neurologen en een neurochirurg. Tot de inclusiecriteria behoorden een voorgeschiedenis die wees op idiopathische PD, waaronder twee van de vier kardinale tekenen (rusttrillingen, rigiditeit, akinesie/bradykinesie, en loopstoornissen/posturale instabiliteit) en een duidelijke voorgeschiedenis van respons op levodopa.
Tweeëntwintig patiënten met PSP werden gezien in een polikliniek van het National Institute of Neurological Disorders and Stroke (NINDS) en zijn eerder beschreven.11 Alle PSP-patiënten voldeden aan de Blin-criteria voor waarschijnlijke PSP.17,18
Vierendertig patiënten met de ziekte van Huntington (HD) meldden zich bij een gespecialiseerde kliniek van de Universiteit van Californië, San Diego, en hadden allemaal de typische choreiforme bewegingsstoornis plus ten minste één eerstegraads familielid dat ook HD had.
Patiënten werden gescreend op chronische psychische aandoeningen, hoofdtrauma, cerebrovasculaire aandoeningen, extrapiramidale stoornissen anders dan beschreven, vitaminetekort, hypothyreoïdie, syfilis, en andere medische aandoeningen. Niet alle patiënten met HD, PSP en PD hadden voldoende geheugenstoornissen om te voldoen aan de DSM-IV criteria voor dementie; ze hadden echter allemaal degeneratieve hersenziekten zoals gedefinieerd door hun klinische diagnoses. Onze primaire focus lag niet op het niveau van dementie, maar op de relatie tussen apathie en depressie. Secundaire analyses onderzochten de relatie van deze symptomen met cognitieve stoornissen.
Assessment
Gedragsgegevens werden verzameld tijdens interviews met verzorgers met behulp van de NPI. Dit instrument beoordeelt 10 gedragingen die voorkomen bij dementie, waaronder wanen, hallucinaties, agitatie, depressie, angst, euforie, apathie, ontremming, prikkelbaarheid, en afwijkend motorisch gedrag (waaronder ijsberen, rommelen en dwanghandelingen). Een frequentie score (1-4) vermenigvuldigd met een ernst score (1-3) geeft een subschaal score voor elk gedrag, en de som van de subschaal scores geeft de totale NPI score. Een andere benadering van de analyse werd ook gebruikt, waarbij we 0 toekenden aan gemiddelde afwezigheid en 1 of meer aan gemiddelde aanwezigheid van het symptoom. De NPI is valide gebleken in vergelijking met een aantal andere diagnostische benaderingen en heeft een hoge interbeoordelaars- en test-hertestbetrouwbaarheid.14 Een trainingsvideoband en gescripte vragen werden gebruikt om de betrouwbaarheid tussen de verschillende locaties te garanderen.
De apathie-subschaal omvat items zoals verlies van interesse tonen, gebrek aan motivatie, minder spontaan, minder aanhankelijk, minder enthousiast, gebrek aan emoties, en niet geïnteresseerd zijn in het doen van nieuwe dingen. De subschaal depressie bevat items zoals verdrietig, depressief, huilerig, neerslachtig, gevoel van mislukking, hopeloos over de toekomst, gevoel van een last en doodswensen. De subschaal depressie bevat geen items die verband houden met apathie en correleert aantoonbaar sterk met de depressieschaal van Hamilton.14 De subschaal apathie bevat geen items die verband houden met droefheid.
Cognitieve functie werd beoordeeld met de Mini-Mental State Examination (MMSE).19 Een perfecte score op de MMSE is 30, en afnemende scores wijzen op ernstigere cognitieve stoornissen. De NPI en MMSE werden meestal op dezelfde dag afgenomen.
Data-analyse
De twee centrale vragen van de studie waren 1) hoe deze twee symptomen met elkaar samenhingen en 2) of hun relatie consistent was tussen verschillende dementiesyndromen. Spearman correlaties werden bepaald voor alle 10 van de NPI subschaal scores en de totale MMSE score. Er werd een aparte matrix gegenereerd voor elk van de vijf dementiegroepen en voor de totale gecombineerde groep. Een Kruskal-Wallis one-way analysis of variance (ANOVA) op de gemiddelde subschaal scores werd gebruikt om groepsverschillen in de ernst van depressie en apathie te bepalen. Analyses zijn exploratief, en een significantieniveau van 0,5 werd als betekenisvol geaccepteerd.
RESULTATEN
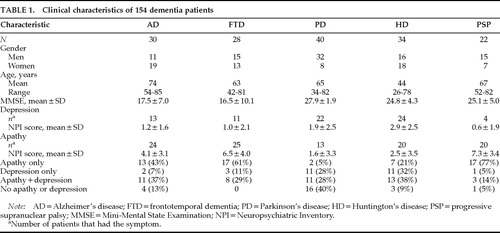
Clinische kenmerken van de 154 patiënten worden gepresenteerd in tabel 1. Er waren bijna evenveel mannen als vrouwen in de FTD- en HD-groepen, maar er waren meer vrouwen in de AD-groep en meer mannen in zowel de PD- als de PSP-groep. De AD groep was gemiddeld ongeveer 10 jaar ouder dan de FTD, PD, en PSP groepen en 30 jaar ouder dan de HD groep. MMSE scores waren vergelijkbaar in AD en FTD, en deze twee groepen hadden MMSE scores die 10 punten lager waren dan de PD, HD, en PSP groepen.
De ernst van apathie en depressie verschilde significant tussen de groepen (Tabel 1). Een Kruskal-Wallis one-way ANOVA werd gebruikt om de gemiddelde NPI subscale scores tussen de groepen te vergelijken. Er werden significante verschillen gevonden tussen de vier groepen, waarbij PD- en HD-patiënten de minst ernstige apathie en de meest ernstige depressie hadden (Figuur 1).
De frequentie van apathie en depressie en de relatie tussen de twee symptomen varieerde tussen de diagnostische groepen. Een groot aantal AD-patiënten en nog meer FTD- en PSP-patiënten hadden apathie zonder depressie, terwijl veel PD- en HD-patiënten depressie hadden zonder apathie. Alle diagnostische groepen hadden meer patiënten met het ene of het andere symptoom dan met beide symptomen. Het verschil tussen apathie en depressie was vooral dramatisch bij patiënten met PD en PSP. Weinig PD-patiënten hadden apathie alleen (n=2; 5%) vergeleken met het aantal dat depressie alleen (11; 28%) of depressie plus apathie (11; 28%) had, en weinig PSP-patiënten hadden depressie, maar zij hadden een hoge frequentie van apathie. Van de 22 patiënten met PSP hadden er 17 (77%) alleen apathie,11 1 depressie, en 3 depressie plus apathie (tabel 1).
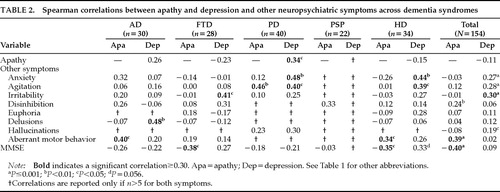
Apathie correleerde niet met depressie in de gecombineerde steekproef van dementiepatiënten (r=-0,11, P=0,18). Er was een niet-significante negatieve correlatie in de FTD (r=-0,23, P=0,23) en HD (r=-0,15, P=0,40) groepen, en er was een niet-significante positieve correlatie in de AD groep (r=0,26, P=0,16). De PD-groep was de enige dementiegroep die een significante correlatie tussen de twee symptomen vertoonde (r=0,34, P=0,03; Tabel 2). Het patroon van correlatie tussen apathie en depressie verschilde dus tussen de diagnosegroepen, en de aanwezigheid van het ene voorspelde niet de aanwezigheid van het andere.
De NPI meet acht neuropsychiatrische symptomen naast apathie en depressie. Sommige van deze symptomen correleerden met apathie en andere, andere symptomen correleerden met depressie. In de totale steekproef correleerde apathie met ontremming en afwijkend motorisch gedrag, en depressie correleerde met angst, agitatie, prikkelbaarheid, en hallucinaties (tabel 2).
Apathie was gecorreleerd met een lagere cognitieve functie zoals gemeten door de MMSE in de totale steekproef (r= -0,40, P<0.0001), in de FTD-groep (r= -0,38, P<0,05), en in de HD-groep (r= -0,35, P<0,05). De AD en PD groepen hadden een trend naar lagere cognitieve functie met toegenomen apathie, en de PSP groep had geen correlatie tussen apathie en cognitieve functie. Apathie was niet gecorreleerd met het vorderen van de leeftijd.
Depressie had geen significante correlatie met MMSE scores in de gecombineerde steekproef. Bij AD en PD waren er niet-significante trends in de richting van een verband tussen depressie en een lagere cognitieve functie. FTD- en HD-patiënten vertoonden geen significante trends in de richting van een verband tussen de ernst van de depressie en een betere cognitieve functie, en er waren te weinig PSP-patiënten met een depressie om een zinvolle analyse te kunnen maken.
DISCUSSIE
Apathie komt veel voor bij neurodegeneratieve ziekten,5,9-13 en deze studie ondersteunt en breidt de bevindingen uit van de weinige eerdere studies waarin apathie en depressie als onafhankelijke klinische verschijnselen werden behandeld.5,7,11,20 In tegenstelling tot de Ham-D die in veel eerdere studies werd gebruikt, bevat de depressiesubschaal van de NPI geen items die verband houden met apathie, en de apathiesubschaal bevat geen vragen die verband houden met depressie. Wij vonden geen correlatie tussen apathie en depressie bij 154 patiënten met vijf neurodegeneratieve aandoeningen. Bovendien waren de twee symptomen op verschillende manieren geassocieerd met andere neuropsychiatrische symptomen. Apathie werd geassocieerd met ontremming en afwijkend motorisch gedrag; depressie werd geassocieerd met angst, agitatie, prikkelbaarheid, en hallucinaties. Apathie en ontremming lijken elkaar uit te sluiten, maar beide worden bemiddeld door frontale kwabsystemen en ze worden vaak samen gezien, vooral bij patiënten met FTD. Ook kan het probleemgedrag dat leidt tot beheersproblemen of verminderde functionele capaciteit primair gerelateerd zijn aan frontale kwabdysfunctie, en eerdere studies hebben gevonden dat apathie geassocieerd is met deze symptomen.21,22
In deze en eerdere studies was apathie significant gecorreleerd met verhoogde cognitieve stoornissen (zoals gemeten door de MMSE) in AD en PD,5,13,20,23 maar niet in PSP11 of HD.22 De relatie tussen depressie en cognitieve functie bij dementie is controversieel. Sommige studies hebben een verband gevonden tussen depressie en ernstigere cognitieve stoornissen,24 maar andere niet.25 Wij vonden geen consistent verband tussen depressie en cognitie in de totale steekproef of bij individuele ziekten. De MMSE test echter niet adequaat de werking van de frontale kwab, die bij veel dementerende stoornissen vaak verstoord is, en biedt geen geldige maat voor dit deel van de cognitieve achteruitgang.
De relatie tussen apathie en depressie lijkt ziektespecifiek te zijn. AD, FTD, en PSP hadden een meer voorkomende en ernstige apathie, terwijl PD en HD een meer voorkomende en ernstige depressie hadden. PSP patiënten vertoonden de meest frequente en ernstige apathie en de minste depressie. Een eerdere studie die verschillende maten van apathie en ziekte-ernst gebruikte, vond dat HD-patiënten ernstiger apathisch waren dan AD-patiënten.22
Anatomische lokalisatie van regionale disfunctie geassocieerd met apathie en depressie lijkt aanzienlijk te overlappen. Depressie komt vaker voor wanneer de focale laesies anterieur en links zijn.26 Deze bevinding is vergelijkbaar maar niet identiek met bevindingen uit metabolische studies bij jongere patiënten, waaruit blijkt dat depressie geassocieerd is met frontale, en vooral links frontale, hypometabolisme.27 De ziekte van Parkinson met depressie wordt geassocieerd met een verminderd glucosemetabolisme in de inferieure frontale28 en mediale prefrontale cortex.29 Paralimbische gebieden zoals orbitaal-inferieure prefrontale en temporale cortex zijn ook betrokken bij depressie bij patiënten met HD.30 Apathie is het gevolg van beschadiging van mediale prefrontale, anterieure cingulate, en anterieure temporale paralimbische gebieden, met name de amygdala en gerelateerde subcorticale structuren.31-33 Apathie bij AD-patiënten is gecorreleerd met frontotemporale hypoperfusie in één studie23 en met rechter temporopariëtale hypoperfusie in een andere.21 Apathie kan ook optreden bij beroertes waarbij het achterste deel van het interne kapsel is betrokken.20 Apathie is pas recentelijk het onderwerp van onderzoek geworden, en er kunnen verschillende vormen van apathie zijn die worden bemiddeld door een netwerk van verwante structuren. De anatomische correlaten van apathie vereisen verder onderzoek, maar de waarnemingen hier suggereren dat de frontale regio’s die betrokken zijn bij FTD en de diencephalische structuren die betrokken zijn bij PSP bijzonder relevant zijn.
Een deel van de overlap die gerapporteerd is tussen depressie en apathie kan te wijten zijn aan het gebruik van depressie-instrumenten die apathie-items bevatten. Een andere mogelijke verklaring is dat bij beide symptomen soortgelijke circuits betrokken kunnen zijn, maar dat de mate van betrokkenheid van neurotransmitters bij verschillende stoornissen kan verschillen. Serotonerge middelen verlichten vaak depressie, maar kunnen apathie versterken, terwijl dopaminerge middelen apathie kunnen verlichten34,35 maar niet effectief zijn als antidepressiva; bij acetylcholine-deficiënte ziekten zoals AD, kan een cholinomimetisch middel nuttig zijn om apathie te verminderen, maar het heeft geen invloed op de stemming.36 Een mogelijke verklaring voor de verschillende therapeutische reacties van depressie en apathie is dat depressie ontstaat wanneer een onevenwicht in de functie van paralimbische neurotransmitters resulteert in overmatige negatieve emotie, terwijl apathie optreedt wanneer de cortex functioneel losgekoppeld is van relevante paralimbische input.
De beperkingen en sterke punten van deze studie moeten worden erkend. Ten eerste, gedragsbeoordeling was een primair doel bij het verzamelen van deze gegevens, maar de specifieke hypotheses die hier worden gepresenteerd waren niet prospectief gesteld en de analyses zijn post hoc. Ten tweede zijn depressie en apathie subjectieve menselijke ervaringen, en het is mogelijk dat de door het NPI gebruikte informantenstrategieën van verzorgers niet helemaal accuraat zijn – hoewel er aanwijzingen zijn dat verzorgers in staat zijn om geldige beoordelingen van depressie en apathie te geven.8,37 Ten derde hadden de PD-, HD- en PSP-patiënten significant minder cognitieve beperkingen, wat een verklaring zou kunnen zijn voor sommige van de verschillen die wij als ziektespecifiek hebben beschreven. Ten vierde kunnen psychotrope medicaties apathie en depressie veroorzaken, en we kunnen niet garanderen dat sommige van onze patiënten deze niet gebruikten; deze beoordelingen werden echter over het algemeen gedaan bij het eerste bezoek voorafgaand aan de medicatietherapie. Tenslotte beschikken we niet over autopsiegegevens om onze diagnostische nauwkeurigheid te bevestigen.
De studie wordt versterkt door de aanwezigheid van een grote groep patiënten met neurodegeneratieve aandoeningen en een grote variatie in de klinische en pathologische expressie van hun ziekten, waardoor we conclusies kunnen trekken over de relatie tussen apathie en depressie in de aanwezigheid van differentieel gestoorde neurale paden. Bovendien maakt het gebruik van een betrouwbaar en valide instrument dat de twee constructen scheidt een zinvolle vergelijking mogelijk.
We concluderen dat apathie veel voorkomt bij neurodegeneratieve ziekten en te scheiden is van depressie. Het kan behandelbaar zijn met dopaminerge of cholinerge medicatie, en de aanwezigheid ervan zou moeten worden nagegaan tijdens het routine verloop van een neuropsychiatrische evaluatie. Apathie mag niet worden toegeschreven aan depressie, en de diagnose depressie moet worden gebaseerd op symptomen van droefheid en gevoelens van hulpeloosheid, hopeloosheid en waardeloosheid.
ACKNOWLEDGMENTS
Dit project werd ondersteund door een Department of Veterans Affairs Neuroscience Fellowship, een subsidie van het National Institute on Aging Alzheimer’s Disease Center (AG10123), en het Sidell-Kagan Research Fund.
TABEL 1.
TABEL 2.

TABEL 2.
1. Marin RS: Differentiële diagnose en classificatie van apathie. Am J Psychiatry 1990; 147:22-30Crossref, Medline, Google Scholar
2. American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders, 4e editie. Washington, DC, American Psychiatric Association, 1994Google Scholar
3. Hamilton M: A rating scale for depression. J Neurol Neurosurg Psychiatry 1960; 23:56-62Crossref, Medline, Google Scholar
4. Marin RS, Firinciogullari S, Biedrzycki RC: The sources of convergence between measures of apathy and depression. J Affect Disord 1993; 28:117-124Crossref, Medline, Google Scholar
5. Starkstein SE, Mayberg HS, Preziosi TJ, et al: Reliability, validity, and clinical correlates of apathy in Parkinson’s disease. J Neuropsychiatry Clin Neurosci 1992; 4:134-139Link, Google Scholar
6. Marin RS: Apathie: een neuropsychiatrisch syndroom. J Neuropsychiatry Clin Neurosci 1991; 3:243-254Link, Google Scholar
7. Marin RS, Firinciogullari S, Biedrzycki RC: Group differences in the relationship between apathy and depression. J Nerv Ment Dis 1994; 182:235-239Crossref, Medline, Google Scholar
8. Marin RS, Biedrzycki RC, Firinciogullari S: Betrouwbaarheid en validiteit van de apathie evaluatieschaal. Psychiatry Res 1991; 38:143-162Crossref, Medline, Google Scholar
9. Levy ML, Miller BL, Cummings JL, et al: Alzheimer disease and frontotemporal dementias: behavioral distinctions. Arch Neurol 1996; 53:687-690Crossref, Medline, Google Scholar
10. Mega MS, Cummings JL, Fiorello T, et al: The spectrum of behavioral changes in Alzheimer’s disease. Neurology 1996; 46:130-135Crossref, Medline, Google Scholar
11. Litvan I, Mega MS, Cummings JL, et al: Neuropsychiatric aspects of progressive supranuclear palsy. Neurology 1996; 47:1184-1189Crossref, Medline, Google Scholar
12. Bozzola FG, Gorelick PB, Freels S: Persoonlijkheidsveranderingen bij de ziekte van Alzheimer. Arch Neurol 1992; 49:297-300Crossref, Medline, Google Scholar
13. Devanand DP, Brockington CD, Moody BJ, et al: Behavioral syndromes in Alzheimer’s disease. International Psychogeriatrics 1992; 4(suppl)2:161-184Google Scholar
14. Cummings JL, Mega M, Gray K, et al: The Neuropsychiatric Inventory: comprehensive assessment of psychopathology in dementia. Neurology 1994; 44:2308-2314Crossref, Medline, Google Scholar
15. McKhann G, Drachman D, Folstein M, et al: Clinical diagnosis of Alzheimer’s disease: report of the NINCDS-ADRDA work group under the auspices of Department of Health and Human Services Task Force on Alzheimer’s Disease. Neurology 1984; 34:939-944Crossref, Medline, Google Scholar
16. Brun A, Englund B, Gustafson L, et al: Consensus statement: Klinische en neuropathologische criteria voor frontotemporale dementie: de Lund en Manchester groepen. J Neurol Neurosurg Psychiatry 1994; 57:416-418Crossref, Medline, Google Scholar
17. Litvan I, Agid Y, Jankovic J, et al: Accuracy of clinical criteria for the diagnosis of progressive supranuclear palsy (Steele-Richardson-Olszewski syndrome): report of the NINDS-SPSP International Workshop. Neurology 1996; 47:1-9Crossref, Medline, Google Scholar
18. Blin J, Baron JC, Dubois B, et al: Positron emission tomography study in progressive supranuclear palsy. Brain hypometabolic pattern and clinicometabolic correlations. Arch Neurol 1990; 47:747-752Crossref, Medline, Google Scholar
19. Folstein MF, Folstein SE, McHugh PR: “Mini-Mental State”: een praktische methode voor het beoordelen van de cognitieve toestand van patiënten voor de clinicus. J Psychiatr Res 1975; 12:189-198Crossref, Medline, Google Scholar
20. Starkstein SE, Fedoroff JP, Price TR, et al: Apathie na cerebrovasculaire laesies. Stroke 1993; 24:1625-1630Crossref, Medline, Google Scholar
21. Ott BR, Noto RB, Fogel BS: Apathy and loss of insight in Alzheimer’s disease: a SPECT imaging study. J Neuropsychiatry Clin Neurosci 1996; 8:41-46Link, Google Scholar
22. Paulsen JS, Stout JC, DeLaPena J, et al: Frontal behavioral syndromes in cortical and subcortical dementia. Assessment 1996; 3:327-337Crossref, Google Scholar
23. Craig AH, Cummings JL, Fairbanks L, et al: Cerebral blood flow correlates of apathy in Alzheimer disease. Arch Neurol 1996; 53:1116-1120Crossref, Medline, Google Scholar
24. Cooper JK, Mungas D, Weiler PG: Relation of cognitive status and abnormal behaviors in Alzheimer’s disease. J Am Geriatr Soc 1990; 38:867-870Crossref, Medline, Google Scholar
25. Sultzer DL, Levin HS, Mahler ME, et al: Assessment of cognitive, psychiatric, and behavioral disturbances in patients with dementia: the Neurobehavioral Rating Scale. J Am Geriatr Soc 1992; 40:549-555Crossref, Medline, Google Scholar
26. Starkstein SE, Robinson RG: Depression in cerebrovascular disease, in Depression in Neurologic Disease, edited by Starkstein SE, Robinson RG. Baltimore, Johns Hopkins University Press, 1993, pp 28-49Google Scholar
27. Baxter LR, Schwartz JM, Phelps ME, et al: Reduction of prefrontal cortex glucose metabolism common to three types of depression. Arch Gen Psychiatry 1989; 46:243-250Crossref, Medline, Google Scholar
28. Mayberg HS, Starkstein SE, Sadzot B, et al: Selective hypometabolism in the inferior frontal lobe in depressed patients with Parkinson’s disease. Ann Neurol 1990; 28:57-64Crossref, Medline, Google Scholar
29. Ring HA, Bench CJ, Trimble MR, et al: Depression in Parkinson’s disease: a positron emission study. Br J Psychiatry 1994; 165:333-339Crossref, Medline, Google Scholar
30. Mayberg HS: Neuroimaging studies of depression in neurologic disease, in Depression in Neurologic Disease, edited by Starkstein SE, Robinson RG. Baltimore, Johns Hopkins University Press, 1993, pp 186-216Google Scholar
31. Cummings JL: Frontal-subcortical circuits and human behavior. Arch Neurol 1993; 50:873-880Crossref, Medline, Google Scholar
32. Duffy JD: The neural subrates of motivation. Psychiatric Annals 1997; 27:24-29Crossref, Google Scholar
33. Marin RS: Apathie: concept, syndroom, neurale mechanismen, en behandeling. Seminars in Clinical Neuropsychiatry 1996; 1:304-314Medline, Google Scholar
34. Marin RS, Fogel BS, Hawkins J, et al: Apathie: een behandelbaar syndroom. J Neuropsychiatry Clin Neurosci 1995; 7:23-30Link, Google Scholar
35. Watanabe MD, Martin EM, DeLeon OA, et al: Successful methylphenidate treatment of apathy after subcortical infarcts. J Neuropsychiatry Clin Neurosci 1995; 7:502-504Link, Google Scholar
36. Kaufer DI, Cummings JL, Christine D: Effect of tacrine on behavioral symptoms in Alzheimer’s disease: an open-label study. J Geriatr Psychiatry Neurol 1996; 9:1-6Crossref, Medline, Google Scholar
37. Logsdon RG, Teri L: Depression in Alzheimer’s disease patients: caregivers as surrogate reporters. J Am Geriatr Soc 1995; 43:150-155Crossref, Medline, Google Scholar