L’apatia è definita come una diminuzione della motivazione non attribuibile a una diminuzione del livello di coscienza, a un deterioramento cognitivo o a un disagio emotivo.1 La depressione comporta un notevole disagio emotivo, evidenziato da lacrime, tristezza, ansia, agitazione, insonnia, anoressia, sentimenti di inutilità e disperazione, e pensieri ricorrenti di morte.2 La nomenclatura diagnostica tradizionale e le misure della depressione, compreso il DSM-IV2 e la Hamilton Rating Scale for Depression (Ham-D),3 trattano l’apatia come un aspetto della depressione, ma può essere un costrutto clinico discriminabile che richiede un approccio diverso al trattamento in alcuni pazienti.4-7
Marin et al.7 hanno valutato pazienti con malattia di Alzheimer (AD), ictus e depressione maggiore utilizzando la Apathy Evaluation Scale8 e la Ham-D. Hanno scoperto che la relazione tra apatia e depressione variava tra i gruppi diagnostici. L’apatia e la depressione erano significativamente correlate all’interno dei gruppi, anche se i livelli assoluti di apatia e depressione variavano considerevolmente. I pazienti con malattia di Alzheimer avevano frequentemente alti punteggi di apatia e bassa depressione, mentre i pazienti con ictus dell’emisfero sinistro o depressione maggiore avevano frequentemente alta depressione con bassi punteggi di apatia. I pazienti con ictus dell’emisfero destro erano l’unico gruppo che aveva livelli uguali dei due sintomi, ed era l’unico gruppo in cui apatia e depressione non erano correlate. Gli autori hanno suggerito che l’apatia e la depressione sono sindromi neuropsichiatriche clinicamente distinte.
I disturbi neurodegenerativi facilitano lo studio dell’apatia e della depressione perché producono una patologia cerebrale dimostrabile e sono frequentemente associati a sintomi neuropsichiatrici.5,9-13 Il Neuropsychiatric Inventory (NPI)14 è stato progettato per valutare i sintomi neuropsichiatrici nelle malattie demenziali e comprende sottoscale separate per l’apatia e la depressione. In due studi precedenti, abbiamo scoperto che i pazienti con demenza frontotemporale (FTD) e paralisi sopranucleare progressiva (PSP) potevano essere discriminati dai pazienti con AD per la loro apatia più grave e relativamente meno depressione.9,11 Abbiamo ipotizzato che l’apatia o la mancanza di emozioni possa essere diversa dalla depressione e abbiamo ipotizzato che i due sintomi possano essere prodotti da diversi substrati neuroanatomici o neurochimici e che si manifestino in modo diverso in una varietà di disturbi neurologici.
METHODS
Soggetti
Un totale di 154 pazienti è stato visto in quattro centri accademici. La partecipazione allo studio richiedeva il consenso informato sia del paziente che del caregiver.
Trenta pazienti con AD e 28 pazienti con FTD si sono presentati in una clinica della demenza presso l’Università della California a Los Angeles, l’Università della California a Los Angeles-Harbor Medical Center, o il West Los Angeles Veterans Affairs Medical Center. Tutti i 30 pazienti AD e 22 dei pazienti FTD sono stati precedentemente descritti.9 Il probabile AD è stato diagnosticato sulla base dei criteri stabiliti dal National Institute of Neurological and Communicative Disorders and Stroke e dall’Alzheimer’s Disease and Related Disorders Association (NINCDS-ADRDA).15 La demenza frontotemporale è stata diagnosticata sulla base dei criteri sviluppati dai gruppi Lund e Manchester.16
quaranta pazienti con malattia di Parkinson (PD) sono stati indirizzati a una clinica dei disturbi del movimento dell’Università della California a Los Angeles per un intervento di pallidotomia a causa della sindrome on-off, tremore intrattabile o bradicinesia alle dosi massime di farmaci anti-PD. I pazienti sono stati esaminati da due neurologi e un neurochirurgo. I criteri di inclusione includevano una storia indicativa di PD idiopatica, compresi due dei quattro segni cardinali (tremore a riposo, rigidità, acinesia/bradicinesia e disturbi dell’andatura/instabilità posturale) e una chiara storia di risposta alla levodopa.
Ventidue pazienti con PSP sono stati visti presso un ambulatorio del National Institute of Neurological Disorders and Stroke (NINDS) e sono stati precedentemente descritti.11 Tutti i pazienti con PSP hanno soddisfatto i criteri di Blin per una probabile PSP.17,18
Trentaquattro pazienti con malattia di Huntington (HD) si sono presentati in una clinica specializzata dell’Università della California, San Diego, e tutti avevano il tipico disturbo coreiforme del movimento e almeno un parente di primo grado che aveva anche la HD.
I pazienti sono stati sottoposti a screening per malattie mentali croniche, trauma cranico, malattia cerebrovascolare, disturbi extrapiramidali diversi da quelli descritti, carenza di vitamine, ipotiroidismo, sifilide e altre condizioni mediche. Non tutti i pazienti con HD, PSP e PD avevano un deterioramento della memoria sufficiente a soddisfare i criteri DSM-IV per la demenza; tuttavia, tutti avevano malattie cerebrali degenerative come definito dalle loro diagnosi cliniche. Il nostro obiettivo primario non era il livello di demenza, ma il rapporto tra apatia e depressione. Le analisi secondarie hanno esaminato la relazione di questi sintomi con il deterioramento cognitivo.
Valutazione
I dati comportamentali sono stati raccolti durante le interviste ai caregiver usando l’NPI. Questo strumento valuta 10 comportamenti che si verificano nelle malattie demenziali, tra cui deliri, allucinazioni, agitazione, depressione, ansia, euforia, apatia, disinibizione, irritabilità e comportamento motorio aberrante (tra cui camminare, frugare e compulsioni). Un punteggio di frequenza (1-4) moltiplicato per un punteggio di gravità (1-3) produce un punteggio di subscala per ogni comportamento, e la somma dei punteggi di subscala produce il punteggio totale NPI. È stato utilizzato anche un altro approccio all’analisi in cui abbiamo assegnato 0 all’assenza media e 1 o più alla presenza media del sintomo. È stato dimostrato che NPI è valido se confrontato con una varietà di altri approcci diagnostici e che ha un’alta affidabilità inter-rater e test-retest.14 Sono state utilizzate una videocassetta di addestramento e domande scriptate per assicurare l’affidabilità cross-site.
La subscala dell’apatia include elementi come mostrare perdita di interesse, mancanza di motivazione, meno spontaneo, meno affettuoso, meno entusiasta, mancanza di emozioni, e non preoccuparsi di fare cose nuove. La subscala della depressione include elementi come triste, depresso, lacrimevole, di basso umore, sentirsi un fallimento, senza speranza per il futuro, sentirsi un peso, e desiderare la morte. La subscala della depressione non ha elementi relativi all’apatia e ha dimostrato di essere fortemente correlata alla scala della depressione di Hamilton.14 La subscala dell’apatia non ha elementi relativi alla tristezza.
La funzione cognitiva è stata valutata con il Mini-Mental State Examination (MMSE).19 Un punteggio perfetto sul MMSE è 30, e punteggi decrescenti indicano un deterioramento cognitivo più grave. L’NPI e il MMSE sono stati generalmente somministrati lo stesso giorno.
Analisi dei dati
Le due questioni centrali dello studio erano 1) come questi due sintomi erano correlati tra loro e 2) se la loro relazione era coerente o meno tra le diverse sindromi di demenza. Le correlazioni di Spearman sono state determinate per tutti e 10 i punteggi della subscala NPI e il punteggio totale MMSE. Una matrice separata è stata generata per ciascuno dei cinque gruppi di demenza e per il gruppo totale combinato. Un’analisi Kruskal-Wallis a una via della varianza (ANOVA) sui punteggi medi delle sottoscale è stata utilizzata per determinare le differenze di gruppo nella gravità della depressione e dell’apatia. Le analisi sono esplorative e un livello di significatività di 0,5 è stato accettato come significativo.
RESULTATI
Le caratteristiche cliniche dei 154 pazienti sono presentate nella tabella 1. C’era un numero quasi uguale di uomini e donne nei gruppi FTD e HD, ma c’erano più donne nel gruppo AD e più uomini in entrambi i gruppi PD e PSP. Il gruppo AD era in media circa 10 anni più vecchio dei gruppi FTD, PD e PSP e 30 anni più vecchio del gruppo HD. I punteggi MMSE erano simili in AD e FTD, e questi due gruppi avevano punteggi MMSE più bassi di 10 punti rispetto ai gruppi PD, HD e PSP.
La gravità dell’apatia e della depressione differiva significativamente tra i gruppi (Tabella 1). Un’ANOVA a una via di Kruskal-Wallis è stata utilizzata per confrontare i punteggi medi della subscala NPI tra i gruppi. Sono state trovate differenze significative tra i quattro gruppi, con i pazienti PD e HD che avevano l’apatia meno grave e la depressione più grave (Figura 1).
La frequenza di apatia e depressione e la relazione tra i due sintomi variava tra i gruppi diagnostici. Un gran numero di pazienti AD e un numero ancora maggiore di pazienti FTD e PSP avevano apatia senza depressione, mentre molti pazienti PD e HD avevano depressione senza apatia. Tutti i gruppi diagnostici avevano più pazienti con uno o l’altro sintomo che con entrambi i sintomi. La disparità tra apatia e depressione era particolarmente drammatica nei pazienti con PD e PSP. Pochi pazienti con PD avevano apatia da sola (n=2; 5%) rispetto al numero che aveva depressione da sola (11; 28%) o depressione più apatia (11; 28%), e pochi pazienti con PSP avevano depressione, ma avevano un’alta frequenza di apatia. Su 22 pazienti con PSP, 17 (77%) avevano apatia da sola,11 1 aveva depressione, e 3 avevano depressione più apatia (Tabella 1).
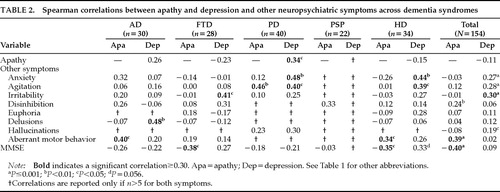
L’apatia non era correlata alla depressione nel campione combinato di pazienti con demenza (r=-0.11, P=0.18). C’era una correlazione negativa non significativa nei gruppi FTD (r=-0.23, P=0.23) e HD (r=-0.15, P=0.40), e c’era una correlazione positiva non significativa nel gruppo AD (r=0.26, P=0.16). Il gruppo PD è stato l’unico gruppo di demenza a mostrare una correlazione significativa tra i due sintomi (r=0,34, P=0,03; Tabella 2). Quindi, il modello di correlazione tra apatia e depressione differiva tra i gruppi diagnostici, e la presenza di uno non prediceva la presenza dell’altro.
L’NPI misura otto sintomi neuropsichiatrici oltre all’apatia e alla depressione. Alcuni di questi sintomi erano correlati all’apatia e altri, diversi, erano correlati alla depressione. Nel campione totale, l’apatia correlava con la disinibizione e il comportamento motorio aberrante, e la depressione correlava con l’ansia, l’agitazione, l’irritabilità e le allucinazioni (tabella 2).
L’apatia era correlata con una funzione cognitiva inferiore misurata dal MMSE nel campione totale (r= -0,40, P<0.0001), nel gruppo FTD (r= -0,38, P<0,05), e nel gruppo HD (r= -0,35, P<0,05). I gruppi AD e PD avevano una tendenza verso una funzione cognitiva più bassa con l’aumento dell’apatia, e il gruppo PSP non aveva alcuna correlazione tra apatia e funzione cognitiva. L’apatia non era correlata con l’avanzare dell’età.
La depressione non aveva una correlazione significativa con i punteggi MMSE nel campione combinato. In AD e PD, c’erano tendenze non significative verso una relazione tra depressione e funzione cognitiva inferiore. I pazienti con FTD e HD hanno mostrato tendenze non significative verso una relazione tra la gravità della depressione e una migliore funzione cognitiva, e c’erano troppo pochi pazienti PSP con depressione per sostenere un’analisi significativa.
DISCUSSIONE
L’apatia è molto diffusa nelle malattie neurodegenerative,5,9-13 e questo studio supporta ed estende i risultati dei pochi studi precedenti che affrontano la questione dell’apatia e della depressione come fenomeni clinici indipendenti.5,7,11,20 A differenza dell’Ham-D utilizzato in molti studi precedenti, la sottoscala della depressione dell’NPI non include item relativi all’apatia, e la sottoscala dell’apatia non ha domande relative alla depressione. Non abbiamo trovato alcuna correlazione tra apatia e depressione in 154 pazienti con cinque disturbi neurodegenerativi. Inoltre, i due sintomi erano associati ad altri sintomi neuropsichiatrici in modi diversi. L’apatia era associata a disinibizione e comportamento motorio aberrante; la depressione era associata ad ansia, agitazione, irritabilità e allucinazioni. L’apatia e la disinibizione possono sembrare comportamenti che si escludono a vicenda, ma entrambi sono mediati dai sistemi del lobo frontale e sono spesso visti insieme, soprattutto nei pazienti con FTD. Inoltre, i comportamenti problematici che portano a difficoltà di gestione o a una ridotta capacità funzionale possono essere principalmente legati alla disfunzione del lobo frontale, e studi precedenti hanno trovato che l’apatia è associata a questi sintomi.21,22
In questo e in studi precedenti, l’apatia era significativamente correlata a un aumento del deterioramento cognitivo (misurato dal MMSE) in AD e PD,5,13,20,23 ma non in PSP11 o HD.22 Il rapporto tra depressione e funzione cognitiva nella demenza è controverso. Alcuni studi hanno trovato un’associazione tra depressione e deterioramento cognitivo più grave,24 ma altri no.25 Non abbiamo trovato alcuna relazione coerente tra depressione e cognizione nel campione totale o nelle singole malattie. Tuttavia, il MMSE non testa adeguatamente la funzione del lobo frontale, che è frequentemente compromessa in molti disturbi demenziali, e non fornisce una misura valida di questa parte del declino cognitivo.
La relazione tra apatia e depressione sembra essere specifica della malattia. AD, FTD e PSP avevano un’apatia più prevalente e grave, mentre PD e HD avevano una depressione più prevalente e grave. I pazienti PSP hanno mostrato l’apatia più frequente e grave e la depressione minore. Uno studio precedente che ha usato diverse misure di apatia e di gravità della malattia ha trovato che i pazienti con HD erano più gravemente apatici dei pazienti con AD.22
La localizzazione anatomica della disfunzione regionale associata all’apatia e alla depressione sembra sovrapporsi notevolmente. La depressione è più frequente quando le lesioni focali sono anteriori e sul lato sinistro.26 Questo risultato è simile ma non identico ai risultati di studi metabolici in pazienti più giovani che mostrano che la depressione maggiore è associata all’ipometabolismo frontale, e specialmente frontale sinistro.27 La malattia di Parkinson con depressione è associata a un ridotto metabolismo del glucosio nella corteccia frontale inferiore28 e prefrontale mediale.29 Anche le aree paralimbiche come la corteccia prefrontale orbitale-inferiore e quella temporale sono state coinvolte nella depressione in pazienti con HD.30 L’apatia è il risultato di danni alle aree paralimbiche prefrontali mediali, cingolate anteriori e temporali anteriori, in particolare l’amigdala e le relative strutture sottocorticali.31-33 L’apatia nei pazienti con AD è stata correlata all’ipoperfusione frontotemporale in uno studio23 e all’ipoperfusione temporoparietale destra in un altro.21 L’apatia può anche verificarsi con ictus che coinvolgono l’arto posteriore della capsula interna.20 L’apatia è stata solo recentemente al centro delle indagini, e ci possono essere diverse forme di apatia mediate da una rete di strutture correlate. I correlati anatomici dell’apatia richiedono ulteriori indagini, ma le osservazioni qui suggeriscono che le regioni frontali coinvolte nella FTD e le strutture diencefaliche interessate nella PSP sono particolarmente rilevanti.
Alcune delle sovrapposizioni riportate tra depressione e apatia possono essere dovute all’uso di strumenti per la depressione che contengono item sull’apatia. Un’altra possibile spiegazione è che circuiti simili potrebbero essere coinvolti in entrambi i sintomi, ma potrebbero differire nel grado di coinvolgimento dei neurotrasmettitori tra i diversi disturbi. Gli agenti serotoninergici spesso alleviano la depressione ma possono aumentare l’apatia, mentre gli agenti dopaminergici possono alleviare l’apatia34,35 ma sono inefficaci come antidepressivi; nelle malattie con deficit di acetilcolina come il MA, un agente colinomimetico può essere utile per ridurre l’apatia, ma non ha effetto sull’umore.36 Una potenziale spiegazione per le diverse risposte terapeutiche della depressione e dell’apatia è che la depressione risulta quando uno squilibrio nella funzione dei neurotrasmettitori paralimbici provoca un’eccessiva emozione negativa, mentre l’apatia si verifica quando la corteccia è funzionalmente scollegata da input paralimbici rilevanti.
Le limitazioni e i punti di forza di questo studio devono essere riconosciuti. In primo luogo, la valutazione comportamentale era un obiettivo primario nella raccolta di questi dati, ma le ipotesi specifiche presentate qui non sono state dichiarate prospetticamente e le analisi sono post hoc. In secondo luogo, la depressione e l’apatia sono esperienze umane soggettive, e le strategie informative del caregiver impiegate da NPI potrebbero non essere del tutto accurate – sebbene vi siano prove che suggeriscono che i caregiver sono in grado di fornire valutazioni valide della depressione e dell’apatia.8,37 In terzo luogo, i pazienti con PD, HD e PSP avevano un deterioramento cognitivo significativamente inferiore, il che potrebbe spiegare alcune delle differenze che abbiamo descritto come specifiche della malattia. Quarto, i farmaci psicotropi possono causare apatia e depressione, e non possiamo garantire che alcuni dei nostri pazienti non li stessero assumendo; tuttavia, queste valutazioni sono state generalmente effettuate durante la visita iniziale prima della terapia farmacologica. Infine, non abbiamo dati autoptici per confermare la nostra accuratezza diagnostica.
Lo studio è rafforzato dalla presenza di un ampio gruppo di pazienti con disturbi neurodegenerativi e un’ampia variazione nell’espressione clinica e patologica delle loro malattie, che ci permette di trarre conclusioni sul rapporto tra apatia e depressione in presenza di percorsi neurali differenzialmente compromessi. Inoltre, l’uso di uno strumento affidabile e valido che separa i due costrutti permette un confronto significativo.
Concludiamo che l’apatia è comune nelle malattie neurodegenerative ed è separabile dalla depressione. Può essere trattabile con farmaci dopaminergici o colinergici, e la sua presenza dovrebbe essere ricercata nel corso di una valutazione neuropsichiatrica di routine. L’apatia non dovrebbe essere attribuita alla depressione, e la diagnosi di depressione dovrebbe essere basata su sintomi di tristezza e sentimenti di impotenza, disperazione e inutilità.
Riconoscimenti
Questo progetto è stato sostenuto da una borsa di studio di Neuroscienze del Dipartimento degli Affari dei Veterani, da una sovvenzione del National Institute on Aging Alzheimer’s Disease Center (AG10123) e dal Sidell-Kagan Research Fund.
Tabella 1.
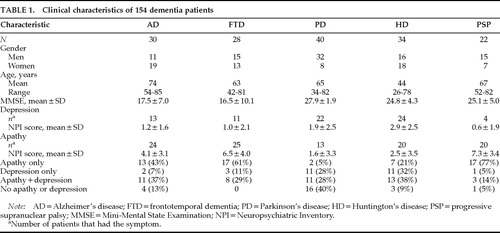
Tabella 2.
1. Marin RS: diagnosi differenziale e classificazione dell’apatia. Am J Psychiatry 1990; 147:22-30Crossref, Medline, Google Scholar
2. American Psychiatric Association: Manuale diagnostico e statistico dei disturbi mentali, 4a edizione. Washington, DC, American Psychiatric Association, 1994Google Scholar
3. Hamilton M: A rating scale for depression. J Neurol Neurosurg Psychiatry 1960; 23:56-62Crossref, Medline, Google Scholar
4. Marin RS, Firinciogullari S, Biedrzycki RC: Le fonti di convergenza tra misure di apatia e depressione. J Affect Disord 1993; 28:117-124Crossref, Medline, Google Scholar
5. Starkstein SE, Mayberg HS, Preziosi TJ, et al: Affidabilità, validità e correlati clinici dell’apatia nella malattia di Parkinson. J Neuropsychiatry Clin Neurosci 1992; 4:134-139Link, Google Scholar
6. Marin RS: Apatia: una sindrome neuropsichiatrica. J Neuropsychiatry Clin Neurosci 1991; 3:243-254Link, Google Scholar
7. Marin RS, Firinciogullari S, Biedrzycki RC: Differenze di gruppo nel rapporto tra apatia e depressione. J Nerv Ment Dis 1994; 182:235-239Crossref, Medline, Google Scholar
8. Marin RS, Biedrzycki RC, Firinciogullari S: Affidabilità e validità della scala di valutazione dell’apatia. Psychiatry Res 1991; 38:143-162Crossref, Medline, Google Scholar
9. Levy ML, Miller BL, Cummings JL, et al: Malattia di Alzheimer e demenze frontotemporali: distinzioni comportamentali. Arch Neurol 1996; 53:687-690Crossref, Medline, Google Scholar
10. Mega MS, Cummings JL, Fiorello T, et al: Lo spettro dei cambiamenti comportamentali nella malattia di Alzheimer. Neurology 1996; 46:130-135Crossref, Medline, Google Scholar
11. Litvan I, Mega MS, Cummings JL, et al: Aspetti neuropsichiatrici della paralisi sopranucleare progressiva. Neurology 1996; 47:1184-1189Crossref, Medline, Google Scholar
12. Bozzola FG, Gorelick PB, Freels S: Cambiamenti di personalità nella malattia di Alzheimer. Arch Neurol 1992; 49:297-300Crossref, Medline, Google Scholar
13. Devanand DP, Brockington CD, Moody BJ, et al: Sindromi comportamentali nella malattia di Alzheimer. International Psychogeriatrics 1992; 4(suppl)2:161-184Google Scholar
14. Cummings JL, Mega M, Gray K, et al: The Neuropsychiatric Inventory: valutazione completa della psicopatologia nella demenza. Neurology 1994; 44:2308-2314Crossref, Medline, Google Scholar
15. McKhann G, Drachman D, Folstein M, et al: Diagnosi clinica della malattia di Alzheimer: rapporto del gruppo di lavoro NINCDS-ADRDA sotto gli auspici del Dipartimento della Salute e dei Servizi Umani Task Force sulla malattia di Alzheimer. Neurology 1984; 34:939-944Crossref, Medline, Google Scholar
16. Brun A, Englund B, Gustafson L, et al: Consensus statement: Criteri clinici e neuropatologici per la demenza frontotemporale: i gruppi di Lund e Manchester. J Neurol Neurosurg Psychiatry 1994; 57:416-418Crossref, Medline, Google Scholar
17. Litvan I, Agid Y, Jankovic J, et al: Accuratezza dei criteri clinici per la diagnosi di paralisi sopranucleare progressiva (sindrome di Steele-Richardson-Olszewski): rapporto del NINDS-SPSP International Workshop. Neurology 1996; 47:1-9Crossref, Medline, Google Scholar
18. Blin J, Baron JC, Dubois B, et al: Studio di tomografia ad emissione di positroni nella paralisi sopranucleare progressiva. Modello ipometabolico del cervello e correlazioni clinicometaboliche. Arch Neurol 1990; 47:747-752Crossref, Medline, Google Scholar
19. Folstein MF, Folstein SE, McHugh PR: “Mini-Mental State”: un metodo pratico per valutare lo stato cognitivo dei pazienti per il clinico. J Psychiatr Res 1975; 12:189-198Crossref, Medline, Google Scholar
20. Starkstein SE, Fedoroff JP, Price TR, et al: Apatia dopo lesioni cerebrovascolari. Stroke 1993; 24:1625-1630Crossref, Medline, Google Scholar
21. Ott BR, Noto RB, Fogel BS: Apatia e perdita di intuizione nella malattia di Alzheimer: uno studio di imaging SPECT. J Neuropsychiatry Clin Neurosci 1996; 8:41-46Link, Google Scholar
22. Paulsen JS, Stout JC, DeLaPena J, et al: Sindromi comportamentali frontali nella demenza corticale e sottocorticale. Assessment 1996; 3:327-337Crossref, Google Scholar
23. Craig AH, Cummings JL, Fairbanks L, et al: Flusso sanguigno cerebrale correlato all’apatia nella malattia di Alzheimer. Arch Neurol 1996; 53:1116-1120Crossref, Medline, Google Scholar
24. Cooper JK, Mungas D, Weiler PG: Relazione tra stato cognitivo e comportamenti anomali nella malattia di Alzheimer. J Am Geriatr Soc 1990; 38:867-870Crossref, Medline, Google Scholar
25. Sultzer DL, Levin HS, Mahler ME, et al: Valutazione dei disturbi cognitivi, psichiatrici e comportamentali nei pazienti con demenza: la Neurobehavioral Rating Scale. J Am Geriatr Soc 1992; 40:549-555Crossref, Medline, Google Scholar
26. Starkstein SE, Robinson RG: Depression in cerebrovascular disease, in Depression in Neurologic Disease, edited by Starkstein SE, Robinson RG. Baltimora, Johns Hopkins University Press, 1993, pp 28-49Google Scholar
27. Baxter LR, Schwartz JM, Phelps ME, et al: Riduzione del metabolismo del glucosio della corteccia prefrontale comune a tre tipi di depressione. Arch Gen Psychiatry 1989; 46:243-250Crossref, Medline, Google Scholar
28. Mayberg HS, Starkstein SE, Sadzot B, et al: ipometabolismo selettivo nel lobo frontale inferiore in pazienti depressi con malattia di Parkinson. Ann Neurol 1990; 28:57-64Crossref, Medline, Google Scholar
29. Ring HA, Bench CJ, Trimble MR, et al: Depression in Parkinson’s disease: a positron emission study. Br J Psychiatry 1994; 165:333-339Crossref, Medline, Google Scholar
30. Mayberg HS: Studi di neuroimaging della depressione nella malattia neurologica, in Depression in Neurologic Disease, a cura di Starkstein SE, Robinson RG. Baltimora, Johns Hopkins University Press, 1993, pp 186-216Google Scholar
31. Cummings JL: Circuiti frontali-sottocorticali e comportamento umano. Arch Neurol 1993; 50:873-880Crossref, Medline, Google Scholar
32. Duffy JD: I substrati neurali della motivazione. Psychiatric Annals 1997; 27:24-29Crossref, Google Scholar
33. Marin RS: Apatia: concetto, sindrome, meccanismi neurali e trattamento. Seminars in Clinical Neuropsychiatry 1996; 1:304-314Medline, Google Scholar
34. Marin RS, Fogel BS, Hawkins J, et al: Apatia: una sindrome trattabile. J Neuropsychiatry Clin Neurosci 1995; 7:23-30Link, Google Scholar
35. Watanabe MD, Martin EM, DeLeon OA, et al: Successo del trattamento con metilfenidato dell’apatia dopo infarti sottocorticali. J Neuropsychiatry Clin Neurosci 1995; 7:502-504Link, Google Scholar
36. Kaufer DI, Cummings JL, Christine D: Effect of tacrine on behavioral symptoms in Alzheimer’s disease: an open-label study. J Geriatr Psychiatry Neurol 1996; 9:1-6Crossref, Medline, Google Scholar
37. Logsdon RG, Teri L: Depressione nei pazienti con malattia di Alzheimer: caregivers come reporter surrogati. J Am Geriatr Soc 1995; 43:150-155Crossref, Medline, Google Scholar