Heeft u ooit gevraagd “wat is het verschil tussen pH en alkaliteit? Velen onder ons verwarren de totale alkaliteit met de pH. Dat is begrijpelijk, gezien de vage scheidslijn tussen woorden als “alkalisch” en “alkaliteit”. In de waterchemie zijn alkaliteit en pH inderdaad nauw verwant, maar ze zijn niet hetzelfde. Dit artikel maakt een onderscheid tussen beide.
Beluister dit onderwerp op onze Podcast:
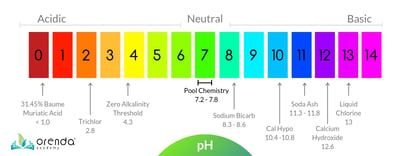
Wat is pH?
 De pH-schaal
De pH-schaalpH staat voor potenz Waterstof, meer algemeen aangeduid als de “kracht van Waterstof”. Het is de negatieve logaritme van de waterstofionenconcentratie in een oplossing. Hoe lager de pH, hoe exponentieel meer Waterstof.
pH = -log(H+)
We meten hoe zuur of basisch (ook wel alkalisch genoemd) stoffen zijn met behulp van de pH-schaal. De pH-schaal loopt van 0 tot 14, en is relatief ten opzichte van zuiver water, dat een volkomen neutrale pH heeft van 7. Wanneer de concentratie waterstofionen stijgt, daalt de pH (en vice versa). De schaal is logaritmisch, wat betekent dat elk geheel getal op de 1-14 pH-schaal 10 keer meer of minder is dan de getallen eromheen. Bijvoorbeeld, iets met een pH van 6,0 zou 10 keer zuurder zijn dan 7,0 pH gedestilleerd water. Iets met een pH van 5,0 is 10x zuurder dan 6,0, en 100x zuurder dan 7,0 (10×10=100).
Om de pH-schaal in perspectief te plaatsen, laten we even snel rekenen. Trichloor, een populair type gestabiliseerd chloor dat vooral in buitenzwembaden wordt gebruikt, heeft een pH van ongeveer 3. Laten we het voor dit rekensommetje afronden op precies 3,0. Hoe zuur is 3.0pH Trichloor in vergelijking met 7.0pH water? Laten we dat eens uitzoeken.
(7,0pH – 3,0pH) = 4,0
Logaritmische schaal betekent 104, of 10x10x10x10 = 10.000
Trichloor is ongeveer 10.000 keer zuurder dan zuiver water.
Maak je geen zorgen over de wiskunde, het is alleen maar om de pH-schaal zelf uit te leggen. Vanuit het oogpunt van de waterchemie vertellen de leerboeken ons dat de ideale pH voor een zwembad of spa tussen 7,4-7,6 ligt. Maar realistisch gezien stijgt de pH in de meeste zwembaden na verloop van tijd, dus het normale bereik voor zwembaden ligt eerder tussen 7,4 en 8,2.
De rol van pH in de waterchemie
Chloorgehalte (%HOCl)
Het beheren van de pH is een essentieel onderdeel van het handhaven van een gezonde en evenwichtige waterchemie. Het is zo belangrijk omdat pH een drijvende factor is in de Langelier Saturation Index (LSI), en ook omdat pH bepaalt hoe effectief chloor zal zijn in niet-gestabiliseerde zwembaden. Dus in zwembaden zonder cyanuurzuur (CYA), hoe lager de pH, hoe sterker chloor zal zijn, omdat pH de dissociatie-evenwichten tussen sterk en zwak chloor regelt:
HOCl ⇌ H+ + OCl-
Hypochlorietzuur valt uiteen in waterstof en hypochloriet-ion
Ook hier geldt dat de pH de sterkte van chloor (%HOCl) bepaalt, want hoe lager de pH, hoe hoger de concentratie waterstof. Dat betekent een hoger % sterke HOCl versus zwakke OCl-. Dit is niet zo relevant in zwembaden met CYA, omdat isocyanuraten de zwembadchemie fundamenteel veranderen.
 Calciumcarbonaat oplosbaarheid
Calciumcarbonaat oplosbaarheid
Terwijl de LSI bepaalt wanneer water oververzadigd is met calciumcarbonaat (CaCO3), is pH een belangrijke factor op de LSI. En aangezien LSI-overschrijdingen plaatselijk voorkomen, niet universeel in een zwembad, is de pH van groot belang. Er is bijvoorbeeld een grafiek hieronder die de evenwichten van alkaliteitstypen laat zien. Wanneer de pH 8,2 of 8,3 wordt, wordt het erg moeilijk voor calcium om in oplossing te blijven, omdat carbonaatalkaliteit (CO3-) zich erg goed bindt met calcium (Ca++). Dus als je pH te hoog wordt, heeft calcium de neiging om uit de oplossing neer te slaan, zelfs als de totale LSI van je zwembad in balans is. We zien dat dit fenomeen zwembaden vertroebelt, bijvoorbeeld wanneer iemand te snel natriumcarbonaat toevoegt.
CO2 bepaalt pH
De hoeveelheid kooldioxide (CO2) in uw water bepaalt grotendeels de pH. Hoe meer CO2, hoe lager de pH, en omgekeerd. Dit verklaart waarom waterpartijen, verdwijnranden en spastralen de pH sneller doen stijgen dan in stilstaand water; beluchting versnelt het verlies van CO2 aan de atmosfeer.
gevolgen voor de pH
Een lage pH verlaagt de LSI, en kan schade veroorzaken aan oppervlakken en apparatuur, corrosie van metalen onderdelen in en rond het zwembad, huid- en oogirritatie, en algemeen ongemak voor de patiënt. Aan de andere kant verhoogt een hoge pH de LSI en leidt tot carbonaatvorming, troebel water en zwakker chloor (in niet-gestabiliseerde zwembaden). In de handboeken staat dat u tussen 7,4 en 7,6 moet blijven om deze problemen te voorkomen, maar met een LSI-strategie kunt u deze problemen beter voorkomen dan door gewoon binnen dit bereik te blijven.
Wat is totale alkaliteit?
De totale alkaliteit is een maat voor de concentratie van alle alkalische stoffen die in het water zijn opgelost en die waterstofionen kunnen aantrekken en afgeven. Deze interferentie met waterstof is de reden waarom de alkaliteit een buffer vormt tegen de verandering in pH. De totale alkaliteit bestaat hoofdzakelijk uit bicarbonaat, carbonaat en hydroxide, samen met een paar andere zoals cyanuraatalkaliteit. Wanneer zuur wordt toegevoegd, hebben deze alkaliën het vermogen een deel van het zuur te neutraliseren. Eenvoudiger gezegd, de totale alkaliteit is een maat voor het vermogen van het water om weerstand te bieden tegen veranderingen in pH. De alkaliteit vertraagt met name de verlaging van de pH. Te veel alkaliteit is in feite een bron van stijgende pH. Hoe meer alkaliteit, hoe meer zuur er nodig is om de pH te verlagen.
Gerelateerd: Wat is Alkaliteit?
 De totale alkaliteit wordt gemeten aan de hand van de concentratie in delen per miljoen (ppm), en het ideale bereik ligt tussen 80-120 ppm, afhankelijk van het type chloor dat u gebruikt. Trichloor heeft bijvoorbeeld een lage pH van 2,8, dus gezien het zuurgehalte van trichloor heeft een trichloorzwembad een hogere alkaliteit nodig. Een andere reden voor meer alkaliteit in een trichloor zwembad is omdat de CYA in trichloor de alkaliteit compenseert bij het doen van LSI correcties.
De totale alkaliteit wordt gemeten aan de hand van de concentratie in delen per miljoen (ppm), en het ideale bereik ligt tussen 80-120 ppm, afhankelijk van het type chloor dat u gebruikt. Trichloor heeft bijvoorbeeld een lage pH van 2,8, dus gezien het zuurgehalte van trichloor heeft een trichloorzwembad een hogere alkaliteit nodig. Een andere reden voor meer alkaliteit in een trichloor zwembad is omdat de CYA in trichloor de alkaliteit compenseert bij het doen van LSI correcties.
Niet gestabiliseerde chloor, zoals vloeibare chloor (bleekmiddel) of cal hypo, hebben elk een hoge pH. U kunt dus een lagere alkaliteit hebben, zoals 80-100 ppm, of zelfs lager dan 80 ppm als uw LSI dat toelaat. Zwembaden met zout chloor hebben vaak te kampen met kalkaanslag die van de zoutcel afschilfert en het zwembad in waait. Zoutzwembaden kunnen in het seizoen meestal baat hebben bij lagere alkaliteitsniveaus, zoals 60-70 ppm, mits de LSI in evenwicht blijft. De sleutel is om zuur te meten en te verdunnen voor het gieten om overcorrecties te vermijden. Te veel zuur bij een lagere alkaliteit veroorzaakt grotere problemen, dus wees voorzichtig.
Heb je gemerkt dat de totale alkaliteit niet wordt gemeten op de pH-schaal?
Dit is een belangrijk onderscheid, omdat dit meestal de manier is waarop pH en alkaliteit worden verward. De totale alkaliteit wordt gemeten aan de hand van de hoeveelheid, of concentratie (ppm) in het water, niet aan de hand van hoe alkalisch (pH) het water is. Producten voor het verhogen van de alkaliteit zijn wijdverbreid in de zwembadindustrie. Als u op zoek bent naar een middel om de alkaliteit te verhogen, zijn de twee meest gebruikte natriumbicarbonaat (NaHCO3) en natriumcarbonaat (Na2CO3), beter bekend als natriumcarbonaat. Alkaliteitsverlagende producten zijn zuren zoals zoutzuur of natriumbisulfaat.
De rol van de totale alkaliteit in de waterchemie
Als zwembadbeheerder weet u waarschijnlijk al dat de pH op en neer kan fluctueren. En wanneer dat gebeurt, is het zwembad voortdurend in gevecht met u. Het juiste niveau van totale alkaliteit is een goede zaak, omdat het helpt om de pH gestabiliseerd te houden. Een eenvoudige manier om over alkaliteit na te denken is dat het voorkomt dat de pH te gemakkelijk verandert, vooral naar beneden toe.
Technisch gezien buffert alkaliteit de pH door naar behoefte een waterstofion (H+) af te geven of te absorberen. Dus wanneer zuur wordt toegevoegd, kunnen carbonaationen waterstof absorberen om bicarbonaationen te creëren. Dit is een evenwicht, net als pH, dus het kan ook de andere kant op gaan. Het evenwicht ziet er als volgt uit:
HCO3- + H+ ↔ H2CO3
Omdat CO2 de pH van het water regelt, kun je ofwel direct CO2 toevoegen om de pH te verlagen, of je kunt zuur gebruiken om bicarbonaatalkaliteit om te zetten in koolzuur (H2CO3), wat gewoon opgelost CO2 is: (H2O + CO2 → H2CO3).

Je zou meerdere kilo’s 8,3pH natriumbicarbonaat kunnen toevoegen en dezelfde pH-impact kunnen hebben als wanneer je een veel kleinere hoeveelheid 11,6 pH natriumcarbonaat zou toevoegen. Maar de totale alkaliteit zou hoger zijn voor de Natrium Bicarb, omdat er gewoon meer van in het water zit.
Hoe de totale alkaliteit en pH te verhogen
Als u de totale alkaliteit in een zwembad wilt verhogen, moet u het aantal liters van het zwembad weten, en uw pH. Het helpt om een nauwkeurige doseringscalculator te hebben. Het verhogen van de alkaliteit is zo eenvoudig als het toevoegen van natriumbicarbonaat aan het water.
Gerelateerd: Hoe de alkaliteit en pH te verhogen
Hoe de totale alkaliteit en pH te verlagen
U kunt de alkaliteit verlagen met behulp van zuur. Sommige experts bevelen een “zuurkolom-gieting” aan om de alkaliteit te verlagen, maar wij doen dat niet. Onze ervaring – en wetenschappelijke experimenten bevestigen dit – is dat kolom gieten schadelijker is dan verdunnen. Wij raden aan het zuur te verdunnen in een emmer water en het gelijkmatig over het zwembad te gieten. Bovendien kan het gieten in kolommen de pH op een geconcentreerde plaats (op de bodem van uw zwembad!) sterk verlagen, wat de LSI kan verstoren, en op zijn beurt het oppervlak kan etsen. De pH verlagen zonder de totale alkaliteit aan te tasten kan worden bereikt door kooldioxide te injecteren. Maar dat is een onderwerp voor een andere keer.
Gerelateerd: Hoe pH en alkaliteit te verlagen
Conclusie
Houd uw zwembad in de eerste plaats in LSI-balans. Probeer vervolgens uw alkaliniteit binnen een bereik te houden dat het meest gunstig is voor uw primaire chloortype. Gebruik een alkaliteitverhoger zoals natriumbicarbonaat om de totale alkaliteit te verhogen, of een zuur om deze te verlagen. Als u chloor met een hoge pH-waarde gebruikt, zoals zoutchloorgeneratoren, vloeibare chloor of cal hypo, hebt u minder alkaliniteit nodig, bijvoorbeeld 60-80 ppm. Voor chloor met een lage pH-waarde, zoals Trichlor, is 100-120 ppm wellicht een beter bereik. Raadpleeg uw testkit of de doseringscalculator op de Orenda App voor specifieke getallen.
Terzijde: meng nooit verschillende soorten chloor. Ze kunnen ontploffen. Letterlijk.
Mensen verwarren pH met alkaliteit en we kunnen begrijpen waarom. Onthoud alleen dat pH een evenwicht is dat ons vertelt hoe zuur of hoe basisch een oplossing is. De totale alkaliteit meet de hoeveelheid of concentratie (in delen per miljoen) opgeloste alkali die de verandering van pH kan bufferen door waterstof vrij te maken of aan te trekken. We hopen dat dit helpt!