1. Morfologia
2. warstwa podstawna
3. warstwa kolczysta
4. warstwa ziarnista
5. Warstwa rogowa
6. Funkcje
Keratynocyty są głównymi składnikami komórkowymi naskórka. Wydzielają one bardzo mało macierzy zewnątrzkomórkowej, dzięki czemu błona plazmatyczna sąsiadujących ze sobą keratynocytów jest bardzo blisko siebie. Spójność keratynocytów wzmacniana jest przez liczne desmosomy, które utrzymują integralność naskórka. Keratyny, rodzaj filamentu pośredniego cytoszkieletu, stanowią główną rodzinę białek syntetyzowanych przez keratynocyty. Keratynocyty przechodzą przez charakterystyczny cykl życiowy, który rozpoczyna się w warstwie podstawnej naskórka, a kończy w bardziej powierzchownej lub wolnej powierzchni naskórka.
Morfologia i różnicowanie
Morfologia keratynocytów zmienia się podczas cyklu życiowego, który u człowieka trwa około 1 miesiąca. Zmiany zachodzą stopniowo od warstwy podstawnej, gdzie keratynocyty się rodzą, aż do warstwy powierzchownej, gdzie obumierają i odłączają się od naskórka. Z różnic morfologicznych keratynocytów wynikają cechy warstw naskórka. Warstwy lub warstwy (stratum w liczbie pojedynczej) to: warstwa podstawna (stratum basale), warstwa kolczysta (stratum spinosum), warstwa ziarnista (stratum granulosum) i warstwa rogowa (stratum corneum). Warstwy te mogą zmieniać swoją grubość w zależności od okolicy ciała (rys. 1). I tak grubość naskórka, czyli grubość warstw, może wynosić od 50 µm w okolicach ciała o niewielkim obciążeniu mechanicznym do 1 mm w okolicach takich jak dłonie i podeszwy stóp, gdzie tarcie jest większe.

Stratum basale

Warstwa podstawna lub warstwa podstawna (ryc. 2 i 4) to jedna gruba warstwa komórek składająca się głównie z keratynocytów znajdujących się w głębszej części naskórka. Komórki te są połączone z blaszką podstawną za pomocą hemidesmosomów. Połączenie to pomaga w utrzymaniu integralności nabłonka i kontroluje proliferację i różnicowanie keratynocytów.
Komórki macierzyste keratynocytów znajdują się w warstwie podstawnej. Mają kształt okrągły do kolumnowego, wielkość ok. 6-10 µm i wykazują większe powinowactwo do barwników zasadowych niż keratynocyty zróżnicowane ze względu na dużą zawartość rybosomów. Komórki macierzyste naskórka interfolikularnego różnicują się w keratynocyty, ale nie w inne typy komórek naskórka. W mieszkach włosowych znajdują się również komórki macierzyste keratynocytów, które różnicują się w komórki mieszków włosowych (keratynocyty i gruczoły łojowe) oraz w keratynocyty naskórka międzykolczystego.
Szczepy proliferacji i różnicowania komórek macierzystych keratynocytów oraz tempo wymiany dojrzałych keratynocytów muszą być podobne w nabłonku. Tempo reparacji zależy od okoliczności, takich jak naprawa rany, tarcie czy wzrost narządu. Kontakt komórek macierzystych z blaszk± podstawn± wydaje się być istotny dla regulacji tempa proliferacji. Na przykład, gdy integryny, białka adhezyjne, które przyczepiają keratynocyty do blaszki podstawnej, tracą kontakt z blaszką podstawną, komórki macierzyste zaczynają się różnicować i migrować do górnych warstw naskórka.
Keratynocyty warstwy podstawnej syntetyzują część blaszki podstawnej. Integryny, które przyłączają keratynocyty do blaszki podstawnej, są również zaangażowane w utrzymanie integralności blaszki podstawnej.
Stratum spinosum
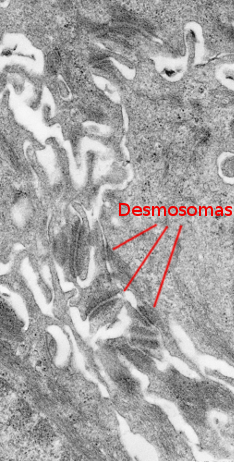
Stratum spinosum znajduje się tuż nad warstwą podstawną (ryc. 2 i 4). Zbudowana jest z mniej lub bardziej wielościankowych keratynocytów o wielkości około 10-15 µm, większych niż w warstwie podstawnej, z bardziej eozynofilową cytoplazmą i jednym lub dwoma wyraźnie widocznymi jądrami. W cytoplazmie obecnych jest wiele wiązek keratyny, zwanych tonofilamentami, które łączą się ze sobą, tworząc tonofibryle. Tonofibryle mogą być obserwowane w mikroskopie świetlnym i przyczyniają się do zabarwienia cytoplazmy eozyną. W tej warstwie keratynocyty nazywane są keratynocytami kolczystymi, ponieważ mają wiele desmosomów (rysunek 3) i połączeń przylegających. Te połączenia komórka-komórka są promieniście rozmieszczone w błonie plazmatycznej i połączone przez tonofibryle. W mikroskopie świetlnym połączenia komórkowe wyglądają jak kolce, stąd nazwa tej warstwy.
Keratynocyty wykazują ekspresję keratyn filamentu pośredniego w cytoplazmie. Typ wyrażonej keratyny zmienia się w miarę przesuwania się keratynocytów ku górnej powierzchni nabłonka. W bardziej powierzchownej części warstwy kolczystej keratynocyty stają się bardziej spłaszczone w kształcie, co prawdopodobnie jest spowodowane postępującą zmianą typu syntetyzowanych keratyn.
Warstwa spinosum jest grubsza w tych regionach skóry, które są narażone na tarcie lub mechaniczne rozciąganie. Silna adhezja komórkowo-komórkowa w tej warstwie pomaga uzyskać bardziej odporny naskórek.
Stratum granulosum
W zewnętrznych warstwach warstwy ziarnistej keratynocyty zmieniają ekspresję genów i wytwarzają ziarnistości kerato-hialinowe (ryc. 2 i 4). Warstwa ziarnista jest stosunkowo cienka, ok. 15 µm, a keratynocyty są spłaszczone i wykazują w cytoplazmie liczne ziarnistości kerato-hialinowe. Granulki te są wielokątne, nie odgraniczone błoną i silnie bazofilne. Stopniowo rosną, wzmacniają barierę naskórkową i są punktem wyjścia do rogowacenia lub keratynizacji górnych warstw naskórka.

Ciała lamelarne obserwuje się w warstwie ziarnistej. Te struktury komórkowe nie występują w warstwie podstawnej, a zaczynają być widoczne w warstwie kolczystej (stratum spinosum). W warstwie ziarnistej występują bardzo licznie. Ciałka lamelarne są organellami o wielkości około 100 do 300 nm, zbudowanymi ze stosów warstw lipidowych, dzięki czemu wykazują strukturę lamelarną. Ich funkcja odbywa się w warstwie rogowej naskórka i jest związana z procesem odrywania się komórek w tej warstwie oraz z nieprzepuszczalnością naskórka. Ciała lamelarne są egzocytowane, a ich składniki są modyfikowane zewnątrzkomórkowo, tworząc warstwy lipidowe równoległe do powierzchni skóry.
Jądro i organelle komórek w warstwie ziarnistej ulegają degradacji, a cytoplazma jest prawie pełna włókien keratynowych. W ostatnich etapach różnicowania się komórek zwiększa się ich przepuszczalność dla wapnia i innych jonów. Jony wzmagają aktywację transglutaminaz i prowadzą do powstania pod błoną plazmatyczną struktury białkowej zwanej otoczką komórkową. Struktura ta zwiększa swoją grubość w miarę degeneracji keratynocytów i jest ważna dla organizacji filamentów keratynowych równoległych do powierzchni nabłonka oraz dla łączenia tych filamentów z pozakomórkowymi ciałkami blaszkowatymi.
Ciasne połączenia między keratynocytami warstwy ziarnistej tworzą szczelną barierę, którą mogą przekroczyć tylko małe cząsteczki i jony. Keratynocyty obumierają w procesie zwanym rogowaceniem, stając się komórkami jądrowymi o kształcie rogowym. Kornifikacja jest mechanizmem odmiennym od apoptozy. Przed śmiercią keratynocyty syntetyzują białka i lipidy, które przyczyniają się do tworzenia powierzchownej bariery naskórka.
Stratum lucidum jest warstwą keratynocytów znajdującą się pomiędzy warstwą ziarnistą a warstwą rogową. Występuje w okolicach skóry narażonych na silne obciążenia mechaniczne, np. na podeszwach.
Strata rogowa
Warstwę rogową tworzą zdegenerowane keratynocyty, tzw. korneocyty (ryc. 5). Korneocyty są połączone desmosomami (korneosomy) ze sobą i osadzone w macierzy zewnątrzkomórkowej wzbogaconej w niepolarne lipidy, zorganizowanej w warstwy. W ostatnich etapach korneocyty tracą jądro komórkowe, wypełniają się keratynami i są otoczone warstwą białek, a także okrywą z chemicznie związanych lipidów.

Grubość warstwy rogowej naskórka jest zmienna i zależy od ogólnej grubości naskórka. I tak, im więcej keratynocytów jest produkowanych w warstwie podstawnej, tym większą grubość obserwuje się w warstwie kolczystej i rogowej. Obumieranie komórek w warstwie ziarnistej prowadzi do utraty desmosomów wzdłuż warstwy rogowej naskórka, co powoduje osłabienie połączeń komórkowo-komórkowych, a w konsekwencji odrywanie się komórek i fragmentów komórek od naskórka. Filagryna i keratyna stanowią 80-90% białek warstwy rogowej naskórka.
Warstwa ta chroni przed wysuszeniem, patogenami oraz uszkodzeniami chemicznymi i fizycznymi. Dla naskórka ważne jest przetwarzanie lipidów w ciałach blaszkowatych. Na przykład glicerol jest tworzony z ciałek blaszkowatych i pomaga naskórkowi utrzymać nawilżenie. Wolne lipidy powierzchniowe przyczyniają się do utrzymania lekko kwaśnego odczynu naskórka, którego pH u ludzi wynosi około 5. Ponadto siarczan cholesterolu jest przekształcany w cholesterol, który uczestniczy w odrywaniu bardziej powierzchownych warstw warstwy rogowej naskórka. Uwolnione lipidy są zorganizowane w kilka arkuszy, które umożliwiają nieprzepuszczalność naskórka.
Funkcje
Keratynocyty tworzą naskórek skóry, a ich główną funkcją jest organizowanie bariery pomiędzy środowiskiem zewnętrznym i wewnętrznym. Chronią one przed uszkodzeniami mechanicznymi, promieniowaniem ultrafioletowym, patogenami i szkodliwymi substancjami chemicznymi. Bardzo ważną rolą naskórka jest zapobieganie utracie wody. Ponadto keratynocyty są bardzo aktywne podczas naprawy po zranieniu.
Bariera utraty wody
Przeciwdziałanie utracie wody opiera się głównie na warstwie rogowej naskórka. Jest ona jak mur z przerwami i zaprawą, gdzie przerwami są komórki, a zaprawą są pozakomórkowe agregaty lipidowe.
Bariera przed patogenami
Naskórek jest pierwszą fizyczną przeszkodą, którą patogeny muszą pokonać, aby dostać się do organizmu. Ponadto keratynocyty uwalniają cytokiny, które hamują i neutralizują patogeny. Po zranieniu lub uszkodzeniu, keratynocyty stymulują stan zapalny i aktywację komórek Lagerhansa, które są komórkami prezentującymi antygen w naskórku.
Pigmentacja skóry
Pigmentacja skóry ma na celu ochronę przed promieniowaniem ultrafioletowym. U ssaków melanina jest pigmentem, który sprawia, że skóra staje się ciemniejsza. Melanina jest syntetyzowana przez melanocyty, bardzo nieliczny typ komórek występujący w rozproszeniu w warstwie podstawnej naskórka i w mieszkach włosowych. Melanina jest pakowana w organella cytoplazmatyczne zwane melanosomami. Na produkcję i uwalnianie melanosomów wpływają zmienne środowiskowe, jak również substancje parakrynne uwalniane przez keratynocyty. Zanim zostaną uwolnione, melanosomy są rozprowadzane przez cytoplazmę melonocytów i procesy komórkowe, które rozciągają się pomiędzy otaczającymi je keratynocytami. Ostateczny kolor skóry zależy od produkcji melanosomów i ich dystrybucji w naskórku. Po dużej syntezie melaniny, melanosomy są egzocytowane z melanocytów i wychwytywane przez sąsiednie keratynocyty. Szacuje się, że każdy melanocyt dostarcza melaninę do około 45 keratynocytów. Po wbudowaniu melanosomów do keratynocytów warstwy podstawnej, są one przemieszczane do górnych warstw naskórka, ponieważ załadowane keratynocyty opuszczają warstwę podstawną i różnicują się, tworząc górne warstwy. W ten sposób wszystkie warstwy naskórka posiadają melaninę, nawet warstwa rogowa. W sumie, kolor skóry zależy od ilości melaniny zawartej w melanocytach i keratynocytach.
Naprawa ran
Po zranieniu keratynocyty przechodzą ze stanu stałego w inny, w którym zaczynają się poruszać. Odłączenie od błony podstawnej poprzez utratę desmosomów i zmianę ekspresji integryn pozwala na ruchliwość keratynocytów, a także odpowiedź na cytokiny uwalniane przez inne komórki. W ten sposób keratynocyty mogą przemieszczać się do uszkodzonych miejsc i uszczelniać je.
Bibliografia
Eckert RL, Rorke EA. 1989. Biologia molekularna różnicowania się keratynocytów. Perspektywy zdrowia środowiskowego 80:109-116.
Grinnell F. 1992. Wound repair, keratinocyte activation and integrin modulation. Journal of cell sciences 101:1-5.
Madison KC. 2003. Barierowa funkcja skóry: „La Raison d’EŒtre'” of the Epidermis. The journal of investigative dermatology 121: 231-241.
Nemes Z, Steinert PM. 1999. Cegły i zaprawa murarska bariery naskórkowej. Experimental and molecular medicine 1: 5-19.
Proksch E, Brandner JM, Jensen J-M. 2008. Skóra: niezastąpiona bariera. Experimental dermatology 17: 1063-1072.
Simpson CL, Patel DM, Green KJ. 2011. Deconstructing the skin: cytoarchitectural determinants of epidermal morphogenesis. Nature reviews in molecular and cell biology 12:568-580.
Yamaguchi Y, Brenner M, Hearing VJ. 2007. The Regulation of Skin Pigmentation. Journal of biological chemistry 282:27557-27561.
.