Endovenous thermal ablation for varicose veins: strengths and weaknesses
Pobierz to wydanie Powrót do streszczenia
The Netherlands
ABSTRACT
Ablacja endovenous jest często stosowaną metodą leczenia żylaków. Endovenous ablacja laserowa jest najczęściej stosowaną techniką, a następnie ablacja prądem o częstotliwości radiowej. Endovenous thermal treatments podgrzewają żyłę, prowadząc do zakrzepowego zamknięcia i w końcu zwłóknienia ściany żyły. Endovenous ablacja parą wodną jest nową techniką, która nie została jeszcze szeroko zbadana. W niniejszym artykule omówiono procedury, mocne i słabe strony obecnie dostępnych zabiegów endovenous thermal ablation.
INTRODUCTION
Endovenous treatment is currently one of the most frequently used methods for treating varicose veins. Żylaki są przejawem przewlekłej choroby żylnej (PNŻ), która może prowadzić do poważnych powikłań. Choroba ta jest powszechnie występującym schorzeniem. Częstość występowania żylaków szacuje się na 2%-40%.1-4 Częstość występowania owrzodzeń żylnych kończyn dolnych, będących końcowym etapem CVD, jest znacznie mniejsza. Bardzo trudno jest przewidzieć, a nawet jest to niemożliwe, którzy pacjenci z żylakami rozwiną owrzodzenie kończyn dolnych. Niemniej jednak szacuje się, że około połowa owrzodzeń żylnych kończyn dolnych jest wynikiem niewydolności żył powierzchownych.5 Koszty leczenia owrzodzeń kończyn dolnych są bardzo wysokie; leczenie żylaków, które może zmniejszyć częstość występowania owrzodzeń kończyn dolnych o 50%, jest więc prawdopodobnie opłacalne.
Leczenie żylaków można z grubsza podzielić na cztery kategorie: terapię uciskową, leczenie chirurgiczne, skleroterapię i endovenous ablację termiczną. Chirurgiczne podwiązanie połączenia z lub bez strippingu było standardem postępowania w leczeniu niewydolnych wielkich i małych żył odpiszczelowych przez ponad 100 lat.
W ostatniej dekadzie zabiegi endovenous thermal ablation (EVTA) stały się najczęściej stosowaną metodą leczenia żylaków odpiszczelowych, zwłaszcza w krajach, w których wprowadzono refundację tej procedury. Takie małoinwazyjne techniki odpowiadają na zapotrzebowanie na lepsze kosmetycznie, mniej inwazyjne i bardziej skuteczne metody leczenia. Wprowadzone zaledwie 10 lat temu, techniki te radykalnie zmieniły sposób leczenia żylaków.6 Obecnie dostępne techniki EVTA to: endovenous laser ablation (EVLA), ablacja prądem o częstotliwości radiowej (RFA) i endovenous steam ablation. Zaletą EVTA jest to, że jest mało inwazyjna i może być łatwo wykonana w znieczuleniu miejscowym tumescencyjnym, bez konieczności stosowania znieczulenia rdzeniowego lub ogólnego. Ponadto, zgodnie z metaanalizą różnych technik leczenia żylaków, wskaźniki nawrotów są niższe po EVTA niż po klasycznym zabiegu chirurgicznym.7
Pierwsze zabiegi EVTA przeprowadzono metodą RFA z użyciem systemu VNUS® Closure Plus.8 Wkrótce potem opracowano EVLA, która stała się najczęściej stosowaną metodą EVTA na świecie. W ciągu ostatnich kilku lat wprowadzono dwa nowe systemy RFA: VNUS Closure Fast (segmentalna RFA) oraz termoterapię indukowaną prądem o częstotliwości radiowej (RFITT). Najnowsza technika ablacji termicznej wykorzystuje parę wodną o temperaturze 120°C. W następnych punktach zostaną opisane różne techniki EVTA oraz przeanalizowane ich mocne i słabe strony.
ABLACJA LASEROWA ENDOVENOUS
EVLA może być wykonywana w znieczuleniu miejscowym tumescencyjnym w warunkach ambulatoryjnych. Dostęp żylny uzyskuje się przez nakłucie igłą lub kaniulą 16F lub 18F pod kontrolą ultrasonograficzną. Najczęściej niewystarczająca żyła odpiszczelowa wielka (GSV) jest wprowadzana na poziomie kolana, a żyła odpiszczelowa mała (SSV) w połowie łydki. Po wprowadzeniu do żyły, przez igłę wprowadza się prowadnik do żyły, aż do poziomu połączenia z układem żył głębokich. Jeśli żyła jest zbyt kręta, ma małą średnicę (z powodu skurczu) i duże odgałęzienia boczne lub zawiera segmenty zakrzepowe lub sklerotyczne (po zakrzepicy żył powierzchownych lub wcześniejszym leczeniu), posuwanie drutu może być trudne i wskazana jest ostrożność ze względu na zwiększone ryzyko perforacji i zdarzeń zatorowych. Po sprawdzeniu położenia prowadnika za pomocą ultradźwięków, usuwa się igłę i wykonuje niewielkie nacięcie skórne o długości 3 mm. Na prowadnik nakłada się osłonę wprowadzającą, którą umieszcza się kilka centymetrów poniżej złącza. Następnie, po usunięciu prowadnicy, wprowadza się włókno lasera (średnica w zakresie od 200 do 600 μm). W niektórych zestawach laserowych nie ma drutu prowadzącego, a osłonka jest wprowadzana bezpośrednio przez kaniulę. W innych zestawach laserowych włókno laserowe znajduje się już wewnątrz osłonki. Kluczowym krokiem w procedurze EVLA jest umieszczenie końcówki włókna laserowego w odległości 1 do 2 cm dystalnie od połączenia, pod kontrolą ultrasonograficzną, w widoku podłużnym (Rycina 1). Około 250 do 500 mL (w zależności od długości leczonej żyły) znieczulenia tumescencyjnego jest podawane do przestrzeni okołożylnej, ponownie pod kontrolą ultrasonograficzną przy użyciu strzykawki lub mechanicznej pompy infuzyjnej (Rycina 2). Znieczulenie tumescencyjne jest uzasadnione, ponieważ zmniejsza ból, chłodzi tkankę okołożylną i zmniejsza średnicę żyły. Po aktywacji, protokół może wykorzystywać ciągłe podciąganie lasera (zwykle z prędkością około 3-5 mm/s, w zależności od mocy i długości fali; w przypadku lasera 1320-nm powszechnie stosuje się prędkość podciągania 1 mm/s)9 lub podciąganie pulsacyjne, którego celem jest dostarczenie około 30-60 J/cm. Wskazane jest stosowanie bandaży uciskowych lub medycznych pończoch elastycznych (20-30 mm Hg na kostce) przez 1 tydzień po leczeniu.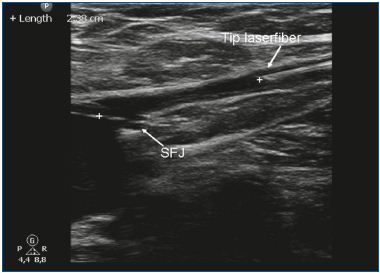
Ryc. 1. Końcówka włókna laserowego jest umieszczana 1-2 cm poniżej połączenia rzepkowo-udowego (SFJ).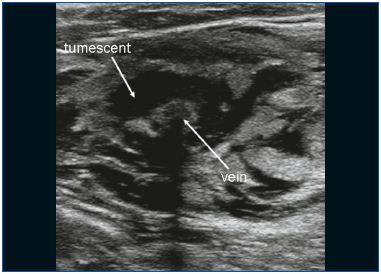
Rysunek 2. Znieczulenie tumescencyjne jest podawane wokół żyły.
EVLA może być użyty do leczenia niewystarczających GSVs i SSVs. Ze względu na sztywność i rozmiar materiałów jednorazowego użytku, liniowe żyły odpiszczelowe o średnicy 5 mm lub większej są idealne do EVLA (Ryc. 3). EVLA może być również stosowana do ablacji żyły odpiszczelowej dodatkowej przedniej lub żyły odpiszczelowej dodatkowej tylnej (często w połączeniu z żyłą Giacominiego) oraz żył przeszywających.10-11 EVLA jest najtańszą metodą leczenia endotermicznego. W Holandii najtańsze materiały jednorazowego użytku do lasera kosztują około 120 euro. Kolejną zaletą systemu EVLA jest możliwość zmiany ilości dostarczanej energii. Regulując prędkość wycofywania, moc lub obie te wartości, można zmienić całkowitą ilość energii dostarczanej na centymetr. W przypadku małych żył stosuje się tylko 20 J/cm, natomiast przy leczeniu dużych żył można zastosować wyższą energię (np. 60 J/cm). Spośród wszystkich technik ablacji termicznej, EVLA jest najszerzej badana w literaturze medycznej. Pierwsze duże serie przypadków wykazały wysoki odsetek powodzeń12-13, a wiele kolejnych serii przyniosło porównywalne wyniki. W 2009 roku opublikowaliśmy metaanalizę dotyczącą różnych metod leczenia żylaków odpiszczelowych i wykazaliśmy, że EVLA miała najwyższy wskaźnik powodzenia, wynoszący 93% po 5 latach obserwacji. EVLA wypadła znacznie lepiej niż stripping, RFA i skleroterapia piankowa pod kontrolą USG.7 Ostatnie duże randomizowane badanie kliniczne przeprowadzone przez Rasmussena i wsp.14 wykazało, że EVLA, RFA i stripping (w znieczuleniu tumescencyjnym) były równie skuteczne. RFA wiązała się z szybszym powrotem do zdrowia i mniejszym bólem pooperacyjnym niż EVLA i stripping.14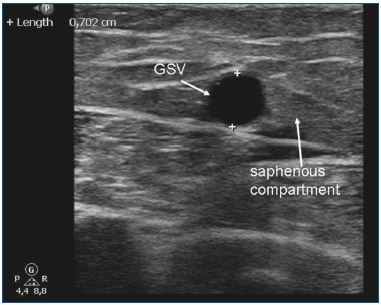
Ryc. 3. Żyła odpiszczelowa wielka (GSV) w przedziale odpiszczelowym.
Podczas zabiegu EVLA mogą wystąpić pewne trudności techniczne, nawet w doświadczonych rękach. Podczas leczenia nawracających żylaków wskazana jest ostrożność, ponieważ wprowadzenie włókna laserowego może być trudne. W bardzo krętych żyłach wprowadzenie prowadnika może być trudne i możliwa jest perforacja żyły. Inną wadą niektórych zestawów EVLA jest to, że wprowadzanie nie jest procedurą jednoetapową, lecz wymaga kilku kolejnych kroków (wprowadzenie prowadnika, osłonki, a następnie włókna laserowego). Każdy dodatkowy krok zwiększa ryzyko popełnienia błędu. Opisano pewne powikłania zależne od jednorazowego użytku, na przykład pozostawienie drutu prowadzącego w ciele po zakończeniu procedury EVLA.15 Takie powikłania są zwykle poważne i można by im zapobiec, gdyby procedura mogła być wykonywana przy użyciu tylko jednego jednorazowego użytku zamiast trzech. Działania niepożądane związane z zabiegiem EVLA są zwykle łagodne. Systematyczna analiza wszystkich publikacji na temat EVLA wykazała, że najczęstszymi działaniami niepożądanymi były wybroczyny i ból, ze stwardnieniem lub bez (100%). Inne, rzadziej występujące działania niepożądane obejmowały: oparzenia skóry (
ABLACJA PROMIENIOTWÓRCZA
Istnieje wiele systemów do ablacji prądem o częstotliwości radiowej. Pierwsze zabiegi RFA przeprowadzono przy użyciu systemu VNUS® Closure Plus.8 W ciągu ostatnich kilku lat wprowadzono dwa nowe systemy RFA: VNUS® Closure Fast (segmentalna RFA) oraz termoterapię indukowaną radiofrekwencją (RFITT). Obecnie najbardziej popularną metodą jest segmentowa RFA.
Procedura Dostęp do GSV uzyskuje się za pomocą 16-igłowej igły pod kontrolą ultrasonograficzną, zwykle na poziomie kolana lub poniżej, albo w najbardziej dystalnym punkcie refluksu. SSV jest zwykle nakłuwane w połowie łydki. Cewnik Closure (VNUS Medical Technologies, Inc, Sunnyvale, California) jest umieszczany 2 cm dystalnie od połączenia pod kontrolą ultrasonograficzną. W przypadku systemu Closure Plus, do odsysania krwi z żyły można użyć mankietu lub bandaża. Małe elektrody na końcu cewnika „parasolki” mają bezpośredni kontakt ze ścianą żyły i emitują wysoką energię o częstotliwości radiowej (regulowaną mocą, impedancją i czasem), która jest wytwarzana przez generator częstotliwości radiowej (VNUS Medical Technologies, Inc). Częstotliwość radiowa podgrzewa miejscową tkankę do temperatury od 85°C do 90°C w miejscu bezpośredniego kontaktu, przy czym ciepło jest przewodzone do głębszych płaszczyzn tkanki, powodując obkurczenie kolagenu, denudację śródbłonka i zatarcie światła żyły.17 Prędkość wycofywania cewnika wynosi 3 cm/min (całkowity czas wycofywania wynosi średnio 20 min dla GSV między połączeniem odpiszczelowo-udowym a poziomem kolana, ale może być szybszy przy wyższych temperaturach).18
Segmentalna RFA (Closure Fast) ma 7 cm terapeutyczny segment dystalny, który podgrzewa się do temperatury 120°C.19 Ta technika jest znacznie szybsza niż technika Closure Plus i może być wykonywana w znieczuleniu miejscowym tumescencyjnym w warunkach ambulatoryjnych. Podobnie jak w przypadku EVLA, stosuje się znieczulenie tumescencyjne przezżylne, aby zoptymalizować kontakt z powierzchnią, zmniejszyć ból i ryzyko dysestezji.20 Zgodnie z metodologią opisaną w pierwszym raporcie na temat segmentalnej RFA, podczas zabiegu zalecany jest zewnętrzny ucisk zapewniany przez sondę ultradźwiękową oraz ucisk ręczny w celu zwiększenia kontaktu cewnika ze ścianą żyły.21 Pierwsze 7 cm żyły poddaje się działaniu dwóch cykli ogrzewania (każdy po 20 s). Następnie cewnik jest przemieszczany do sąsiedniego segmentu, prowadzony za pomocą markerów trzonu w krokach co 6,5 cm, aby umożliwić 5 mm nakładanie się na siebie ogrzewanych segmentów żyły. Całkowity czas leczenia jest znacznie krótszy w przypadku segmentowej RFA niż w przypadku systemu Closure Plus i wynosi zazwyczaj tylko 2 do 3 minut. Opaski uciskowe lub medyczne elastyczne pończochy uciskowe są wskazane przez 1 tydzień po zabiegu.
Od 2000 roku w kilku opublikowanych seriach przypadków wykazano, że RFA może być z powodzeniem stosowana w leczeniu żylaków odpiszczelowych.8, 22-25 W pierwszej długoterminowej, dużej, jednoośrodkowej serii przypadków odnotowano, że RFA była skuteczna w około 90% 140 kończyn po 2 latach.20 W oddzielnym badaniu odnotowano wskaźniki powodzenia na poziomie 83%-88% po 5-letniej obserwacji.26 Nasza metaanaliza wykazała, że RFA (z użyciem Closure Plus) miała wskaźnik powodzenia 88%, który był niższy niż wskaźnik powodzenia EVLA.6
Segmentalna RFA nie została uwzględniona w analizie, ponieważ w tym czasie nie było dostępnych badań. Obecnie ukazało się jednak kilka publikacji na temat segmentalnej RFA z obiecującymi wynikami. W pierwszej serii przypadków 252 leczonych GSV uzyskano wskaźnik okluzji 99,6%,21 a w dwóch innych badaniach wykazano wskaźniki powodzenia >90%.27,28 Główną zaletą segmentowej RFA jest prawdopodobnie to, że powoduje mniejszy ból pooperacyjny niż EVLA. Uważa się, że jest to związane z niższą maksymalną temperaturą osiąganą podczas RFA oraz brakiem perforacji ściany żyły.27 Kolejną zaletą segmentowej RFA jest fakt, że jest to procedura standaryzowana, a wprowadzenie cewnika odbywa się jednoetapowo. Może to zmniejszyć ryzyko powikłań związanych z jednorazowym użyciem cewnika.
Z jednej strony standaryzacja procedury jest zaletą. Z drugiej strony, leczenie niektórych „specjalnych” przypadków może być niemożliwe. W przypadku segmentalnej RFA niemożliwe jest leczenie żył o długości mniejszej niż 7 cm, choć może się to zmienić wraz z wprowadzeniem nowego cewnika z 3 cm segmentem grzewczym. W niektórych przypadkach (np. pacjenci z bocznymi odgałęzieniami lub małymi, krętymi częściami żylaków), może być również pożądana zmiana sposobu dostarczania energii, ale w przypadku segmentowej RFA nie jest możliwe leczenie żył w temperaturze innej niż zadana. Ze względu na stosunkowo niską temperaturę osiąganą podczas segmentowej RFA, mechanizmem działania jest denaturacja kolagenu i obkurczanie ściany żyły.17 Różni się to od EVLA, w przypadku której również opisywano karbonizację i bardziej rygorystyczne niszczenie ściany żyły.29 Długoterminowa skuteczność segmentalnej RFA nie została jeszcze zbadana i stanie się jasna dopiero po przeprowadzeniu randomizowanego badania porównującego EVLA i segmentalną RFA z długoterminową obserwacją.
Ryc. 4. Para wodna jest wyrzucana z dwóch obszarów na końcówce cewnika.
ABLACJA PAROWA
Endovenous steam ablation (EVSA) jest nową metodą termicznej ablacji żył, która działa poprzez ogrzewanie struktury żylnej parą wodną do maksymalnej temperatury 120°C (Rycina 4). Procedura jest bardzo podobna do EVLA i może być wykonywana u pacjenta w znieczuleniu miejscowym tumescencyjnym w warunkach ambulatoryjnych. Żyła jest nakłuwana 16-igłową igłą lub kaniulą pod kontrolą ultrasonograficzną. Żyła GSV jest zwykle wprowadzana w dystalnym miejscu refluksu, na poziomie kolana lub tuż nad nim, ponieważ dostęp do niej jest łatwy, a ryzyko uszkodzenia nerwu niskie. SSV jest zwykle nakłuwana w połowie lub w miejscu w dystalnej trzeciej części łydki, w zależności od średnicy żyły i wielkości refluksu. Po nakłuciu żyły cewnik parowy (średnica 1,2 mm) jest wprowadzany przez wydrążoną igłę do żyły, a następnie końcówka cewnika z gęstym echem jest ostrożnie pozycjonowana 3 cm od połączenia, pod kontrolą ultrasonograficzną. To jest ponownie najbardziej kluczowy krok w procedurze. Około 250 do 500 mL (w zależności od długości leczonej żyły) znieczulenia tumescencyjnego jest podawane do przestrzeni okołożylnej pod kontrolą USG. Znieczulenie tumescencyjne jest niezbędne do zmniejszenia bólu, schłodzenia tkanki okołożylnej i zmniejszenia średnicy żyły. Po aktywacji, cewnik uwalnia małe „pufy” pary i jest stopniowo wycofywany. Przy pierwszej aktywacji, 3 cm poniżej połączenia odpiszczelowo-udowego lub odpiszczelowo-udowego, należy podać cztery uderzenia pary, wywierając jednocześnie delikatny ręczny nacisk na połączenie. Dalej wzdłuż żyły można podać dwa lub trzy uderzenia pary w odstępach 1 cm, w zależności od średnicy żyły. Przez pierwsze 4 cm zabiegu nadal należy stosować ręczny ucisk złącza, ponieważ para wodna może sięgać kilka centymetrów poza końcówkę cewnika. Po zabiegu pacjentom zaleca się noszenie medycznych elastycznych pończoch uciskowych o długości uda (zakres ucisku 25-35 mm Hg) przez 1 tydzień oraz mobilizację bezpośrednio po zabiegu.
Ryc. 5. Elastyczny cewnik parowy ma małą średnicę.
Dwie cechy, które mogą być korzystne (w porównaniu z EVLA) to fakt, że EVSA jest wykonywana przy użyciu bardzo małej objętości sterylnej wody (około 2 mL na leczoną żyłę) oraz to, że temperatura jest względnie stała, z maksymalną wartością 120°C. Cewnik parowy jest wprowadzany bezpośrednio przez igłę nakłuwającą, bez konieczności stosowania prowadnicy lub osłonki, co sprawia, że zabieg jest łatwy i bezpieczny. Opublikowano tylko jedną serię przypadków ablacji parą wodną, w której wykazano, że wyniki zgłaszane przez pacjentów były korzystne, procedura była bardzo dobrze tolerowana, punktacja bólu była niska, a pacjenci byli bardzo zadowoleni z leczenia.30 Zaletą procedury EVSA jest to, że cewnik jest niewielki i bardzo elastyczny (ryc. 5); średnica cewnika parowego SVS (1,2 mm) jest prawie o 50% mniejsza niż cewnika używanego do segmentalnej RFA (2,33 mm). Elastyczność cewnika parowego może ułatwiać wprowadzanie go do bardziej krętych naczyń i żył przeszywających, do których niekiedy trudno jest dotrzeć sztywnymi cewnikami stosowanymi w RFA i sztywnymi włóknami szklanymi używanymi w EVLA. Nawet dopływy żylne mogą być zatem leczone za pomocą EVSA. Para uwalniana jest z dwóch małych obszarów na końcu cewnika, co pozwala na leczenie żył dowolnej długości. Para uwalniana jest pod ciśnieniem i dzięki temu rozprasza się na odległość co najmniej 2 cm. Może to przynieść dodatkowe korzyści w leczeniu krótkich żył przeszywających i krótkich odcinków meandrujących dopływów.
Głównym ograniczeniem ablacji parą wodną jest brak dowodów; do tej pory opublikowano tylko trzy doniesienia na temat ablacji parą wodną.30-32 Innym problemem jest to, że ablacja parą wodną nie jest jeszcze refundowana, co ograniczy liczbę wykonywanych zabiegów, a tym samym jeszcze bardziej utrudni uzyskanie pomiarów wyników. Potrzebne są większe badania porównawcze, aby porównać długoterminową skuteczność oraz stosunek ryzyka do korzyści ablacji parą wodną z istniejącymi technikami endovenous.
DISCUSSION
„Złotym standardem” w leczeniu niewydolnych żył odpiszczelowych było przez ostatnie 100 lat podwiązanie plus stripping. Sytuacja ta uległa zmianie w ostatniej dekadzie wraz z wprowadzeniem technik endovenous thermal ablation. Techniki EVTA są zawsze wykonywane pod kontrolą dupleksu i okazują się bardzo skuteczne z wysokim odsetkiem powodzeń w krótkoterminowej obserwacji. Ponieważ skuteczność obecnie stosowanych zabiegów EVTA jest doskonała (>90%), działania niepożądane są łagodne, a poważne powikłania rzadkie, każda nowa procedura EVTA powinna być co najmniej równie skuteczna, a najlepiej mieć pewne przewagi nad dotychczas stosowanymi technikami. Hipoteza zakłada, że EVSA będzie co najmniej tak samo skuteczna jak EVLA czy RFA. Przewagą pary wodnej nad pozostałymi procedurami ablacji może być lepsza tolerancja pacjenta, bezpieczniejsza, szybsza i łatwiejsza procedura, niższe koszty oraz łatwość stosowania w przypadku żył przeszywających i dopływów. Przyszłe badania powinny porównywać różne zabiegi endowaskularne pod względem skuteczności i wyników zgłaszanych przez pacjentów. Konieczne są również dalsze prace, które pozwolą odpowiedzieć na pozostałe pytania dotyczące dokładnego mechanizmu działania poszczególnych zabiegów EVTA. W dobie oceny technologii medycznych i analiz efektywności kosztowej koszty związane z leczeniem będą nabierały coraz większego znaczenia, a kwestia ta pozostanie kluczowym zagadnieniem w przyszłości.
Dwie cechy, które mogą być korzystne (w porównaniu z EVLA) to fakt, że EVSA jest wykonywana przy użyciu bardzo małej objętości sterylnej wody (około 2 mL na leczoną żyłę) oraz że temperatura jest względnie stała, maksymalnie 120°C. Cewnik parowy jest wprowadzany bezpośrednio przez igłę nakłuwającą, bez konieczności stosowania prowadnicy lub osłonki, co sprawia, że zabieg jest łatwy i bezpieczny. Opublikowano tylko jedną serię przypadków ablacji parą wodną, w której wykazano, że wyniki zgłaszane przez pacjentów były korzystne, procedura była bardzo dobrze tolerowana, punktacja bólu była niska, a pacjenci byli bardzo zadowoleni z leczenia.30 Zaletą procedury EVSA jest to, że cewnik jest niewielki i bardzo elastyczny (ryc. 5); średnica cewnika parowego SVS (1,2 mm) jest prawie o 50% mniejsza niż cewnika używanego do segmentalnej RFA (2,33 mm). Elastyczność cewnika parowego może ułatwiać wprowadzanie go do bardziej krętych naczyń i żył przeszywających, do których niekiedy trudno jest dotrzeć sztywnymi cewnikami stosowanymi w RFA i sztywnymi włóknami szklanymi używanymi w EVLA. Nawet dopływy żylne mogą być zatem leczone za pomocą EVSA. Para uwalniana jest z dwóch małych obszarów na końcu cewnika, co pozwala na leczenie żył dowolnej długości. Para uwalniana jest pod ciśnieniem i dzięki temu rozprasza się na odległość co najmniej 2 cm. Może to przynieść dodatkowe korzyści w leczeniu krótkich żył przeszywających i krótkich odcinków meandrujących dopływów.
Głównym ograniczeniem ablacji parą wodną jest brak dowodów; do tej pory opublikowano tylko trzy doniesienia na temat ablacji parą wodną.30-32 Innym problemem jest to, że ablacja parą wodną nie jest jeszcze refundowana, co ograniczy liczbę wykonywanych zabiegów, a tym samym jeszcze bardziej utrudni uzyskanie pomiarów wyników. Potrzebne są większe badania porównawcze, aby porównać długoterminową skuteczność oraz stosunek ryzyka do korzyści ablacji parą wodną z istniejącymi technikami endovenous.
DISCUSSION
„Złotym standardem” w leczeniu niewydolnych żył odpiszczelowych było przez ostatnie 100 lat podwiązanie plus stripping. Sytuacja ta uległa zmianie w ostatniej dekadzie wraz z wprowadzeniem technik endovenous thermal ablation. Techniki EVTA są zawsze wykonywane pod kontrolą dupleksu i okazują się bardzo skuteczne z wysokim odsetkiem powodzeń w krótkoterminowej obserwacji. Ponieważ skuteczność obecnie stosowanych zabiegów EVTA jest doskonała (>90%), działania niepożądane są łagodne, a poważne powikłania rzadkie, każda nowa procedura EVTA powinna być co najmniej równie skuteczna, a najlepiej mieć pewne przewagi nad dotychczas stosowanymi technikami. Hipoteza zakłada, że EVSA będzie co najmniej tak samo skuteczna jak EVLA czy RFA. Przewagą pary wodnej nad pozostałymi procedurami ablacji może być lepsza tolerancja pacjenta, bezpieczniejsza, szybsza i łatwiejsza procedura, niższe koszty oraz łatwość stosowania w przypadku żył przeszywających i dopływów. Przyszłe badania powinny porównywać różne zabiegi endowaskularne pod względem skuteczności i wyników zgłaszanych przez pacjentów. Konieczne są również dalsze prace, które pozwolą odpowiedzieć na pozostałe pytania dotyczące dokładnego mechanizmu działania poszczególnych zabiegów EVTA. W dobie oceny technologii medycznych i analiz kosztów-efektywności koszty związane z leczeniem będą nabierały coraz większego znaczenia i pozostanie to kluczową kwestią w przyszłości.
1. Evans CJ, Fowkes FG, Ruckley CV, Lee AJ. Prevalence of varicose veins and chronic venous insufficiency in men and women in the general population: Edinburgh Vein Study. J Epidemiol Community Health. 1999;53:149-153.
2. Kurz X, Kahn SR, Abenhaim L, et al. Chronic venous disorders of the leg: epidemiology, outcomes, diagnosis and management. Summary of an evidencebased report of the VEINES task force. Venous Insufficiency Epidemiologic and Economic Studies. Int Angiol. 1999;18:83-102.
3. Abramson JH, Hopp C, Epstein LM. The epidemiology of varicose veins. A survey in western Jerusalem. J Epidemiol Community Health. 1981;35:213-217.
4. Brand FN, Dannenberg AL, Abbott RD, Kannel WB. The epidemiology of varicose veins: the Framingham Study. Am J Prev Med. 1988;4:96-101.
5. Magnusson MB, Nelzen O, Risberg B, Sivertsson R. A color Doppler ultrasonograficzne badanie refluksu żylnego u pacjentów z przewlekłymi owrzodzeniami nóg. Eur J Vasc Endovasc Surg. 2001;21:353-360.
6. De Maeseneer M. The endovenous revolution. Br J Surg. 2011;98:1037- 1038.
7. Van Den Bos R, Arends L, Kockaert M, Neumann M, Nijsten T..Endovenous therapies of lower extremity varicosities: a meta-analysis. J Vasc Surg. 2009;49:230-239.
8. Goldman MP. Closure of the greater saphenous vein with endoluminal radiofrequency thermal heating of the vein wall in combination with ambulatory phlebectomy: preliminary 6-month follow-up. Dermatol Surg. 2000;26:452-456.
9. Goldman MP, Mauricio M, Rao J. Intravascular 1320-nm laserowe zamknięcie żyły odpiszczelowej wielkiej: 6- do 12-miesięczne badanie kontrolne. Dermatol Surg. 2004;30:1380-1385.
10. Proebstle TM, Herdemann S. Early results and feasibility of incompetent perforator vein ablation by endovenous laser treatment. Dermatol Surg. 2007;33:162-168.
11. Bush RG, Hammond K. Treatment of incompetent vein of Giacomini (thigh extension branch). Ann Vasc Surg. 2007;21:245-248.
12. Navarro L, Min RJ, Bone C. Endovenous laser: a new minimally invasive method of treatment for varicose veins-preliminary observations using an 810 nm diode laser. Dermatol Surg. 2001;27:117-122.
13. Min RJ, Zimmet SE, Isaacs MN, Forrestal MD. Endovenous laser treatment of the incompetent greater saphenous vein. J Vasc Interv Radiol. 2001;12:1167-1171.
14. Rasmussen LH, Lawaetz M, Bjoern L, Vennits B, Blemings A, Eklof B. Randomized clinical trial comparing endovenous laser ablation, radiofrequency ablation, foam sclerotherapy and surgical stripping for great saphenous varicose veins. Br J Surg. 2011;98:1079-1087.
15. Kichari JR, Salomonsz R, Postema RR. . . Ned Tijdschr Geneeskd. 2008;152:1387-1390.
16. Doganci S, Demirkilic U. Comparison of 980 nm laser and bare-tip fibre with 1470 nm laser and radial fibre in the treatment of great saphenous vein varicosities: a prospective randomised clinical trial. Eur J Vasc Endovasc Surg. 2010;40:254-259.
17. Schmedt CG, Sroka R, Steckmeier S, et al. Investigation on radiofrequency and laser (980 nm) effects after endoluminal treatment of saphenous vein insufficiency in an ex-vivo model. Eur J Vasc Endovasc Surg. 2006;32:318- 325.
18. Zikorus AW, Mirizzi MS. Evaluation of setpoint temperature and pullback speed on vein adventitial temperature during endovenous radiofrequency energy delivery in an in-vitro model. Vasc Endovascular Surg. 2004;38:167- 174.
19. Strona internetowa VNUS. http://www.vnus.com (ostatni dostęp 4 sierpnia 2008).
20. Weiss RA, Weiss MA. Controlled radiofrequency endovenous occlusion using a unique radiofrequency catheter under duplex guidance to eliminate saphenous varicose vein reflux: a 2-year follow-up. Dermatol Surg. 2002;28:38-42.
21. Proebstle TM, Vago B, Alm J, Göckeritz O, Lebard C, Pichot O. Treatment of the incompetent great saphenous vein by endovenous radiofrequency powered segmental thermal ablation: first clinical experience. Vasc Surg. 2008;47:151-156.
22. Sybrandy JE, Wittens CH. Initial experiences in endovenous treatment of saphenous vein reflux. J Vasc Surg. 2002;36:1207-1212.
23. Goldman MP, Amiry S. Closure of the greater saphenous vein with endoluminal radiofrequency thermal heating of the vein wall in combination with ambulatory phlebectomy: 50 patients with more than 6-month follow-up. Dermatol Surg. 2002;28:29-31.
24. Manfrini S, Gasbarro V, Danielsson G, et al. Endovenous management of saphenous vein reflux. Endovenous Reflux Management Study Group. J Vasc Surg. 2000;32:330-342.
25. Chandler JG, Pichot O, Sessa C, Schuller-Petrovi´c S, Osse FJ, Bergan JJ. Defining the role of extended saphenofemoral junction ligation: a prospective comparative study. J Vasc Surg. 2000;32:941-953.
26. Merchant RF, Pichot O; Closure Study Group. Long-term outcomes of endovenous radiofrequency obliteration of saphenous reflux as a treatment for superficial venous insufficiency. J Vasc Surg. 2005;42:502- 509.
27. Shepherd AC, Gohel MS, Lim CS, Hamish M, Davies AH. Pain following 980-nm endovenous laser ablation and segmental radiofrequency ablation for varicose veins: a prospective observational study. Vasc Endovascular Surg. 2010;44:212-216.
28. Proebstle TM, Alm J, Gockeritz O, et al. Three-year European follow-up of endovenous radiofrequency-powered segmental thermal ablation of the great saphenous vein with or without treatment of calf varicosities. J Vasc Surg. 2011;54:146-152.
29. Weiss RA. Comparison of endovenous radiofrequency versus 810 nm diode laser occlusion of large veins in an animal model. Dermatol Surg. 2002;28:56-61.
30. van den Bos RR, Milleret R, Neumann M, Nijsten T. Proof-of-principle study of steam ablation as novel thermal therapy for saphenous varicose veins. J Vasc Surg. 2010;53:181-186.
31. Milleret R, Mehier H, Llopinet A, et al. Obliteracja żył przy pomocy pary wodnej o wysokiej temperaturze. Phlebologie. 2008;61:223-226.
32. van Ruijven PW, van den Bos RR, Alazard LM, van der Geld CW, Nijsten T. Temperature measurements for dose-finding in steam ablation. J Vasc Surg. 2011;53:1454-1456.