Ablazione termica endovenosa per le vene varicose: punti di forza e di debolezza
Scarica questo numero Torna al sommario
Olanda
ABSTRACT
L’ablazione endovenosa è un metodo frequentemente utilizzato per il trattamento delle vene varicose. L’ablazione laser endovenosa è la tecnica più utilizzata, seguita dall’ablazione a radiofrequenza. I trattamenti termici endovenosi riscaldano la vena, portando all’occlusione trombotica e infine alla fibrosi della parete della vena. L’ablazione endovenosa a vapore è una nuova tecnica che non è stata ancora ampiamente studiata. In questo articolo vengono discusse le procedure, i punti di forza e le debolezze dei trattamenti di ablazione termica endovenosa attualmente disponibili.
INTRODUZIONE
Il trattamento endovenoso è attualmente uno dei metodi più utilizzati per il trattamento delle vene varicose. Le vene varicose sono manifestazioni della malattia venosa cronica (CVD), che può portare a gravi complicazioni. La CVD è una condizione medica comune. Si stima che la prevalenza delle vene varicose vada dal 2% al 40%.1-4 La prevalenza delle ulcere venose delle gambe, lo stadio finale della CVD, è molto più bassa. È molto difficile, se non impossibile, prevedere quali pazienti con vene varicose svilupperanno un’ulcera alla gamba. Tuttavia, è stato stimato che circa la metà delle ulcere venose delle gambe sono il risultato di un’insufficienza venosa superficiale.5 Il costo del trattamento delle ulcere delle gambe è molto elevato; il trattamento delle vene varicose, che può ridurre l’incidenza delle ulcere delle gambe del 50%, è quindi probabilmente conveniente.
Il trattamento delle vene varicose può essere grosso modo diviso in quattro categorie: terapia compressiva, trattamento chirurgico, scleroterapia e ablazione termica endovenosa. La legatura chirurgica della giunzione con o senza stripping è stata lo standard di cura nel trattamento delle vene safene grandi e piccole insufficienti per più di 100 anni.
Nell’ultimo decennio, le procedure di ablazione termica endovenosa (EVTA) sono diventate la terapia più utilizzata per le vene varicose safene, soprattutto nei paesi in cui è stato introdotto il rimborso della procedura. Queste tecniche minimamente invasive soddisfano la domanda di modalità di trattamento esteticamente superiori, meno invasive e di maggior successo. Introdotte solo 10 anni fa, queste tecniche hanno cambiato radicalmente il trattamento delle vene varicose.6 Le tecniche EVTA attualmente disponibili sono: ablazione laser endovenosa (EVLA), ablazione a radiofrequenza (RFA) e ablazione endovenosa a vapore. Il vantaggio dell’EVTA è che è minimamente invasiva e può essere facilmente eseguita in anestesia tumescente locale, senza bisogno di anestesia spinale o generale. Inoltre, secondo una metanalisi delle diverse tecniche di trattamento delle vene varicose, i tassi di recidiva sono più bassi dopo l’EVTA che dopo la chirurgia classica.7
Le prime procedure di EVTA furono eseguite mediante RFA con il sistema VNUS® Closure Plus.8 L’EVLA fu sviluppata poco dopo e divenne presto il metodo EVTA più utilizzato nel mondo. Negli ultimi anni sono stati introdotti due nuovi sistemi RFA: VNUS Closure Fast (RFA segmentale) e la termoterapia indotta da radiofrequenza (RFITT). L’ultima tecnica di ablazione termica utilizza il vapore ad una temperatura di 120°C. Nei paragrafi seguenti, saranno descritte le diverse tecniche di EVTA ed esplorati i loro punti di forza e di debolezza.
ABLAZIONE LASER ENDOVENA
EVLA può essere eseguita in anestesia tumescente locale in un ambiente ambulatoriale. L’accesso venoso è ottenuto mediante puntura con un ago o una cannula 16F o 18F sotto guida ecografica. Più comunemente, la grande safena insufficiente (GSV) viene inserita a livello del ginocchio e la piccola safena (SSV) a metà polpaccio. Dopo aver stabilito l’ingresso nella vena, un filo guida viene fatto passare attraverso l’ago nella vena fino al livello della giunzione con il sistema venoso profondo. Se la vena è troppo tortuosa, è di piccolo diametro (a causa dello spasmo) e ha grandi rami laterali, o contiene segmenti trombotici o sclerotici (dopo una trombosi venosa superficiale o un trattamento precedente), l’avanzamento del filo può essere difficile ed è indicata cautela a causa dell’aumentato rischio di perforazione ed eventi embolici. Dopo aver controllato la posizione del filo guida con gli ultrasuoni, l’ago viene rimosso e viene praticata una piccola incisione cutanea di 3 mm. Una guaina introduttiva viene posta sopra il filo guida e viene posizionata qualche centimetro sotto la giunzione. Successivamente, la fibra laser (con un diametro compreso tra 200 e 600 μm) viene introdotta dopo aver rimosso il filo guida. In alcuni kit laser, non vi è alcun filo guida e la guaina viene introdotta direttamente attraverso una cannula. In altri kit laser la fibra laser è già all’interno della guaina. Un passo cruciale nella procedura EVLA è il posizionamento della punta della fibra laser da 1 a 2 cm distalmente dalla giunzione sotto guida ecografica, in vista longitudinale (Figura 1). Circa 250-500 mL (a seconda della lunghezza della vena trattata) di anestesia tumescente viene somministrata nello spazio perivenoso, sempre sotto guida ecografica utilizzando una siringa o una pompa di infusione meccanica (Figura 2). L’anestesia tumescente è giustificata perché riduce il dolore, raffredda il tessuto perivenoso e diminuisce il diametro venoso. Dopo l’attivazione, il protocollo può utilizzare il pullback laser continuo (di solito a circa 3-5 mm/s, a seconda della potenza e della lunghezza d’onda; con il laser 1320-nm, una velocità di pullback di 1 mm/s è comunemente usato)9 o un pullback pulsato, con l’obiettivo di somministrare circa 30-60 J/cm. Bendaggi compressivi o calze mediche elastiche (20-30 mm Hg alla caviglia) sono indicati per 1 settimana dopo il trattamento.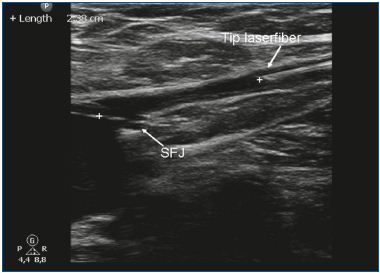
Figura 1. La punta della fibra laser è posizionata 1-2 cm sotto la giunzione safenofemorale (SFJ).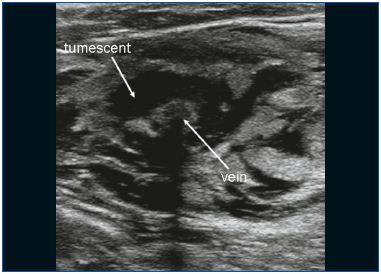
Figura 2. L’anestesia tumescente viene somministrata intorno alla vena.
EVLA può essere usata per trattare GSV e SSV insufficienti. A causa della rigidità e delle dimensioni del monouso, le vene safene lineari con un diametro di 5 mm o più sono ideali per l’EVLA (Figura 3). L’EVLA può essere utilizzata anche per l’ablazione della safena accessoria anteriore o della safena accessoria posteriore (spesso in combinazione con una vena di Giacomini), e delle vene perforanti.10-11 L’EVLA è il trattamento endotermico meno costoso. Nei Paesi Bassi, i dispositivi laser più economici costano circa 120 euro. Un altro vantaggio di EVLA è che la quantità di energia erogata può essere variata. Regolando la velocità di richiamo, la potenza o entrambe, la quantità totale di energia erogata per centimetro può essere modificata. Per le vene piccole, si usano solo 20 J/cm, mentre un’energia più alta (cioè 60 J/cm) può essere usata quando si trattano vene grandi. Di tutte le tecniche di ablazione termica, l’EVLA è la più ampiamente studiata nella letteratura medica. Le prime grandi serie di casi hanno riportato alti tassi di successo12-13 e molte serie sono seguite con risultati comparabili. Nel 2009, abbiamo pubblicato una meta-analisi sui diversi trattamenti per le vene varicose safene e abbiamo dimostrato che l’EVLA aveva il più alto tasso di successo, pari al 93% dopo 5 anni di follow-up. EVLA ha ottenuto risultati significativamente migliori rispetto allo stripping, alla RFA e alla scleroterapia con schiuma guidata da ultrasuoni.7 Un recente e ampio studio clinico randomizzato eseguito da Rasmussen et al14 ha dimostrato che EVLA, RFA e stripping (in anestesia tumescente) erano tutti ugualmente efficaci. La RFA è stata associata a un recupero più rapido e a un minore dolore postoperatorio rispetto all’EVLA e allo stripping.14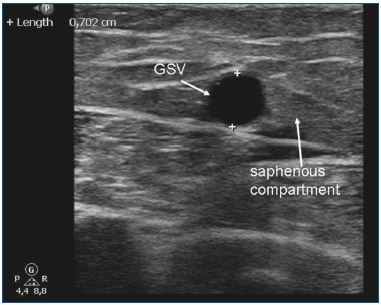
Figura 3. La grande safena (GSV) nel comparto safenico.
Alcune difficoltà tecniche possono verificarsi durante una procedura EVLA, anche in mani esperte. Nel trattamento delle vene varicose ricorrenti, la cautela è indicata perché l’introduzione della fibra laser può essere difficile. Nelle vene molto tortuose, l’introduzione del filo guida può essere difficile e la perforazione della vena è possibile. Un altro svantaggio di alcuni set EVLA è che l’introduzione non è una procedura a fase unica, ma richiede diverse fasi consecutive (introduzione del filo guida, della guaina e poi della fibra laser). Ogni passo aggiuntivo aumenta il rischio di commettere errori. Sono state descritte alcune complicazioni che dipendono dai monouso; per esempio, un filo guida che rimane all’interno del corpo dopo aver terminato la procedura EVLA.15 Tali complicazioni sono solitamente gravi e potrebbero essere evitate se la procedura potesse essere eseguita con un solo monouso invece di tre. Gli effetti collaterali dell’EVLA sono solitamente lievi. Lo studio sistematico di tutte le pubblicazioni sull’EVLA ha mostrato che gli effetti collaterali più comuni erano ecchimosi e dolore, con o senza indurimento (100%). Altri effetti collaterali meno comuni includevano: ustioni cutanee (
ABLAZIONE A RADIOFREQUENZA
Esistono diversi sistemi per l’ablazione a radiofrequenza. Le prime procedure RFA sono state eseguite con il sistema VNUS® Closure Plus.8 Negli ultimi anni sono stati introdotti due nuovi sistemi RFA: VNUS® Closure Fast (RFA segmentale) e la termoterapia indotta da radiofrequenza (RFITT). La RFA segmentale è attualmente il metodo più popolare.
Procedura L’accesso alla GSV si ottiene con un ago calibro 16 sotto guida ecografica, in genere a livello del ginocchio o al di sotto o nel punto più distale del reflusso. La SSV viene solitamente perforata a metà polpaccio. Il catetere di chiusura (VNUS Medical Technologies, Inc, Sunnyvale, California) viene posizionato a 2 cm distalmente dalla giunzione sotto visualizzazione ecografica longitudinale. Con il sistema Closure Plus, è possibile utilizzare un bracciale o una benda per far uscire il sangue dalla vena. I piccoli elettrodi all’estremità del catetere “a ombrello” sono a diretto contatto con la parete venosa ed emettono un’elevata energia di radiofrequenza (regolata da potenza, impedenza e tempo) generata da un generatore di radiofrequenza (VNUS Medical Technologies, Inc). La radiofrequenza riscalda il tessuto locale fino a 85°C – 90°C nel sito di contatto diretto, con il calore condotto a piani di tessuto più profondi, causando la contrazione del collagene, la denudazione dell’endotelio e l’obliterazione del lume venoso.17 La velocità di richiamo del catetere è di 3 cm/min (il tempo totale di richiamo è in media di 20 minuti per la GSV tra la giunzione safenofemorale e il livello del ginocchio, ma può essere più veloce a temperature più elevate).18
La RFA segmentaria (Closure Fast) ha un segmento distale terapeutico di 7 cm che riscalda a 120°C.19 Questa tecnica è molto più veloce della tecnica Closure Plus e può essere eseguita in anestesia tumescente locale in un ambiente ambulatoriale. Come per l’EVLA, l’anestesia tumescente perivenosa viene applicata per ottimizzare il contatto con la superficie e per diminuire il dolore e il rischio di disestesia.20 Secondo la metodologia descritta nel primo rapporto sulla RFA segmentaria, la compressione esterna fornita dalla sonda a ultrasuoni e la compressione manuale sono raccomandate durante il trattamento per migliorare il contatto del catetere con la parete della vena.21 I primi 7 cm di vena vengono trattati con due cicli di calore (20 s ciascuno). Il catetere viene quindi riposizionato sul segmento adiacente guidato dai marcatori dell’asta a passi di 6,5 cm per consentire una sovrapposizione di 5 mm di segmenti di vena riscaldati. Il tempo totale del trattamento è molto più breve con la RFA segmentale che con il sistema Closure Plus e di solito richiede solo 2 o 3 minuti. I bendaggi compressivi o le calze elastiche mediche compressive sono indicati per 1 settimana dopo il trattamento.
Dal 2000, diverse serie di casi pubblicati hanno dimostrato che la RFA può essere utilizzata con successo per trattare le vene varicose safene.8, 22-25 La prima serie di casi a lungo termine, di grandi dimensioni, in un unico centro, ha riportato che la RFA era efficace in circa il 90% dei 140 arti dopo 2 anni.20 Uno studio separato ha riportato tassi di successo dell’83%-88% dopo un follow-up di 5 anni.26 La nostra meta-analisi ha mostrato che la RFA (utilizzando la Closure Plus) aveva un tasso di successo dell’88%, inferiore al tasso di successo della EVLA.6
La RFA segmentaria non è stata inclusa nell’analisi, in quanto al momento non erano disponibili studi. Tuttavia, ci sono ora alcune pubblicazioni sulla RFA segmentale con risultati promettenti. La prima serie di casi su 252 GSV trattate ha riportato un tasso di occlusione del 99,6%,21 e altri due studi hanno dimostrato tassi di successo >90%.27,28 Il principale vantaggio della RFA segmentale è probabilmente che comporta meno dolore post-operatorio rispetto alla EVLA. Si pensa che ciò sia legato alla temperatura massima inferiore raggiunta durante la RFA e all’assenza di perforazioni della parete della vena.27 Un ulteriore vantaggio della RFA segmentaria è che si tratta di una procedura standardizzata e l’introduzione del catetere viene eseguita in un’unica fase. Questo può abbassare il rischio di complicazioni legate all’uso del monouso.
Da un lato, la standardizzazione di una procedura è un vantaggio. D’altra parte, potrebbe non essere possibile trattare alcuni casi “speciali”. Con la RFA segmentale è impossibile trattare vene di lunghezza inferiore a 7 cm, anche se questo potrebbe cambiare con la recente introduzione di un nuovo catetere con un segmento di riscaldamento di 3 cm. In alcuni casi (cioè, pazienti con rami laterali, o piccole parti tortuose di vene varicose), può anche essere desiderabile cambiare l’erogazione di energia, ma con la RFA segmentale non è possibile trattare le vene ad una temperatura diversa da quella preimpostata. Come risultato della temperatura relativamente bassa che viene raggiunta durante la RFA segmentale, il meccanismo di lavoro è la denaturazione del collagene e il restringimento della parete della vena.17 Questo differisce dalla EVLA in cui viene riportata anche la carbonizzazione e la distruzione più rigorosa della parete della vena.29 L’efficacia a lungo termine della RFA segmentale non è ancora stata studiata e diventerà chiara solo dopo che sarà stato condotto uno studio randomizzato di confronto tra EVLA e RFA segmentale con un follow-up a lungo termine.
Figura 4. Il vapore viene espulso da due aree sulla punta del catetere.
ABLAZIONE A VAPORE
L’ablazione a vapore endovenosa (EVSA) è un nuovo metodo di ablazione termica delle vene che funziona riscaldando la struttura venosa con vapore fino ad una temperatura massima di 120°C (Figura 4). La procedura è molto simile all’EVLA e può essere eseguita con il paziente in anestesia tumescente locale in un ambiente ambulatoriale. La vena viene perforata con un ago o una cannula calibro 16 sotto guida ecografica. La GSV è di solito inserita nel sito distale del reflusso, a livello del ginocchio o appena sopra, perché l’accesso è facile in questo sito e il rischio di lesioni nervose è basso. La SSV viene solitamente perforata a metà o in una posizione nel terzo distale del polpaccio, a seconda del diametro della vena e dell’entità del reflusso. Dopo aver forato la vena, il catetere a vapore (1,2 mm di diametro) viene fatto passare attraverso l’ago cavo nella vena e la punta eco-densa del catetere viene poi accuratamente posizionata a 3 cm dalla giunzione, sotto guida ecografica. Questo è di nuovo il passo più importante della procedura. Circa 250-500 mL (a seconda della lunghezza della vena trattata) di anestesia tumescente vengono somministrati nello spazio perivenoso sotto guida ecografica. L’anestesia tumescente è necessaria per ridurre il dolore, raffreddare il tessuto perivenoso e diminuire il diametro venoso. Dopo l’attivazione, il catetere rilascia piccoli “sbuffi” di vapore e viene tirato indietro in modo graduale. Alla prima attivazione, 3 cm sotto la giunzione safenofemorale o safenopoplitea, devono essere somministrati quattro soffi di vapore, mentre si esercita una leggera pressione manuale sulla giunzione. Proseguendo lungo la vena, si possono somministrare due o tre soffi di vapore a intervalli di 1 cm, a seconda del diametro della vena. Per i primi 4 cm di trattamento, la compressione manuale della giunzione dovrebbe ancora essere applicata poiché il vapore può raggiungere diversi centimetri oltre la punta del catetere. Dopo la procedura, si consiglia ai pazienti di indossare calze elastiche medicali a compressione della coscia (range di pressione 25-35 mm Hg) per 1 settimana e di mobilizzarsi immediatamente dopo il trattamento.
Figura 5. Il catetere a vapore flessibile ha un diametro ridotto.
Due caratteristiche che potrebbero essere vantaggiose (rispetto all’EVLA) sono che l’EVSA viene eseguita con un volume molto piccolo di acqua sterile (circa 2 mL per vena trattata) e che la temperatura è relativamente costante, con un massimo di 120°C. Il catetere a vapore viene introdotto direttamente attraverso l’ago di puntura, senza bisogno di un filo guida o di una guaina, risultando in una procedura facile e sicura. È stata pubblicata solo una serie di casi sull’ablazione a vapore, che ha dimostrato che i risultati riportati dai pazienti erano favorevoli, la procedura era molto ben tollerata, i punteggi del dolore erano bassi e i pazienti erano molto soddisfatti del trattamento.30 Un vantaggio della procedura EVSA è che il catetere è minuto e molto flessibile (Figura 5); il diametro del catetere a vapore SVS (1,2 mm) è quasi il 50% più piccolo del catetere utilizzato per la RFA segmentale (2,33 mm). La flessibilità del catetere a vapore può facilitare il posizionamento nei vasi più tortuosi e nelle vene perforanti, che a volte sono di difficile accesso con i cateteri più rigidi usati per la RFA e le fibre di vetro rigide usate per l’EVLA. Anche gli affluenti delle vene possono, quindi, essere trattati con l’EVSA. Il vapore viene rilasciato da due piccole aree sulla punta del catetere, permettendo il trattamento di qualsiasi lunghezza di vena. Il vapore viene rilasciato sotto pressione e, pertanto, si disperde su una distanza di almeno 2 cm. Questo può essere di ulteriore beneficio nel trattamento di vene perforanti corte e di brevi segmenti di affluenti serpeggianti.
La principale limitazione dell’ablazione a vapore è la mancanza di prove; ad oggi sono stati pubblicati solo tre rapporti sull’ablazione a vapore.30-32 L’altro problema è che l’ablazione a vapore non è ancora rimborsata, il che limiterà il numero di procedure eseguite e quindi renderà ancora più difficile ottenere misurazioni dei risultati. Sono necessari studi comparativi più ampi per confrontare l’efficacia a lungo termine e il rapporto rischio-beneficio dell’ablazione a vapore con quelli delle tecniche endovenose esistenti.
DISCUSSIONE
Il “gold standard” per il trattamento delle vene safene insufficienti è stato la legatura e lo stripping negli ultimi 100 anni. Questa situazione è cambiata nell’ultimo decennio con l’introduzione delle tecniche di ablazione termica endovenosa. Le tecniche EVTA sono sempre eseguite sotto guida duplex e si stanno dimostrando molto efficaci con alti tassi di successo nel follow-up a breve termine. Poiché l’efficacia degli attuali trattamenti EVTA è eccellente (>90%), gli effetti collaterali sono lievi e le complicazioni gravi rare, qualsiasi nuova procedura EVTA dovrebbe avere almeno le stesse prestazioni o preferibilmente alcuni vantaggi rispetto alle tecniche esistenti. L’ipotesi è che l’EVSA sarà efficace almeno quanto l’EVLA o la RFA. I vantaggi dell’EVSA rispetto alle altre procedure di ablazione possono essere una migliore tolleranza del paziente; una procedura più sicura, più veloce e più facile; costi inferiori; e facilità d’uso per le vene perforanti e gli affluenti. Gli studi futuri dovrebbero confrontare i diversi trattamenti endovenosi in termini di efficacia e di risultati riferiti dal paziente. È inoltre necessario un ulteriore lavoro per cercare di rispondere alle restanti domande sull’esatto meccanismo di funzionamento dei diversi trattamenti EVTA. In un’era di valutazione delle tecnologie sanitarie e di analisi del rapporto costo-efficacia, i costi legati al trattamento diventeranno sempre più importanti e questa rimarrà una questione cruciale in futuro.
Due caratteristiche che potrebbero essere vantaggiose (rispetto all’EVLA) sono che l’EVSA viene eseguita con un volume molto piccolo di acqua sterile (circa 2 mL per vena trattata) e che la temperatura è relativamente costante, con un massimo di 120°C. Il catetere a vapore viene introdotto direttamente attraverso l’ago di puntura, senza bisogno di un filo guida o di una guaina, risultando in una procedura facile e sicura. È stata pubblicata solo una serie di casi sull’ablazione a vapore, che ha dimostrato che i risultati riferiti dai pazienti erano favorevoli, la procedura era molto ben tollerata, i punteggi del dolore erano bassi e i pazienti erano molto soddisfatti del trattamento.30 Un vantaggio della procedura EVSA è che il catetere è minuto e molto flessibile (Figura 5); il diametro del catetere a vapore SVS (1,2 mm) è quasi il 50% più piccolo del catetere usato per la RFA segmentaria (2,33 mm). La flessibilità del catetere a vapore può facilitare il posizionamento nei vasi più tortuosi e nelle vene perforanti, che a volte sono di difficile accesso con i cateteri più rigidi usati per la RFA e le fibre di vetro rigide usate per l’EVLA. Anche gli affluenti delle vene possono, quindi, essere trattati con l’EVSA. Il vapore viene rilasciato da due piccole aree sulla punta del catetere, permettendo il trattamento di qualsiasi lunghezza di vena. Il vapore viene rilasciato sotto pressione e, pertanto, si disperde su una distanza di almeno 2 cm. Questo può essere di ulteriore beneficio nel trattamento di vene perforanti corte e di brevi segmenti di affluenti serpeggianti.
La principale limitazione dell’ablazione a vapore è la mancanza di prove; ad oggi sono stati pubblicati solo tre rapporti sull’ablazione a vapore.30-32 L’altro problema è che l’ablazione a vapore non è ancora rimborsata, il che limiterà il numero di procedure eseguite e quindi renderà ancora più difficile ottenere misurazioni dei risultati. Sono necessari studi comparativi più ampi per confrontare l’efficacia a lungo termine e il rapporto rischio-beneficio dell’ablazione a vapore con quelli delle tecniche endovenose esistenti.
DISCUSSIONE
Il “gold standard” per il trattamento delle vene safene insufficienti è stato la legatura e lo stripping negli ultimi 100 anni. Questa situazione è cambiata nell’ultimo decennio con l’introduzione delle tecniche di ablazione termica endovenosa. Le tecniche EVTA sono sempre eseguite sotto guida duplex e si stanno dimostrando molto efficaci con alti tassi di successo nel follow-up a breve termine. Poiché l’efficacia degli attuali trattamenti EVTA è eccellente (>90%), gli effetti collaterali sono lievi e le complicazioni gravi rare, qualsiasi nuova procedura EVTA dovrebbe avere almeno le stesse prestazioni o preferibilmente alcuni vantaggi rispetto alle tecniche esistenti. L’ipotesi è che l’EVSA sarà efficace almeno quanto l’EVLA o la RFA. I vantaggi dell’EVSA rispetto alle altre procedure di ablazione possono essere una migliore tolleranza del paziente; una procedura più sicura, più veloce e più facile; costi inferiori; e facilità d’uso per le vene perforanti e gli affluenti. Gli studi futuri dovrebbero confrontare i diversi trattamenti endovenosi in termini di efficacia e di risultati riferiti dal paziente. È inoltre necessario un ulteriore lavoro per cercare di rispondere alle domande rimanenti sull’esatto meccanismo di funzionamento dei diversi trattamenti EVTA. In un’era di valutazione della tecnologia sanitaria e di analisi del rapporto costo-efficacia, i costi legati al trattamento diventeranno sempre più importanti e questo rimarrà un problema cruciale in futuro.
1. Evans CJ, Fowkes FG, Ruckley CV, Lee AJ. Prevalenza di vene varicose e insufficienza venosa cronica in uomini e donne nella popolazione generale: Edinburgh Vein Study. J Epidemiol Community Health. 1999;53:149-153.
2. Kurz X, Kahn SR, Abenhaim L, et al. Disturbi venosi cronici della gamba: epidemiologia, risultati, diagnosi e gestione. Sintesi di un rapporto basato sull’evidenza della task force VEINES. Studi epidemiologici ed economici sull’insufficienza venosa. Int Angiol. 1999;18:83-102.
3. Abramson JH, Hopp C, Epstein LM. L’epidemiologia delle vene varicose. Un sondaggio in Gerusalemme occidentale. J Epidemiol Community Health. 1981;35:213-217.
4. Brand FN, Dannenberg AL, Abbott RD, Kannel WB. L’epidemiologia delle vene varicose: lo studio Framingham. Am J Prev Med. 1988;4:96-101.
5. Magnusson MB, Nelzen O, Risberg B, Sivertsson R. Uno studio ecografico Doppler a colori del reflusso venoso in pazienti con ulcere croniche delle gambe. Eur J Vasc Endovasc Surg. 2001;21:353-360.
6. De Maeseneer M. La rivoluzione endovenosa. Br J Surg. 2011;98:1037- 1038.
7. Van Den Bos R, Arends L, Kockaert M, Neumann M, Nijsten T..Terapie endovenose delle varicosità degli arti inferiori: una meta-analisi. J Vasc Surg. 2009;49:230-239.
8. Goldman MP. Chiusura della vena safena maggiore con riscaldamento termico a radiofrequenza endoluminale della parete della vena in combinazione con flebectomia ambulatoriale: follow-up preliminare di 6 mesi. Dermatol Surg. 2000;26:452-456.
9. Goldman MP, Mauricio M, Rao J. Chiusura laser intravascolare 1320-nm della grande safena: uno studio di follow-up di 6-12 mesi. Dermatol Surg. 2004;30:1380-1385.
10. Proebstle TM, Herdemann S. Primi risultati e fattibilità dell’ablazione della vena perforante incompetente mediante trattamento laser endovenoso. Dermatol Surg. 2007;33:162-168.
11. Bush RG, Hammond K. Trattamento della vena incompetente di Giacomini (ramo di estensione della coscia). Ann Vasc Surg. 2007;21:245-248.
12. Navarro L, Min RJ, Bone C. Laser endovenoso: un nuovo metodo minimamente invasivo di trattamento per le vene varicose – osservazioni preliminari utilizzando un laser a diodi 810 nm. Dermatol Surg. 2001;27:117-122.
13. Min RJ, Zimmet SE, Isaacs MN, Forrestal MD. Trattamento laser endovenoso della vena safena maggiore incompetente. J Vasc Interv Radiol. 2001;12:1167-1171.
14. Rasmussen LH, Lawaetz M, Bjoern L, Vennits B, Blemings A, Eklof B. Studio clinico randomizzato che confronta l’ablazione laser endovenosa, l’ablazione a radiofrequenza, la scleroterapia con schiuma e lo stripping chirurgico delle vene varicose della grande safena. Br J Surg. 2011;98:1079-1087.
15. Kichari JR, Salomonsz R, Postema RR. . . Ned Tijdschr Geneeskd. 2008;152:1387-1390.
16. Doganci S, Demirkilic U. Confronto tra il laser 980 nm e la fibra a punta nuda e il laser 1470 nm e la fibra radiale nel trattamento delle varicosità della grande safena: uno studio clinico prospettico randomizzato. Eur J Vasc Endovasc Surg. 2010;40:254-259.
17. Schmedt CG, Sroka R, Steckmeier S, et al. Indagine sugli effetti della radiofrequenza e del laser (980 nm) dopo il trattamento endoluminale dell’insufficienza della safena in un modello ex-vivo. Eur J Vasc Endovasc Surg. 2006;32:318- 325.
18. Zikorus AW, Mirizzi MS. Valutazione della temperatura di setpoint e della velocità di pullback sulla temperatura avventizia della vena durante l’erogazione di energia a radiofrequenza endovenosa in un modello in-vitro. Vasc Endovascular Surg. 2004;38:167- 174.
19. Sito web VNUS. http://www.vnus.com (ultimo accesso 4 agosto 2008).
20. Weiss RA, Weiss MA. Occlusione endovenosa a radiofrequenza controllata utilizzando un catetere a radiofrequenza unico sotto guida duplex per eliminare il reflusso della vena safena varicosa: un follow-up di 2 anni. Dermatol Surg. 2002;28:38-42.
21. Proebstle TM, Vago B, Alm J, Göckeritz O, Lebard C, Pichot O. Trattamento della grande safena incompetente mediante ablazione termica segmentale alimentata con radiofrequenza endovenosa: prima esperienza clinica. Vasc Surg. 2008;47:151-156.
22. Sybrandy JE, Wittens CH. Esperienze iniziali nel trattamento endovenoso del reflusso della vena safena. J Vasc Surg. 2002;36:1207-1212.
23. Goldman MP, Amiry S. Chiusura della vena safena maggiore con riscaldamento termico a radiofrequenza endoluminale della parete della vena in combinazione con flebectomia ambulatoriale: 50 pazienti con più di 6 mesi di follow-up. Dermatol Surg. 2002;28:29-31.
24. Manfrini S, Gasbarro V, Danielsson G, et al. Gestione endovenosa del reflusso della safena. Gruppo di studio sulla gestione del reflusso endovenoso. J Vasc Surg. 2000;32:330-342.
25. Chandler JG, Pichot O, Sessa C, Schuller-Petrovi´c S, Osse FJ, Bergan JJ. Definizione del ruolo della legatura estesa della giunzione safeno-femorale: uno studio comparativo prospettico. J Vasc Surg. 2000;32:941-953.
26. Merchant RF, Pichot O; Gruppo di studio sulla chiusura. Risultati a lungo termine dell’obliterazione endovenosa con radiofrequenza del reflusso safenico come trattamento dell’insufficienza venosa superficiale. J Vasc Surg. 2005;42:502- 509.
27. Shepherd AC, Gohel MS, Lim CS, Hamish M, Davies AH. Dolore dopo ablazione laser endovenosa 980-nm e ablazione segmentale a radiofrequenza per le vene varicose: uno studio prospettico osservazionale. Vasc Endovascular Surg. 2010;44:212-216.
28. Proebstle TM, Alm J, Gockeritz O, et al. Three-year European follow-up of endovenous radiofrequency-powered segmental thermal ablation of the great saphenous vein with or without treatment of calf varicosities. J Vasc Surg. 2011;54:146-152.
29. Weiss RA. Confronto tra radiofrequenza endovenosa e occlusione laser a diodi da 810 nm di grandi vene in un modello animale. Dermatol Surg. 2002;28:56-61.
30. van den Bos RR, Milleret R, Neumann M, Nijsten T. Proof-of-principle study of steam ablation as novel thermal therapy for saphenous varicose veins. J Vasc Surg. 2010;53:181-186.
31. Milleret R, Mehier H, Llopinet A, et al. Oblitération veineuse par vapeur à haute température. Phlebologie. 2008;61:223-226.
32. van Ruijven PW, van den Bos RR, Alazard LM, van der Geld CW, Nijsten T. Temperature measurements for dose-finding in steam ablation. J Vasc Surg. 2011;53:1454-1456.