Mortanças a Desenvolver
- Para descrever como os electrões são agrupados dentro dos átomos.
Embora tenhamos discutido a disposição geral das partículas subatómicas nos átomos, pouco temos dito sobre como os electrões ocupam o espaço sobre o núcleo. Movem-se ao acaso em torno do núcleo, ou existem em alguma disposição ordenada?
A teoria moderna do comportamento dos electrões é chamada mecânica quântica. Faz as seguintes afirmações sobre electrões em átomos:
- Os electrões em átomos podem ter apenas certas energias específicas. Dizemos que as energias dos electrões são quantizadas.
- Os electrões são organizados de acordo com as suas energias em conjuntos chamados conchas. Geralmente, quanto maior for a energia de uma concha, mais afastada (em média) do núcleo. As conchas não têm distâncias específicas e fixas do núcleo, mas um electrão numa concha de maior energia passará mais tempo longe do núcleo do que um electrão numa concha de menor energia.
- As conchas são ainda divididas em subconjuntos de electrões denominados subconjuntos. A primeira concha tem apenas uma sub-concha, a segunda concha tem duas sub-conchas, a terceira concha tem três sub-conchas, e assim por diante. As subcascasas de cada concha são rotuladas, em ordem, com as letras s, p, d, e f. Assim, a primeira concha tem apenas uma subcasa s, a segunda concha tem uma s e uma subcasa p, a terceira concha tem subcasas s, p, e d, e assim por diante.
- Diferentes subcasas contêm um número máximo diferente de electrões. Qualquer sub-camada pode conter até 2 electrões; p sub-camada até 6 electrões; d sub-camada até 10; e f sub-camada até 14.
É a disposição dos electrões em conchas que tem mais efeito sobre as propriedades químicas, por isso vamos concentrar-nos principalmente nas conchas aqui.
Usamos números para indicar em que concha está um electrão. A primeira concha, mais próxima do núcleo e com os electrões de mais baixa energia, é a concha 1. Esta primeira concha tem apenas uma sub-casca (rotulada 1s) e pode conter um máximo de 2 electrões. É por isso que existem dois elementos na primeira linha da tabela periódica (H & He).
Porque a primeira concha só pode conter um máximo de 2 electrões, o terceiro electrão tem de ir para a segunda concha. Portanto, o lítio (Li), que tem três electrões totais, terá dois electrões na primeira concha e um electrão na segunda concha. Note-se que o lítio é o primeiro elemento na segunda linha da tabela periódica.
A segunda concha tem duas subcascasas (rotuladas como 2s e 2p). A subcasa 2s tem um máximo de 2 electrões, e a subcasa 2p tem um máximo de 6 electrões. Isto significa que a segunda concha pode conter um máximo de oito electrões (2+6=8). Note-se que existem oito elementos na segunda linha da tabela periódica.
São apenas os electrões na casca mais externa, chamada casca de VALÊNCIA, que tendem a reagir (ser ganhos, perdidos, ou partilhados). Poder-se-ia imaginar que, se dois átomos se encontrassem, seriam os electrões exteriores que interagem primeiro. Segue-se uma lista de electrões totais, electrões por concha, e electrões de valência para os primeiros 10 elementos.
- Hidrogénio tem 1 electrão na primeira concha (portanto um electrão de valência).
- Helium tem 2 electrões — ambos na primeira concha (portanto dois electrões de valência).
- Lithium tem 3 electrões — 2 na primeira concha, e 1 na segunda concha (portanto, um electrão de valência).
- Beryllim tem 4 electrões — 2 na primeira concha, e 2 na segunda concha (portanto, dois electrões de valência).
- Beryllim tem 5 electrões — 2 na primeira concha, e 3 na segunda concha (por isso três electrões de valência).
- Carbon tem 6 electrões — 2 na primeira concha, e 4 na segunda concha (por isso quatro electrões de valência).
- Nitrogénio tem 7 electrões — 2 na primeira concha, e 5 na segunda concha (portanto cinco electrões de valência).
- O oxigénio tem 8 electrões — 2 na primeira concha, e 6 na segunda concha (portanto seis electrões de valência).
- Fluorine tem 9 electrões — 2 na primeira carapaça, e 7 na segunda carapaça (portanto 7 electrões de valência).
- Neon tem 10 electrões — 2 na primeira carapaça, e 8 na segunda carapaça (portanto 8 electrões de valência).
Figure 2.6.1 abaixo lista o número atómico para os elementos principais do grupo. O número atómico define o número de prótons no núcleo de cada átomo. Para átomos neutros, o número de prótons positivos será igual ao número total de elétrons negativos (carga líquida zero). Por exemplo, o bromo (Br) tem 35 protões e 35 elétrons totais. Tabelas periódicas listam sempre o número atómico.

Figure 2.6.1 – Número Atómico para cada um dos Elementos Principais do Grupo
O número de electrões de valência para cada elemento principal do grupo pode ser determinado pela coluna, ou grupo, que ocupa na tabela periódica. A tabela 2.6.2 abaixo resume o número de electrões de valência para cada coluna do grupo principal de elementos. Por exemplo, os elementos da primeira coluna (por vezes etiquetados como IA), todos têm um electrão de valência. A segunda coluna (IIA) tem dois electrões de valência. Saltamos o bloco curto de dez elementos no meio, porque é aqui que uma sub-capa se enche fora de ordem. Os elementos das colunas IIIA, IVA, VA, VIA, e VIIA, e VIIIA* têm três, quatro, cinco, seis, sete, e oito* electrões de valência, respectivamente.
*Nota que o hélio (Ele) tem apenas dois electrões de valência. Algumas tabelas periódicas colocam hélio na coluna IIA, outras colocam-no na VIIIA, e algumas em ambos os locais.
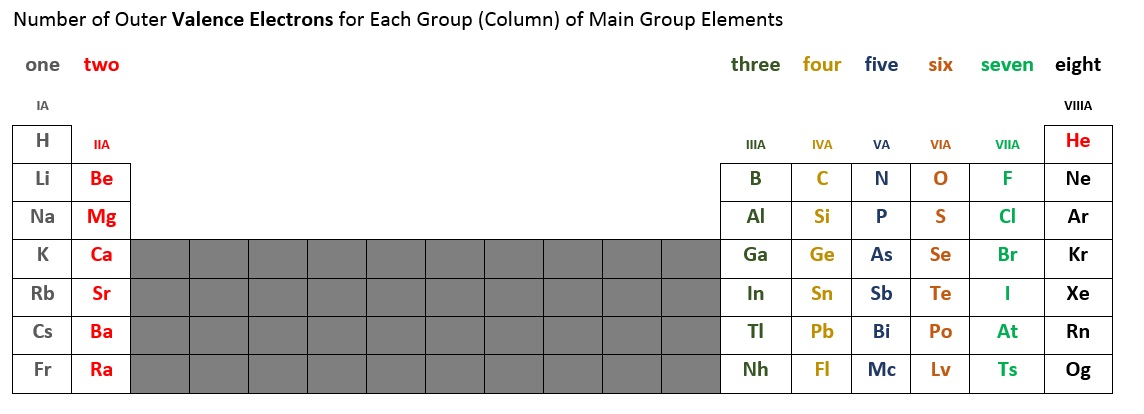
Figure 2.6.2 – Número de Electrões de Valência para Elementos Principais do Grupo
Exemplo {1}(PageIndex{1}}): Electrões de Átomos de Fósforo
Quantos electrões totais e de valência estão num átomo de fósforo neutro?
SOLUÇÃO
Um átomo de fósforo neutro tem 15 electrões totais. Dois electrões podem entrar na primeira concha, oito na segunda concha, e tem mais cinco na terceira concha. A terceira concha é a concha de valência externa, por isso tem 5 electrões de valência.
O número de electrões em cada concha torna-se mais complicado à medida que se adicionam mais electrões, porque há mais sub-conchas a serem utilizadas e porque a concha começa a preencher fora de ordem. Para elementos com número atómico superior a 20 (para além do cálcio), concentrar-nos-emos apenas em quantos electrões totais e quantos de valência, e não no número em cada concha. Afirmámos que os electrões da concha exterior são chamados de valência. As conchas internas (não valência) e os electrões são frequentemente chamados de núcleo.
Exemplo \(\PageIndex{2}}): Contagem do total e dos electrões de valência em átomos de Xénon
Quantos electrões totais, de valência e de núcleo existem num átomo de xenon neutro?
SOLUÇÃO
Xénon tem 54 total, 8 valências, e 46 electrões do núcleo.
Exercícios de Revisão de Conceito
- Como é que os electrões estão organizados em átomos?
- Qual é o número máximo de electrões que podem caber nas duas primeiras conchas de um átomo?
- Qual é a diferença entre electrões do núcleo e electrões de valência?
Respostas
- Os electrões estão organizados em conchas e sub-conchas em torno dos núcleos.
- A primeira concha pode caber um máximo de dois e a segunda concha pode caber um máximo de oito electrões.
- Os electrões de valência estão na concha (exterior) de maior número; todos os outros electrões são electrões de núcleo.
Key Takeaway
- Electrões estão organizados em conchas e sub-conchas sobre o núcleo de um átomo.
Contribuidores
- p>Anónimo/li>