Basicidade das aminas heterocíclicas
Quando um átomo de azoto é incorporado directamente num anel aromático, a sua basicidade depende do contexto de ligação. Num anel de piridina, por exemplo, o par solitário de nitrogénio ocupa um orbital de sp2-híbrido, e não faz parte do sexteto aromático – é essencialmente um imine nitrogénio. O seu par de electrões está disponível para formar uma ligação a um próton, e assim o átomo de azoto em piridina é um pouco básico.

Num anel de pirrolo, em contraste, o par solitário de azoto faz parte do sexteto aromático. Isto significa que estes electrões são muito estáveis exactamente onde estão (no sistema aromático), e estão muito menos disponíveis para se ligarem a um protão (e se pegarem num protão, o sistema aromático é destruído). Por estas razões, os nitrogénicos pirotécnicos não são fortemente básicos.

Os exemplos de anilina, piridina, e pirrolina são bons modelos para prever a reactividade dos átomos de azoto em sistemas circulares mais complexos (uma enorme diversidade dos quais se encontram na natureza). A cadeia lateral triptofano, por exemplo, contém um azoto “tipo pirrol” não-básico, enquanto que a adenina (uma base de ADN/RNA) contém os três tipos.


Os electrões de par único sobre o nitrilo estão contidos num orbital híbrido sp. O carácter de 50% s de um orbital híbrido sp significa que os electrões estão próximos do núcleo e portanto não são significativamente básicos.
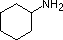
Uma revisão dos conceitos básicos de base ácida deve ser útil para a discussão seguinte. Tal como o amoníaco, a maioria das aminas são bases Brønsted e Lewis, mas a sua força de base pode ser enormemente alterada por substitutos. É comum comparar quantitativamente a basicidade usando os pKa’s dos seus ácidos conjugados em vez dos seus pKb’s. Uma vez que pKa + pKb = 14, quanto mais alto o pKa, mais forte é a base, em contraste com a habitual relação inversa de pKa com a acidez. A maioria das aminas alquílicas simples têm pKa na gama de 9,5 a 11,0, e as suas soluções de água são básicas (têm um pH de 11 a 12, dependendo da concentração). Os primeiros quatro compostos da tabela seguinte, incluindo amoníaco, enquadram-se nessa categoria.
Os últimos cinco compostos (células coloridas) são bases significativamente mais fracas como consequência de três factores. O primeiro deles é a hibridização do azoto. Na piridina o azoto é sp2 hibridizado, e nos nitrilos (última entrada) um azoto híbrido sp faz parte da ligação tripla. Em cada um destes compostos (vermelho sombreado) o par de electrões sem ligação é localizado no átomo de azoto, mas o aumento do s-caracter aproxima-o do núcleo de azoto, reduzindo a sua tendência para se ligar a um protão.
|
Compound |
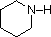 |
 |
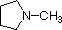 |
NH3 |  |
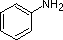 |
 |
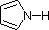 |
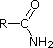 |
CH3C≡N |
|---|---|---|---|---|---|---|---|---|---|---|
| pKa | 11.0 | 10.7 | 10.7 | 9.3 | 5.2 | 4.6 | 1.0 | 0.0 | -1.0 | -10. |
Basicidade das aminas comuns (pKa dos iões de amónio conjugados)
Finalmente, a baixíssima basicidade do pirrol (azul sombreado) reflecte a excepcional deslocalização do par de electrões de azoto associado à sua incorporação num anel aromático. Indole (pKa = -2) e imidazole (pKa = 7,0), ver acima, também têm anéis aromáticos heterocíclicos semelhantes. O imidazol é mais de um milhão de vezes mais básico do que a pirólise porque o azoto sp2 que faz parte de uma dupla ligação é estruturalmente semelhante à piridina, e tem uma basicidade comparável.
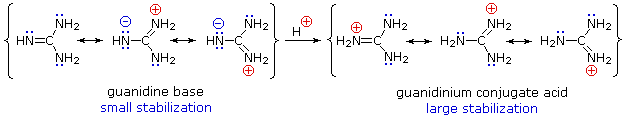
Embora a deslocalização por ressonância reduza geralmente a basicidade das aminas, um exemplo dramático do efeito inverso encontra-se na guanidina composta (pKa = 13,6). Aqui, como mostrado abaixo, a estabilização de ressonância da base é pequena, devido à separação da carga, enquanto que o ácido conjugado é fortemente estabilizado pela deslocalização da carga. Consequentemente, as soluções aquosas de guanidina são quase tão básicas como as soluções de hidróxido de sódio.