Karthish Manthiram sonha com um futuro electrificado. O engenheiro químico do MIT está entre um grupo crescente de investigadores que exploram formas através das quais a electroquímica alimentada por energias renováveis poderia substituir os combustíveis fósseis como base da indústria química.
‘A visão geral é pensar num futuro em que a produção química comece apenas com dióxido de carbono, água e nitrogénio’, diz Manthiram. Se começarmos com estas três matérias-primas, e tivermos electricidade renovável, então podemos prever a utilização de dióxido de carbono como fonte de átomos de carbono, utilizando água para oxigénio e hidrogénio, e dinitrogénio como fonte de azoto, e começar a coser moléculas orgânicas relativamente complexas”, diz ele.
Nesse mundo futuro com que sonhamos, poderíamos fazer amoníaco apenas a partir do ar, água e electricidade renovável
elevada na lista de moléculas que os investigadores de electroquímica querem fazer desta forma é o amoníaco. Um ingrediente chave no fertilizante sintético, são produzidas anualmente cerca de 175 milhões de toneladas de amoníaco. Mas as grandes quantidades em que é produzido, e a natureza energética intensiva da sua produção, significa que as plantas de amoníaco consomem aproximadamente 2% da produção global de energia, e produzem uma proporção semelhante das emissões globais de dióxido de carbono.
Com o rápido aumento da disponibilidade de electricidade renovável, os investigadores podem ver uma via alternativa ao amoníaco. Nesse mundo futuro com que sonhamos, poderíamos produzir amoníaco apenas com ar, água e electricidade renovável”, diz Manthiram. Este ano, o laboratório de Manthiram juntou-se aos poucos em todo o mundo para ter demonstrado definitivamente que, quando mediado por um electrocatalisador de lítio, o amoníaco poderia ser feito desta forma.
Num campo de investigação jovem em que as primeiras alegações de produção electroquímica de amoníaco muitas vezes não resistiram ao escrutínio, o punhado de resultados robustos envolvendo a produção de amoníaco mediado pelo lítio poderia formar a base sólida a partir da qual um futuro de amoníaco limpo começaria a ser construído.
Dores de cabeça rachados
O grande desafio da síntese do amoníaco, electroquímico ou não, é a exigência de tirar o dinitrogénio do ar, e parti-lo em dois. A tripla ligação que mantém os dois átomos de azoto juntos é uma das mais fortes conhecidas.
Durante o século passado, as plantas de amoníaco superaram as reticências do dinitrogénio em reagir através de um processo em duas etapas. Na primeira etapa, a reacção reformadora de vapor-metano, água e metano são aquecidos sobre um catalisador que encoraja a troca do parceiro atómico, produzindo um fluxo de dióxido de carbono e hidrogénio. O hidrogénio é então reagido com azoto sobre um catalisador de ferro no processo Haber-Bosch, com o nome dos químicos alemães Fritz Haber que inventaram a reacção, e Carl Bosch que a refinou para a indústria.
Uma grande parte da nossa desigualdade no acesso aos alimentos no mundo deve-se ao facto de a produção de amoníaco estar centralizada
O que Haber descobriu foi uma forma de contornar o problema, às altas temperaturas necessárias para dividir o dinitrogénio, o equilíbrio para a formação de amoníaco situa-se longe à esquerda, diz Ib Chorkendorff, investigador de catálise na Universidade Técnica da Dinamarca, e director do Centro de Villum para a ciência dos combustíveis e produtos químicos sustentáveis. A grande invenção de Haber foi perceber que não se obterá amoníaco a menos que se exerça pressão”, diz Chorkendorff. ‘Se pegarmos em quatro moles de gás e o transformarmos em dois, a pressão ajuda muito’. As plantas Haber Bosch hoje em dia funcionam normalmente a pressões superiores a 200 atmosferas.
O dióxido de carbono estequiométrico que a reacção produz, bem como as emissões de carbono envolvidas na geração das altas temperaturas e pressões necessárias, é uma razão imperiosa para se procurar uma abordagem alternativa. Mas mesmo que o dióxido de carbono não fosse um gás de aprisionamento infravermelho que conduz ao aquecimento global, ainda teríamos um problema com o processo”, diz Manthiram. As temperaturas e pressões realmente elevadas significam que não é possível fazer esta reacção de forma distribuída.’
O custo da construção de reactores de alta pressão aponta fortemente o equilíbrio económico para a construção de centrais de amoníaco muito grandes e centralizadas. Uma grande parte da nossa desigualdade no acesso aos alimentos no mundo deve-se ao facto de a produção de amoníaco estar centralizada”, diz Manthiram. Na África subsariana, a infra-estrutura de distribuição é tão pobre que o fertilizante acaba por custar duas a três vezes mais do que a média internacional. Isto limita a sua utilização, o que leva a baixos rendimentos das culturas, fome, menor produtividade da força de trabalho, rendimentos mais baixos, o que limita ainda mais a capacidade de pagar o fertilizante. Este é um enorme problema a resolver.’
Amoníaco feito de ar, água e electricidade renovável, a temperaturas e pressões ambientes, pode ser feito onde quer que seja necessário.
Feeling renewables’ pull
Investigadores têm tentado durante décadas encontrar alternativas mais ecológicas à reacção Haber-Bosch. A diferença desta vez é o mercado energético em rápida mudança, diz Doug MacFarlane, um químico da Universidade de Monash que dirige o Centro de Excelência do Conselho Australiano de Investigação para a Ciência dos Eletromateriais. Nos últimos 10 anos mais ou menos, quantidades crescentes de energias renováveis cada vez mais baratas tornaram-se disponíveis”, diz MacFarlane. Desde 2010, o preço da energia solar caiu 80%, e o da energia eólica 50%, com a perspectiva de novas quedas. Isto colocou o foco nas tecnologias electroquímicas de forma muito ampla, utilizando electrões como o derradeiro redutor”, diz ele.

Source: Cortesia do Science and Technology Facilities Council
Siemens Energy Green Ammonia Demonstrator no Reino Unido está a testar a divisão da água e a química Haber-Bosch
Laboratório do MacFarlane – como muitos laboratórios de síntese electroquímica – inicialmente centrado na química de divisão da água orientada para as energias renováveis, para produzir um fluxo de hidrogénio limpo que poderia ser utilizado como matéria-prima ou combustível. A segunda vaga de investigação centrou-se na redução do dióxido de carbono, para transformar as emissões de carbono em produtos úteis, diz ele. Crescendo a partir daí, há cerca de seis anos começámos a perceber que a nossa investigação tinha uma terceira perspectiva, que era a redução do azoto”, diz MacFarlane. ‘São as mesmas ideias, o mesmo kit de laboratório, mas um substrato e um produto alvo diferentes’. Em vez de hidrogénio, a célula produziria um fluxo de amoníaco.
A produção de amoníaco poderia ir muito além da utilização de fertilizantes. A queda dos preços da electricidade impulsionada pelas energias renováveis já provocou um repensar da tradicional reacção de reforma a vapor (ver caixa Reforma eléctrica abaixo). Países como a Austrália, que têm recursos solares e eólicos muito para além das suas próprias necessidades, estão a analisar a síntese electroquímica do amoníaco não só para a produção de fertilizantes mais limpos, mas também como um combustível verde que poderia permitir a exportação de energia renovável.
Em Maio de 2020, MacFarlane e os seus colegas publicaram um roteiro que estabelece a rota potencial para uma economia de amoníaco verde. O conceito de primeira geração, a ideia de combinar a produção convencional de amoníaco com a captura de carbono, já está a ser ultrapassado por uma abordagem de segunda geração, na qual o hidrogénio para Haber-Bosch provém da separação electroquímica da água a partir de energias renováveis, em vez da reforma a vapor movida a metano.
Após décadas de investigação, a separação electroquímica da água chegou ao ponto de estarem disponíveis separadores de água à escala industrial, de empresas como a ITM-Power no Reino Unido e a Siemens na Alemanha. A Siemens já testou o conceito de combinar o separador de água e a Haber-Bosch no Demonstrador de Amónia Verde da Siemens em Oxfordshire. Na região de Pilbara na Austrália Ocidental – que recebe alguma da mais elevada energia solar anual de qualquer parte do planeta – a Yara Fertilisers está também a preparar-se para pilotar o interruptor. Esta fábrica produz actualmente 5% do amoníaco do mundo.
A principal barreira à ampla absorção da produção de amoníaco de segunda geração já não é o custo da electricidade renovável, diz MacFarlane. A barreira é o custo de capital das células de electrólise”, diz ele. Os eléctrodos de melhor desempenho para a divisão da água utilizam metais preciosos.
Reformação eléctrica
O primeiro passo na síntese convencional do amoníaco é gerar o hidrogénio que será combinado com o dinitrogénio para produzir amoníaco. Actualmente, esse hidrogénio provém do metano, através da reacção de reforma a vapor, impulsionado por um conjunto de queimadores de gás em torno dos tubos revestidos com catalisador em que a reacção tem lugar.
A quantidade de catalisador pode ser reduzida por uma ordem de magnitude
A reforma do vapor é tão endotérmica, gera um gradiente significativo de temperatura dentro do tubo, que pode levar à acumulação de carbono na superfície do catalisador e ao bloqueio ou mesmo à ruptura do tubo.
Em 2019, Chorkendorff mostrou que a reacção poderia ser impulsionada de forma muito mais eficaz pelo aquecimento óhmico. A passagem de uma corrente eléctrica através do tubo reformador de vapor de aço gera calor in situ, devido à resistividade eléctrica. “Temos um contacto muito próximo entre a fonte de aquecimento e o catalisador, o que elimina todos os problemas de transporte de calor e não temos qualquer gradiente de temperatura”, diz Chorkendorff.
Ajunto de evitar a deposição de carbono, o aquecimento óhmico oferece muitas vantagens, acrescenta Chorkendorff. O arranque de uma instalação de reforma a vapor demora geralmente cerca de uma semana, mas o sistema de aquecimento ôhmico demora cerca de dois minutos. A quantidade de catalisador pode ser reduzida por uma ordem de magnitude, e o tamanho da planta por duas ordens de magnitude”, diz ele. Anteriormente, o custo da electricidade tornava o aquecimento óhmico proibitivamente caro – mas com as energias renováveis, já não é esse o caso, diz Chorkendorff. A empresa Chorkendorff estabeleceu uma parceria para levar a cabo a investigação já está a trabalhar numa instalação piloto, e tem planos para o aquecimento óhmico muito além da reforma do vapor, diz ele.
Cortar custos
Electrodos de platina e irídio têm sido um alvo a longo prazo do laboratório da Chorkendorf. Em 2005, a equipa mostrou que o sulfureto de molibdénio faz um forte electrocatalisador para a reacção de evolução do hidrogénio. A parte catalítica activa do MoS2 revelou-se ao longo das bordas do catalisador, em vez da sua superfície plana, o que levou a muita investigação no desenvolvimento de materiais MoS2 nanoestruturados ou estratificados que maximizam a proporção de bordas.
Sabemos que um catalisador OER tem de ser um óxido e tem de ser estável até pH extremo
‘Temos olhado muito para a evolução do hidrogénio, mas consideramos isso resolvido – existem alguns catalisadores muito bons’, diz Chorkendorff. ‘O verdadeiro problema é a energia perdida devido à evolução do oxigénio’, argumenta ele. As células divisoras de água produzem hidrogénio no cátodo e oxigénio no ânodo (ver caixa Entretanto, no ânodo abaixo). A baixa eficiência no lado da reacção de evolução do oxigénio (OER) do separador de água torna todo o processo mais intensivo em termos energéticos e mais dispendioso de correr. Hoje funcionam com uma eficiência máxima de 70%, mas normalmente não tão elevada.’
Embora anos de trabalho, a descoberta do catalisador OER ainda está para vir. ‘Não há nada que diga que não conseguimos encontrar um material, mas sabemos que está a ficar apertado – sabemos que tem de ser um óxido, tem de ser estável ou em ácido forte ou em solução alcalina forte’, diz Chorkendorff. Os electrolisadores são executados num extremo ou noutro da escala de pH para maximizar a eficiência, mas os catalisadores OER mais activos não são suficientemente estáveis nestas condições para uma utilização prática a longo prazo.
Um conceito, introduzido por Daniel Nocera, então no Massachusetts Institute of Technology nos EUA, é o de catalisadores OER auto-curativos, que formam in-situ e regeneram continuamente a partir de iões metálicos no electrólito. Os catalisadores electrocatalisadores Nocera operavam em condições neutras. Em 2019, MacFarlane e os seus colegas demonstraram uma auto-cura, catalisador OER de óxido metálico misto gerado in situ para condições fortemente ácidas.
Meanwhile, at the anode
Para a maioria dos processos electroquímicos – fazendo hidrogénio ou amoníaco, ou reduzindo o dióxido de carbono – todos os olhos estão sobre o cátodo. A reacção companheira que ocorre no ânodo é um processo oxidativo que tipicamente gera oxigénio, um subproduto inócuo do evento principal.
‘Muitas pessoas consideram o oxigénio apenas como um produto residual’, diz Chorkendorff. Mas há utilizações potencialmente valiosas para o gás. Um fluxo de oxigénio puro é fundamental para o conceito de centrais eléctricas oxicorte, que contornam os problemas de captura de carbono através da queima de combustível em oxigénio em vez de ar. Se queimar biomassa numa central eléctrica com esse oxigénio, obtém-se um grau muito superior de dióxido de carbono’, diz Chorkendorff.
Manthiram também vê valor na reacção do ânodo. Temos estado a trabalhar em métodos através dos quais se pode utilizar esse oxigénio para síntese química, em vez de tentar combinar dois átomos de oxigénio para tornar o dio-oxigénio, o que é cinicamente difícil de fazer”. Com base em trabalhos anteriores, a equipa sabia que o óxido de manganês é um catalisador que oxida a água, gerando no processo uma espécie de oxo de manganês. E se pudéssemos interceptar isso utilizando uma olefina, para fazer um epoxídico? pergunta Manthiram. ‘Foi puramente conjectura, mas de alguma forma funcionou’. Para além de produzir epoxídeos, a equipa mostrou que pode inserir oxigénio numa ligação carbono-carbono para fazer lactonas. Poderia tornar o electrolisador de água mais viável economicamente”, diz Manthiram. Não há maneira de tornar todo o hidrogénio do mundo desta forma – temos uma necessidade demasiado grande de hidrogénio – mas poderíamos fazer algum hidrogénio que seja realmente barato enquanto co-criamos lactonas que vão para plásticos biodegradáveis de alto volume, ou epóxidos de alto volume para fazer etilenoglicol.
Fontes não fiáveis
Com a divisão da água ainda por aperfeiçoar, e com a sua contínua dependência da reacção Haber-Bosch, a esperança é que a produção de amoníaco verde de segunda geração seja um trampolim para o objectivo final de produzir amoníaco directamente por meios electroquímicos. Em vez de produzir gás dihidrogénio, os átomos de hidrogénio e azoto poderiam ser combinados in situ no cátodo para produzir amoníaco.
O principal desafio é encontrar formas de favorecer a produção de amoníaco em detrimento da formação de di-hidrogénio, explica Manthiram. O reservatório de electrões no cátodo poderia reagir com dois prótons em solução para fazer hidrogénio; ou em vez disso reagir com azoto para quebrar a ligação tripla, e também recrutar seis prótons, para fazer duas moléculas de amoníaco”, diz Manthiram. Praticamente qualquer catalisador tenderá a produzir mais hidrogénio do que amoníaco.’
Nos últimos cerca de cinco anos, apareceu um fluxo de papéis que parecia mostrar catalisadores que poderiam produzir algum amoníaco no fluxo de gás predominantemente hidrogénio produzido no cátodo. Entretanto, o laboratório do MacFarlane estava a testar a ideia de que uma boa maneira de suprimir a produção de hidrogénio seria eliminar uma das principais fontes de protões – o electrólito. Mudando para um electrólito líquido iónico aprox., e depois apenas adicionando a quantidade controlada de água, ácido ou base, a equipa mostrou que poderia favorecer a produção de amoníaco.
Virtualmente qualquer catalisador tenderá a produzir mais hidrogénio do que amoníaco
‘O trabalho aproximado é bastante agnóstico sobre o catalisador, por isso a nossa abordagem foi sempre aplicá-lo ao melhor catalisador que pudéssemos encontrar’, diz MacFarlane. Sempre que um artigo sobre um novo catalisador fosse publicado, tentaríamos rapidamente repetir o trabalho literário, e depois aplicá-lo no nosso trabalho aprox. Em alguma frustração, em alguns casos depois de falar com os autores envolvidos, nunca conseguimos que um catalisador da literatura funcionasse bem. Acabámos por nos tornar especialistas no que não funciona.’
Embora seja muito difícil transformar nitrogénio em amoníaco, é demasiado fácil produzir vestígios de amoníaco a partir de outras fontes de nitrogénio. A longa lista de possíveis fontes de azoto adventício inclui o eléctrodo, ou vestígios de NO ou NO2 no fornecimento de gás nitrogénio. Eliminar ou contabilizar estas fontes, e a quantidade de azoto a ser convertida em amoníaco pela maioria dos sistemas catalíticos é tão baixa que não tem qualquer interesse prático, diz MacFarlane.
‘ tem sido um grande defensor de descobrir de onde vem realmente o amoníaco e se o catalisador está realmente a fazer o trabalho’, diz Lauren Greenlee da Universidade do Arkansas nos EUA, que foi uma das primeiras a trabalhar na produção de amoníaco electrocatalítico, e uma das primeiras a salientar que o amoníaco adventício era uma grande preocupação. A conversão directa do dinitrogénio em duas moléculas de amoníaco na superfície do catalisador é apenas um problema muito difícil, e não sei se estamos assim tão perto de o resolver.’
Por agora, Greenlee recuou das experiências de produção de amoníaco para realizar uma investigação mais fundamental sobre o problema. Interessamo-nos pela química do electrólito, e trabalhamos para compreender a química da superfície do catalisador e como ela muda com estes electrólitos’, diz Greenlee. Não prometo fazer amoníaco, mas esperemos aprender muito sobre o catalisador e contribuir para esse campo.’
Looking to lithium
As well as Greenlee and MacFarlane, Chorkendorff expôs as experiências de controlo rigoroso, incluindo a utilização de dinitrogénio radiolabelado, necessárias para mostrar que o amoníaco produzido é de facto proveniente do dinitrogénio e não de uma fonte alternativa de azoto. Publicámos um método, porque estou farto de olhar para todos aqueles documentos que afirmam estar a produzir amoníaco, porque não estão a produzir nenhum”, diz Chorkendorff. “Só conheço um sistema que está a fazer amoníaco com certeza, e que é a via mediada pelo lítio.
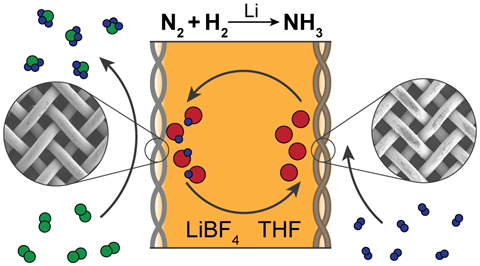
Source: © Nikifar Lazouski et al/Springer Nature Limited 2020
Catalisadores à base de lítio parecem ser o melhor sistema, como neste desenvolvido pelo grupo de Karthish Manthiram no MIT
Lithium é o único metal que pode reagir espontaneamente com o dinitrogénio para formar um nitreto metálico – quebrando a tripla ligação do dinitrogénio no processo. A capacidade do lítio para gerar amónia foi demonstrada por investigadores japoneses em meados da década de 1990 – o único protocolo que Chorkendorff foi capaz de reproduzir.
A abordagem mediada pelo lítio ao amónia é actualmente a única que, sem sombra de dúvida, funciona, MacFarlane concorda. A desvantagem do lítio é que envolve uma pesada penalização de eficiência energética, exigindo um potencial excessivo de mais de 3V. Isto é muita energia que será desperdiçada, perdida como calor, e é por isso que não foi captada e desenvolvida anteriormente’, diz MacFarlane.
Mas o que o protocolo tem de bom é o facto de funcionar definitivamente – e oferece muitas direcções para pesquisas futuras. A abordagem mediada pelo lítio é a nossa principal abordagem neste momento”, diz MacFarlane. Uma forma óbvia de resolver o problema energético é olhar para outros metais, e os seus nitretos metálicos, que realizariam este processo a um custo energético mais baixo, um potencial energético menos negativo’, diz ele.
No laboratório de Chorkendorff, o foco está em compreender o que torna o lítio eficaz em primeiro lugar. Estamos, antes de mais, a descobrir o que realmente se encontra nessa superfície para levar a cabo esse processo. Estamos a utilizar o synchrotron em Stanford, tentando construir um modelo para o processo.
Há alguns anos atrás, as taxas eram tão baixas que nem sequer sabíamos se estávamos a fazer amoníaco
Manthiram, entretanto, tem procurado formas de enfrentar o problema de conseguir que os gases reajam eficientemente numa célula electroquímica de base líquida. Demonstrámos como se poderia utilizar um eléctrodo de difusão de gás como meio de introduzir gás nitrogénio de forma muito mais eficaz no reactor, ultrapassar as limitações de transporte, e assim fazer amoníaco a taxas muito mais rápidas e maior selectividade para fazer amoníaco versus hidrogénio”, diz ele. A equipa atingiu um rendimento recorde de amoníaco.
Até agora, o reactor de difusão de gás funciona apenas durante alguns minutos, e com um potencial extremo de sobrepotência. Eles estão a forçá-lo – mas apesar dos inconvenientes, gosto muito desse papel’, diz Chorkendorff. Mostra o caminho a seguir e a ciência necessária.’
A equipa – e o campo – tem o seu trabalho cortado para transformar o processo numa solução prática para fertilizar as culturas, ou para armazenar e transportar energia renovável, diz Manthiram. “Mas quando pensamos onde estávamos neste campo há uns anos atrás, as taxas eram tão baixas que nem sabíamos se estávamos a fazer amoníaco. Estamos finalmente no ponto, penso que o nosso artigo mostra, que as taxas são tão elevadas que não é necessário fazer uma experiência de controlo com azoto rotulado para demonstrar que o amoníaco é real. É impossível que haja amoníaco adventício nessas concentrações”. Embora se apresse a acrescentar que a equipa ainda faz as experiências de controlo.
Por enquanto, a equipa está a suportar o problema inerente de sobrepotência do lítio. ‘É a portagem que se tem de pagar para seguir por este caminho, e chegámos a um acordo sobre o pagamento desse preço, porque não há outro sistema que possa funcionar mesmo nas proximidades das taxas que alcançámos com o lítio’, diz Manthiram. “Ficaria surpreendido se na próxima década não surgissem outros métodos que não pagassem essa penalidade”, acrescenta ele. Mas é aqui que o campo está agora.’
James Mitchell Crow é um escritor científico sediado em Melbourne, Austrália