Um composto é uma substância formada quando dois ou mais elementos químicos estão quimicamente ligados entre si. Nas misturas, as substâncias presentes não estão quimicamente ligadas entre si.
 br>
br>
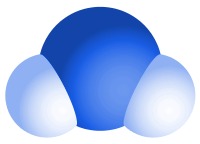
Água: dois átomos de hidrogénio ligados a um átomo de oxigénio.
O tipo de ligações que mantêm elementos juntos num composto pode variar: dois tipos comuns são ligações covalentes e ligações iónicas.
Os elementos em qualquer composto estão sempre presentes em proporções fixas.
Exemplo 1:A água pura é um composto feito de dois elementos – hidrogénio e oxigénio. A razão hidrogénio/oxigénio na água é sempre 2:1. Cada molécula de água contém dois átomos de hidrogénio ligados a um único átomo de oxigénio.
Exemplo 2: O sal puro de mesa é um composto feito a partir de dois elementos – sódio e cloro. A proporção de iões de sódio em cloreto de sódio é sempre 1:1.
Exemplo 3:Metano puro é um composto feito a partir de dois elementos – carbono e hidrogénio. A razão hidrogénio/carbono no metano é sempre 4:1.
Exemplo 4:A glucose pura é um composto feito a partir de três elementos – carbono, hidrogénio e oxigénio. A razão hidrogénio/carbono e oxigénio na glucose é sempre 2:1:1.
Compostos podem ser decompostos quimicamente nos seus elementos constituintes.
Outras diferenças entre compostos e misturas são listadas na definição de mistura.