Enolização ou tautomerismo keto-enol é um processo de conversão de uma cetona ou aldeído a um enol correspondente (em condições ácidas) ou a um enolado (em condições básicas). Este processo também pode ocorrer em ésteres. No entanto, vou concentrar-me nos aldeídos e cetonas neste posto, para não o sobrecarregar com os pormenores e nuances.
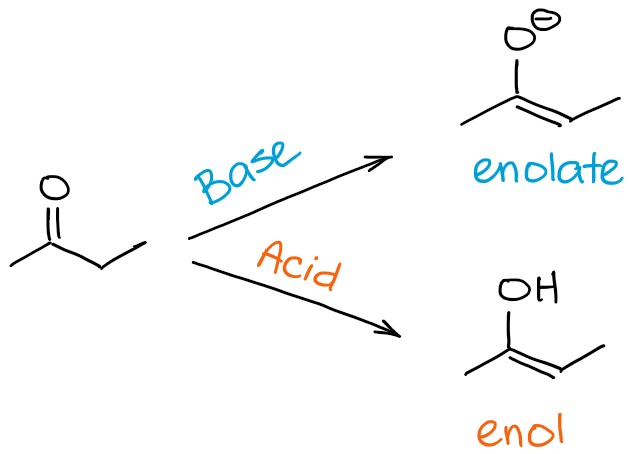
So, qual é a diferença entre uma enolização e um processo de tautomerização de keto-enol? Uma resposta curta não é realmente nenhuma 😊
Quando nos referimos à enolização, referimo-nos especificamente ao processo que o leva de uma cetona ou um aldeído a um enol ou a um enolado. Quando nos referimos a um tautomerismo de keto-enol, referimo-nos ao equilíbrio em geral. Assim, ao dizer que a minha molécula sofre a tautomerização do keto-enol, posso implicar a direcção do processo, mas geralmente não o aponto per se. A direcção da tautomerização do keto-enol, contudo, pode muitas vezes ser deduzida do contexto da reacção.
Em resumo, se dissermos que a molécula “A” sofre uma enolização, isso significa que “A” se torna um enol ou um enolado. Se dissermos que uma molécula “B” sofre uma tautomerização de keto-enol, pode significar uma enolização se B for um carbonilo, ou pode significar um processo inverso se B já for um enol ou um enolado.
Enolização de base catalisada
Embora a enolização possa ocorrer tanto em condições básicas como ácidas, a enolização de base catalisada é uma forma mais comum de fazer esta reacção. Assim, penso que é uma boa ideia rever primeiro a enolização em condições básicas.
Em condições básicas, uma cetona ou um aldeído actua como um ácido Brønsted doando um próton de um α-carbono para uma base na solução. Este processo dá um anião enolizado ressoncentemente estabilizado:

Desde que neste equilíbrio o nosso carbonilo actue como um ácido, tem de ser suficientemente ácido para dar o protão. Em alternativa, a base precisa de ser suficientemente forte para conduzir este equilíbrio em direcção ao produto.
How Acidic Are Hydrogens on the α-Carbons?
The enolate anion is a ressonancely stabilized species, so the extent of the ressonance stabilization plays a very significant role in the acidity of carbonyl compounds. Sabemos, que quanto mais contribuidores de ressonância pudermos extrair para a base conjugada, mais estável ela é. E quanto mais estável for a base conjugada, mais ácido é o ácido original. Assim, os hidrogénios entre duas ligações C=O serão significativamente mais ácidos do que os próximos de apenas um C=O.
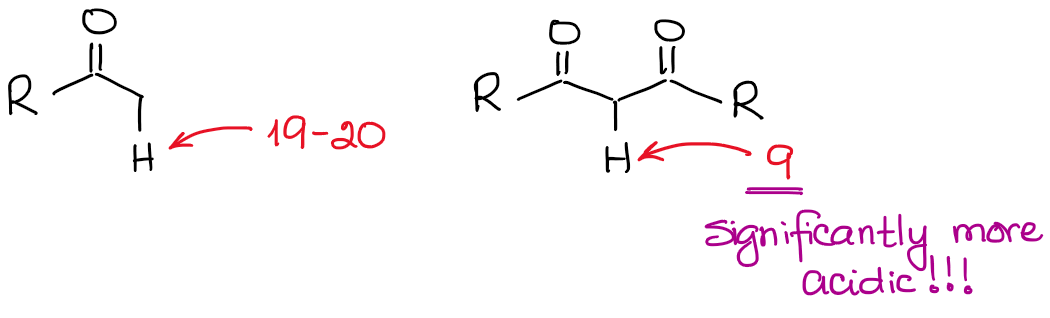
Se compararmos as bases conjugadas em ambos os casos, veremos que o dicarbonilo tem uma melhor estabilização da ressonância da carga negativa através de um sistema conjugado mais alargado.
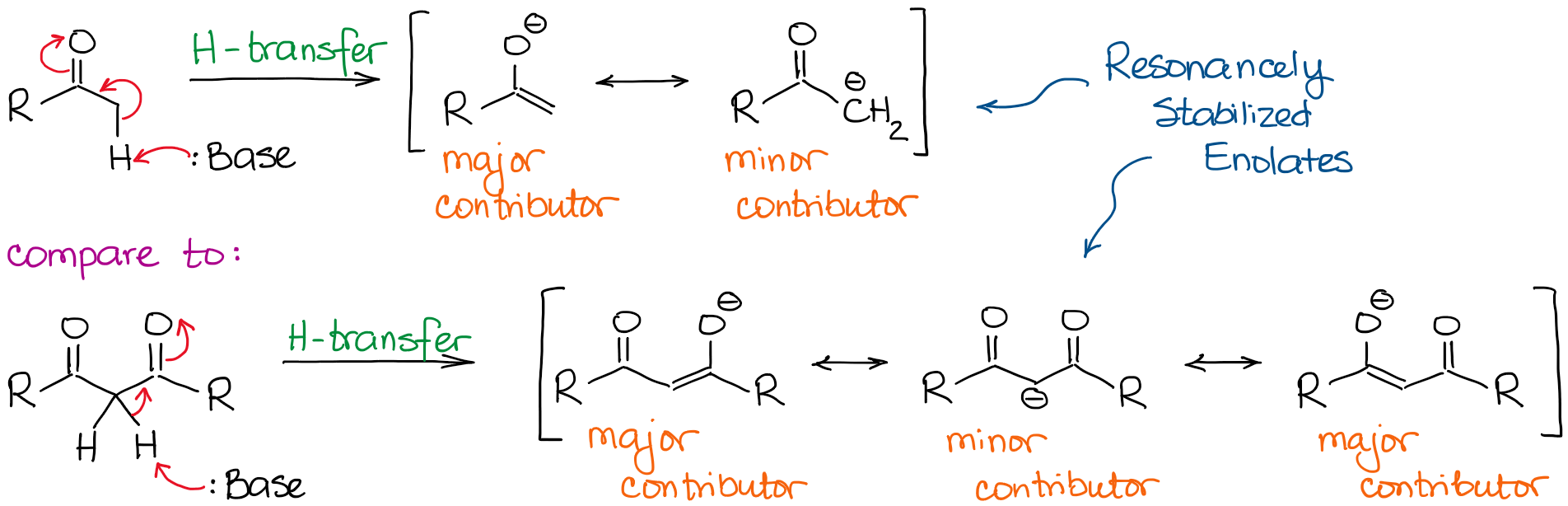
Um maior contribuinte de ressonância adicional no ânion dicarbonilo torna a molécula cerca de 10000000000 vezes mais ácida! Assim, a natureza de uma cetona ou de um aldeído é bastante clara aqui: quanto mais C=O se liga ao lado de um hidrogénio, mais ácido se torna.
Efeito de uma Base no Equilíbrio de Enolização
Bases têm forças muito diferentes. Portanto, a escolha de uma base é importante se se quiser conduzir o equilíbrio até à sua conclusão. Vejamos algumas bases que tipicamente vemos nas reacções da química orgânica:
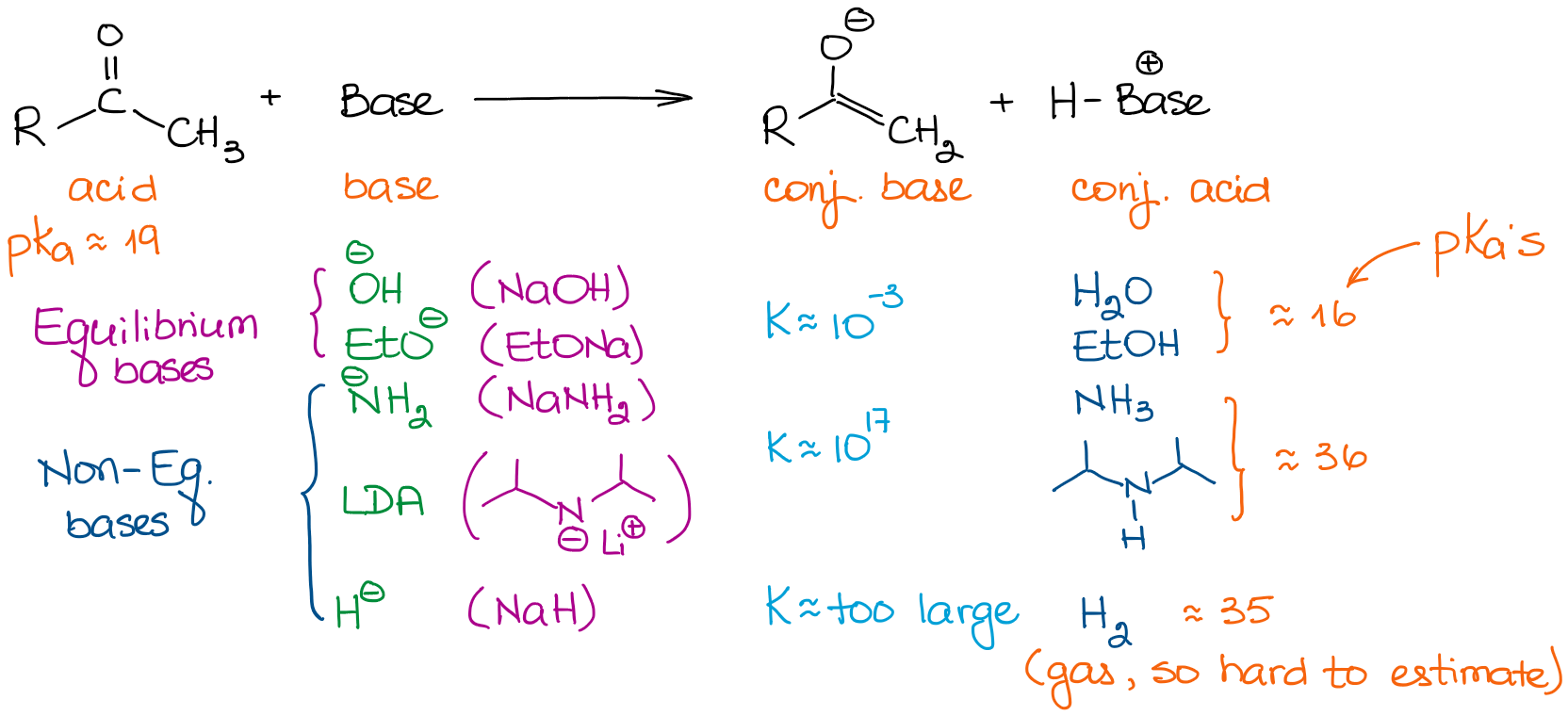
Quando estamos a lidar com os aldeídos e cetonas simples, podemos classificar todas as bases em duas categorias: bases de equilíbrio e não-equilíbrio. As bases de equilíbrio são relativamente fracas. Isto significa que só podem conduzir o equilíbrio a um grau muito modesto. Assim, a concentração real de um enolado na solução será muito pequena. A reacção estará também num equilíbrio constante entre a matéria de partida e um enolado. Estas bases favorecem a formação de enolatos mais estáveis termodinamicamente. Estes enolatos são chamados enolatos termodinâmicos.
Bases não-equilibradas, no entanto, são muito fortes. Isto leva a uma reacção de transferência de prótons (ácido-base) com constantes de equilíbrio muito grandes. Quando temos uma constante de equilíbrio superior a 103, o equilíbrio é completamente deslocado para os produtos. Assim, uma enolização com uma base como a LDA dá praticamente 100% de enolização. Assim, a concentração do aldeído inicial ou uma cetona é basicamente zero.
Carbonyls with One C=O Bond vs β-Dicarbonyls
Como mencionei acima, β-dicarbonyls são significativamente mais ácidos do que os aldeídos e cetonas regulares. Vamos olhar para uma constante de equilíbrio nos dois casos seguintes:
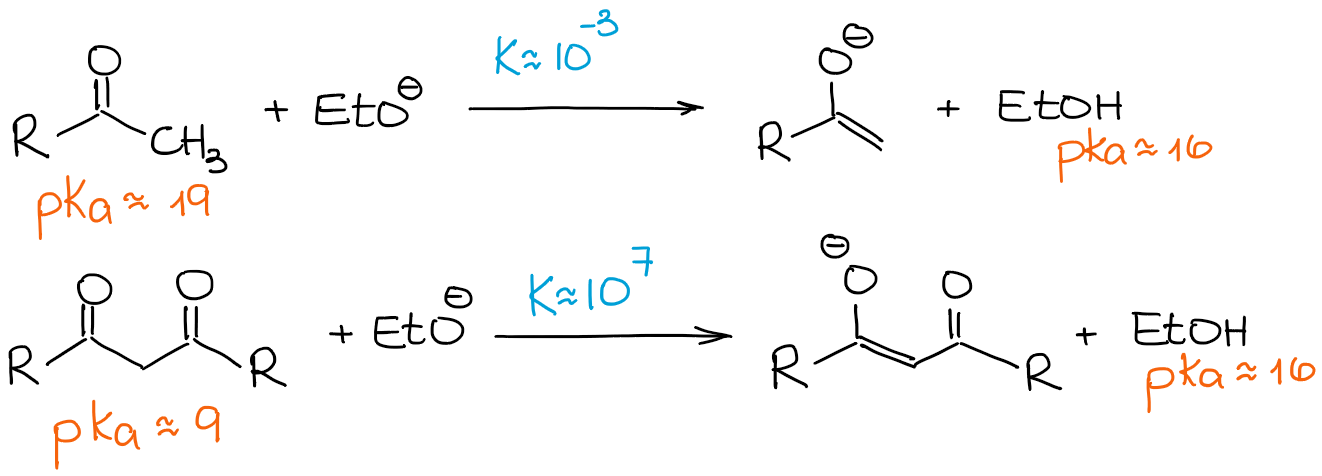
Desde a β-O dicarbonilo é muito mais ácido que um aldeído normal ou uma cetona, mesmo uma base fraca impulsiona o equilíbrio em direcção aos produtos dando 100% de enolização. Assim, vamos analisar qualquer reacção de enolização dos dicarbonilos β como um processo 100% enolado e 0% de material de partida, independentemente de uma base.
Porquê a Escolha de uma Base é Importante?
algumas reacções podem ser muito sensíveis ao que está na solução e quais são as concentrações dos reagentes. Por exemplo, os aldeídos são electrofílicos enquanto os enolatos são nucleofílicos. Assim, se estou a utilizar uma base fraca não-equilibérica que deixa muito do material inicial na solução, posso começar a ver uma reacção indesejável entre um enolado e um aldeído inicial. Geralmente, só vamos ver as fracas bases de equilíbrio utilizadas quando não vamos esperar muita concorrência entre os possíveis produtos. Se forem possíveis múltiplas reacções e nenhum produto principal dominar o equilíbrio, usaremos sempre bases fortes não equilibradas.
Bases Bulky vs Pequenas Bases
O tamanho de uma base pode ser um factor determinante no processo de enolização quando múltiplas posições enolizáveis numa molécula estão a competir. Vejamos a enolização da 2-metilbutanona por duas bases fortes:
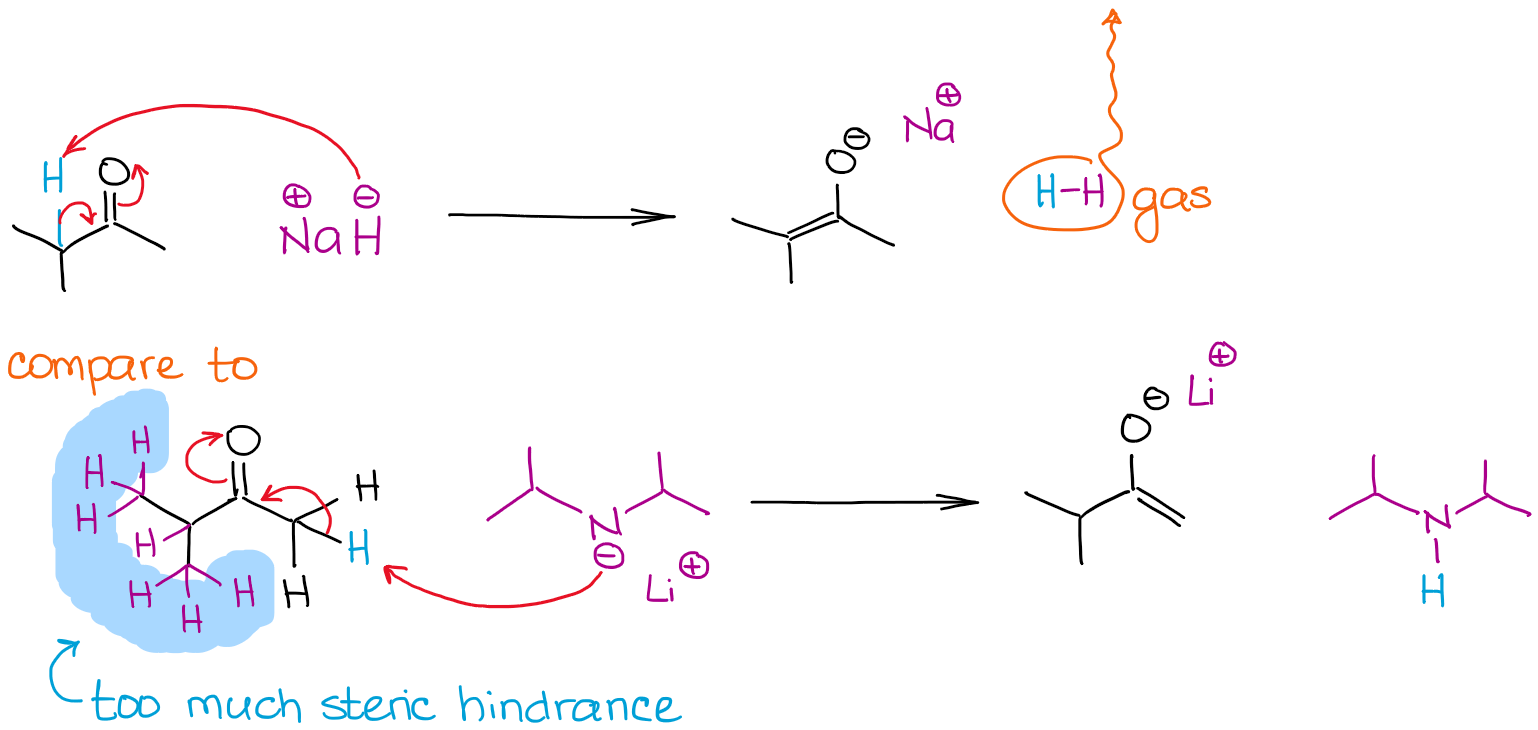
Todas as reacções dão 100% de enolização devido ao uso de bases não-equilibriantes muito fortes. No entanto, a reacção com hidreto de sódio (NaH) dá um enolato mais estável termodinamicamente. Ao contrário do LDA, o anião hidreto é muito pequeno para que possa facilmente alcançar um próton mais estéril e dar um enolato termodinâmico. O LDA é muito volumoso e por isso é muito sensível a quaisquer obstáculos estéreis. Isto significa, que irá atrás de hidrógenos menos esterelizados e mais acessíveis.
Damos ao enolado menos estável termodinamicamente como na reacção com LDA um enolado cinético. É também aqui que a ordem de adição de reagentes se torna relevante. Para obter um enolato cinético, deve-se sempre adicionar um carbonilo à base, e não o contrário! Alguns instrutores são exigentes em relação a isso, por isso tenha isso em mente.
Ensolados termodinâmicos versus cinéticos
Por agora já mencionei os enolados termodinâmicos e cinéticos algumas vezes, por isso penso que pode ser uma boa ideia rever esses em mais alguns detalhes.
O que conta exactamente para a estabilidade termodinâmica de um enolado?
Os maiores contribuidores de ressonância enolada têm uma carga negativa sobre o átomo de oxigénio e uma dupla ligação C=C.
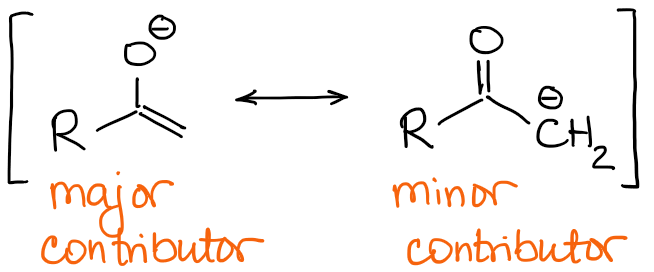
Assim, a natureza da dupla ligação será a principal diferença entre os enolados. Se olharmos para o exemplo com 2-methylbutanone de cima, podemos ver que os dois possíveis enolados têm uma dupla ligação qualitativamente diferente:

Procure sempre o número de substitutos na sua dupla ligação. Quanto mais substituintes tiver numa dupla ligação, mais estável ela é. Assim, o enolado termodinâmico terá sempre a dupla ligação mais ocupada.
Um enolado cinético é o que se forma mais rapidamente. Pense sobre a reacção com LDA. O LDA é uma base não-equilibrium muito forte. Assim que arranca o protão, não o vai devolver. É também uma base muito volumosa e não consegue agarrar um hidrogénio do meio da molécula. Por isso, vai atrás do que é mais estéreamente acessível. Assim, uma base como a LDA arranca um próton rapidamente, de um local menos estéril, e não o devolve ou permite o equilíbrio produzindo um enolado menos estável.
Por que é importante adicionar um carbonilo a uma base para fazer um enolado cinético?
Se quiser um enolado cinético, a sua base deve estar sempre em excesso. Os enolatos são eles próprios básicos! Portanto, se tiver um carbonilo em excesso, então o enolado pode rapidamente estabelecer um equilíbrio com ele.
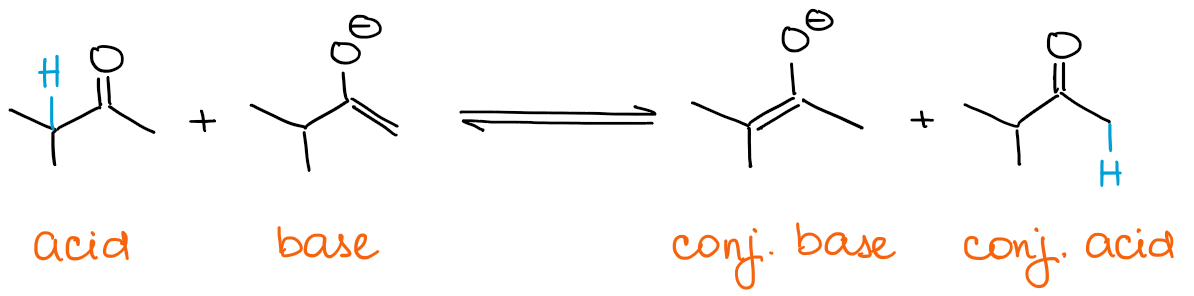
Any equilibrium irá sempre favorecer espécies mais estáveis termodinamicamente. Isto significa que terá sempre um enolato termodinâmico se tiver um excesso de carbonilo e não uma base.
Por isso, lembre-se que:
Bases fracas e pequenas e fortes = enolato termodinâmico
Bases fortes = enolato cinético
Utilizar esta simples regra de ouro ajudá-lo-á a determinar o enolato que vai ter ou que precisa de fazer na sua reacção.
Enolização catalizada com ácido
Logo no início deste post, mencionei que a enolização também é possível em condições ácidas. Uma vez que os aldeídos e as cetonas não são particularmente básicos, pretende-se utilizar um ácido muito forte para catalisar este processo. Tipicamente, utilizamos ácidos sulfúrico ou tosílico como catalizadores.
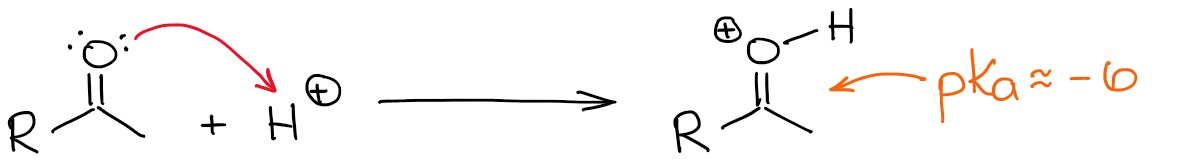
O hidrogénio mais ácido de um carbonilo protonado é, naturalmente, o do oxigénio. No entanto, fazer uma ligação C=O mais polarizada ao adicionar-lhe um protão, torna a posição α também mais ácida. Assim, é agora um pouco mais fácil desprotonificar a posição α e fazer um enol.
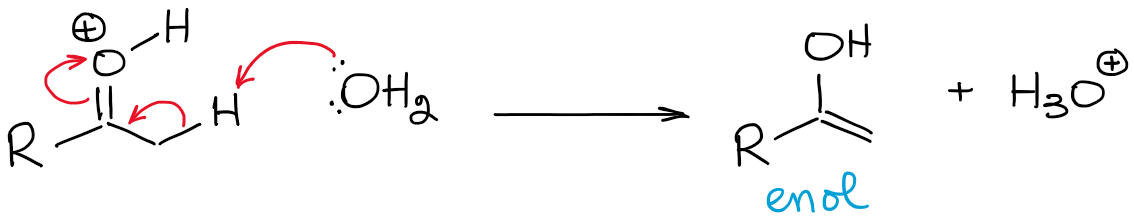
Este equilíbrio é extremamente desfavorável e favorece o carbonilo em geral. Assim, nunca terá uma concentração elevada de um enol em condições ácidas, a menos que haja algum tipo de efeito de estabilização que torne o enol favorável (raro).
Enquanto todos os produtos possíveis de enol podem ser produzidos, esta reacção favorecerá sempre a formação de um enol termodinâmico.
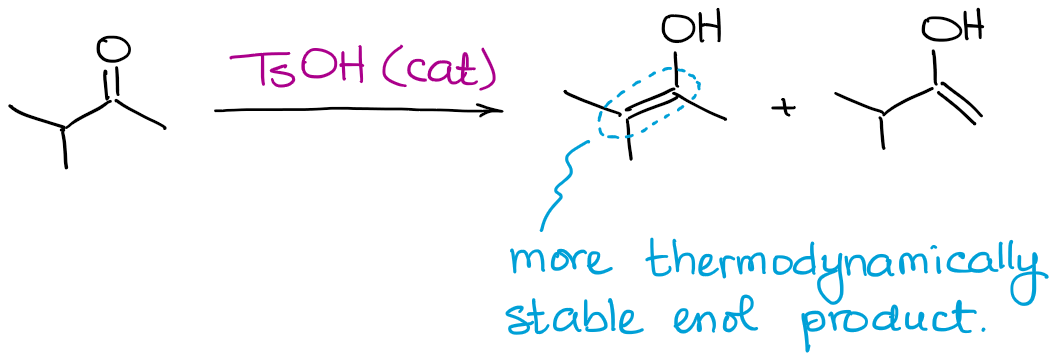
Apenas como no caso dos enolados, um enol termodinâmico é o que tem mais substitutos na dupla ligação.
Que factores influenciam a enolização catalisada por ácido?
Qualquer coisa que possa tornar um enol mais estável ajudará ao equilíbrio. Os factores mais comuns são a ligação de hidrogénio e a conjugação prolongada.
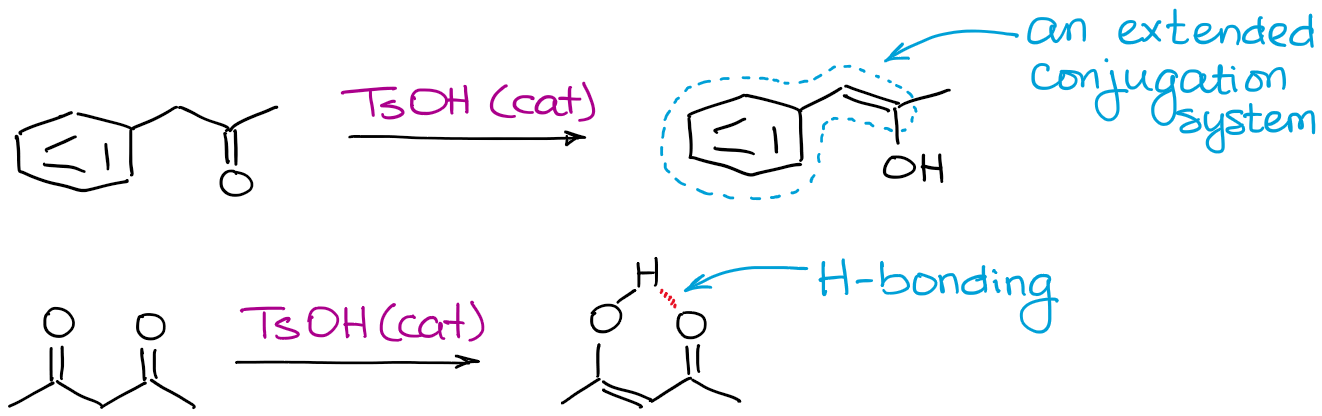
Porquê incomodar com ácido…enolização catalítica se houver tantos problemas com ela?
Seu composto pode ser sensível a bases. Além disso, pode ser mais fácil combinar múltiplos passos quando ocorrem nas mesmas condições. Combinamos frequentemente a enolização catalisada com outros passos numa reacção que também ocorre em condições ácidas.
Tem de ter em mente, no entanto, que os grupos de extracção de electrões nas proximidades de um carbonilo o tornarão ainda menos básico do que já é. Portanto, se tiver, digamos, um halogéneo na posição α, será realmente difícil forçar a formação de um enol.

Vigualmente verifique a existência de quaisquer EWG’s no α-posição antes de assumir qualquer formação enol! Qualquer EWG que não ofereça estabilização de ressonância à dupla ligação irá desfavorecer significativamente o processo de enolização.
O que esperar no Exame?
Professores raramente fazem perguntas especificamente dirigidas à formação de enolias ou enolias directamente. As perguntas de enolização serão sempre disfarçadas como algo diferente. As perguntas de enolização são tipicamente formuladas como:
- Encontrar o hidrogénio mais ácido na seguinte molécula… ou
- Desenhar o produto… (a reacção terá um enol ou um enolado como intermediário)
Obviamente, eles podem fazer uma pergunta directa. Contudo, na minha experiência, a tautomerização e as enolizações de keto-enol são geralmente o conceito subjacente que conduz a uma determinada questão.