h6>Proteína do Mês
Novembro de 2006
MAIS SOBRE ESTA PROTEÍNA DO MÊS |
|
OUTROS PROTEÍNOS DE INTERESSE |
|
Molécula do Mês: Fibrin |
|
ExPASy Protein Spotlight |
Bloodclotting, ou coagulação, é uma resposta rápida aos danos dos tecidos, onde a exposição do factor tecido contendo células à corrente sanguínea através de danos nas paredes dos vasos inicia um sistema rápido de cascatas. Esta cascata enzimática utiliza uma série de enzimas para trabalhar em sucessão rápida para amplificar uma pequena resposta num grande no local do dano (ver Figura 1). Uma vez activado, o factor de tecido (TF) liga-se e activa o factor VII(FVII), iniciando a cascata. TF/FVII é activado através da auto-pulverização para TF/FVIIa, que juntamente com o cofactorFVIIIa converte FIX para FIXa; FXa pode então converter FX para FXa, que juntamente com o cofactor FVa converte FII (protrombina) para FIIa (trombina); finalmente FIIaconverte fibrinogénio para fibrina, levando à deposição de fibrina e à activação de plaquetas para formar coágulos de sangue. A activação de FXIII a FXIIIa pode estabilizar estes coágulos de sangue através da ligação cruzada dos mesmos.
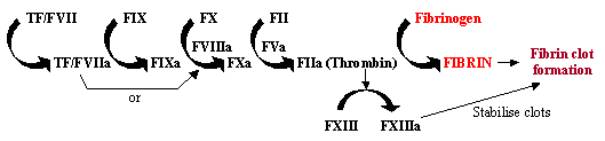
Figure 1. Cascata de Coagulação Sanguínea
Fibrinogénio,Acabando a Cascata de Coagulação
Fibrinogénio foi primeiramente isolado do plasma de cavalo por Hammarsten em 1876, embora um precursor inactivo da fibrina tenha sido proposto para existir já em 1859 por Deni deCommercy. O fibrinogénio pode sofrer uma transformação marcável de monómeros solúveis (fibrogénio) para um polimergel insolúvel (fibrina polimerizada).
Fibrinogénio é uma plasmaglicoproteína sintetizada no fígado que é essencial para a hemostasia (impedindo a perda de sangue dos tecidos danificados), cicatrização de feridas, fibrinólise, inflamação, angiogénese, interacções celulares e matriciais, andneoplasia. Estes processos envolvem a conversão do fibrinogénio em fibrina, e frequentemente a interacção de fibrina(ogen)com várias proteínas e células. As pessoas transportam normalmente cerca de 2,5g de fibrinogénio/L do sangue, contudo, as concentrações de offibrogénio podem aumentar até 200-400% durante períodos de stress fisiológico (principalmente devido à acção da interleucina-6 derivada do macrófago).
Fibrinogénio é uma glicoproteína grande e complexa composta por três pares de polipéptidos: dois Aa, dois Bb,e dois g. Estes polipéptidos estão ligados entre si por 29 ligações de bissulfureto, algumas das quais estão representadas na Figura 2 abaixo. Os polipeptídeos são orientados de modo a que todos os seis terminais N se encontrem para formar o domínio E central. Duas regiões de hélices alfa de bobinas enroladas estendem-se de ambos os lados do domínio E, cada uma constituída por um Aa, um Bb e um gpolypeptide. Cada região de bobinas enroladas termina num domínio globular D que consiste nas extremidades terminais C de Bb e g,bem como parte de Aa. A extremidade terminal C de Aa sobressai então de cada domínio D como uma longstrand; estas protuberâncias Aa podem interagir umas com as outras e com o domínio E durante a ligação fibrino-cruzada. Tanto o domínio E como o domínio D contêm sítios de ligação importantes para a conversão do fibrinogénio em fibrina, para a montagem e ligação cruzada de fibrina, e para a agregação de plaquetas. Os iões de cálcio ligados são importantes para ajudar a manter a estrutura do fibrinogénio.
Os N-terminais dos polipéptidos Aa e Bb são clivados por trombina para transformar o fibrinogénio solúvel em fibrina formadora de gel. Uma vez clivados do fibrinogénio, os N-terminalends são conhecidos como fibrinopeptídeo A (de Aapolypeptide) e fibrinopeptídeo B (de Bbpolypeptide).
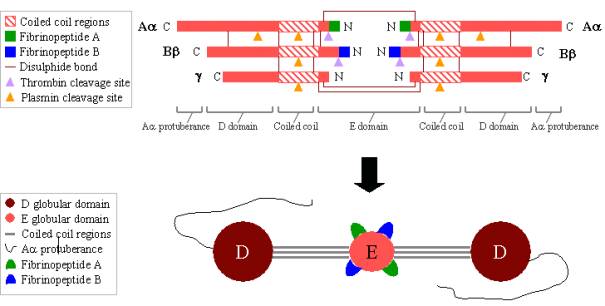
br>
Figure 2. Fibrinogen:
TOP – organização polipéptica do fibrinogen.
BOTTOM – organização do domínio do fibrinogen.
h2>BloodClot Formation
Para toformar um coágulo de sangue, o fibrinogénio deve ser primeiro clivado por trombina para remover os fibrinopéptidos. A remoção dos offibrinopeptídeos A e B das extremidades N-terminais de Aa e Bb expõe ‘knobs’ no domínio E, que podem interagir com os ‘buracos’ sempre presentes nos Ddomínios. As moléculas de fibrina podem ligar-se através da interacção do domínio E numa molécula de fibrina com os domíniosD em quatro outras moléculas de fibrina, polimerizando-se assim em oligómeros formados que se acumulam em protofibrils. À medida que os oligómeros de fibrina se agregam, estes protofibrils continuam a alongar-se para fazer fibras longas que se podem enrolar umas em torno das outras para fazer feixes multi-fibras, e que podem ramificar-se numa rede de 3-dimencionais de emaranhados de fibras, o coágulo de fibrina. O coágulo de fibrina é então estabilizado pelo Factor XIIIa, uma transglutaminase, onde a zymogenform do Factor XIII é convertida no Factor XIIIa activo através da acção da trombina (ver Figura 1). O Factor XIIIacross liga resíduos de glutamina numa molécula de fibrina aos resíduos de lisina numa outra molécula de fibrina, formando fortes ligações de isopeptídeos. Esta ligação cruzada ocorre entre as pontas terminais C (Aa protuberâncias) dos polipéptidos Aa, bem como (mais raramente) noutros locais, tais como entre as pontas terminais C das cadeias g. Estas ligações cruzadas ajudam a fortalecer o coágulo de fibrina, tornando-o mais resistente a danos físicos e químicos.
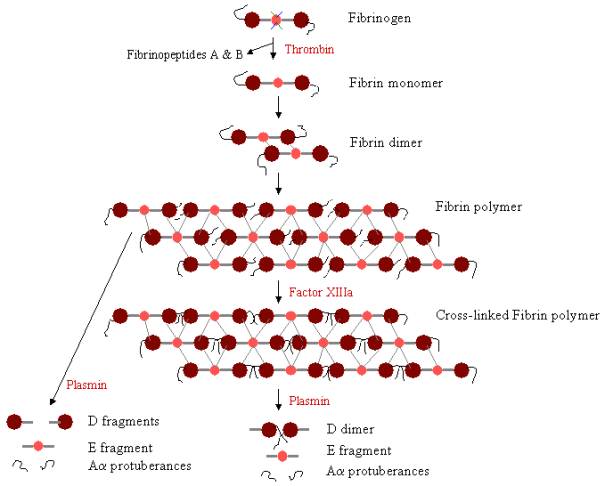
Figure 3. Fibrin Polimerização e lise: Percurso de polimerização e ruptura da fibrina. Os botões no domínio E ligam-se aos buracos em até quatro domínios D (linhas cinzentas), formando uma treliça longa e fibrosa. O coágulo é então estabilizado através de reticulação. O coágulo pode ser degradado, produzindo diferentes produtos de degradação se tiver sido reticulado.