US Pharm. 2013;38(2):HS2-HS8.
ABSTRACT: A insuficiência cardíaca aguda descompensada(ADHF), uma exacerbação da insuficiência cardíaca crónica, pulmonar, e/ou renaldysfunction, é responsável pela maior parte dos 39 mil milhões de dólares gastos em insuficiência cardíaca crónica. A farmacoterapia da ADHF não mudou recentemente, mas os estudos indicaram que a maior parte da terapia é eficientemente, embora noteconomicamente, equivalente. A farmacoterapia baseada em provas e em internamento é orientada pela compreensão dos subconjuntos hemodinâmicos de Forrester e da sua patofisiologia. O sucesso clínico depende não só do tratamento hospitalar adequado, mas também da utilização de uma equipa de alta. Os farmacêuticos podem colmatar a lacuna entre as visitas hospitalares e os cuidados ambulatórios recomendando e proporcionando a continuidade dos cuidados.
Em 2010, o custo do tratamento da insuficiência cardíaca (IC) nos Estados Unidos foi estimado em 39,2 mil milhões de dólares.1,2Cerca de 1 milhão de pacientes são hospitalizados todos os anos por exacerbações, e a IC é actualmente a razão mais comum de internamento hospitalar em adultos com mais de 65 anos de idade.2 A insuficiência cardíaca aguda descompensada (FAA) pode resultar de insuficiência cardíaca crónica, mal controlada e/ou disfunção cardíaca, pulmonar, ou renal. O custo de hospitalização destes pacientes é extremamente elevado, representando cerca de 60% das despesas totais de IC.3
Além do impacto financeiro da IC, a longevidade e a qualidade de vida são gravemente afectadas em pacientes com crises agudas. A admissão hospitalar está associada a um aumento do risco de mortalidade em doentes com IC; a mortalidade ocorre em 15,5% dos doentes, e um terço dos doentes nunca tem alta do hospital.2 A TDAH é uma doença paralisante que sobrecarrega não só os doentes, mas também o sistema de saúde.
A farmacoterapia TDAH é um campo de batalha para os hospitais que procuram controlar os custos numa era de redução de pagamentos e aumento de despesas. Em Outubro de 2012, os Centros de Medicare e Medicaid (CMS) começaram a cortar os reembolsos aos hospitais com elevadas taxas de doentes em três estados de doença de alto custo: enfarte do miocárdio (IM), pneumonia, e HF. Se os pacientes com estas condições forem readmitidos no prazo de 30 dias, o CMS reduzirá o reembolso base total em1% anualmente, até uma redução máxima de 3% até 2014.4 Em breve, as perdas financeiras motivarão os quase 2.000 hospitais que sofrem as maiores penalizações a instituir novas políticas e cuidados de acompanhamento para os pacientes que recebem alta com um diagnóstico de HF.
Felizmente, uma análise de 2011 feita pelo CMS mostrou que a taxa de admissões de HF tinha realmente diminuído ao longo de um período de 10 anos.1 Em 2008, houve menos 229.000 admissões do que o esperado, dadas as tendências observadas nas últimas décadas.1,5 Os investigadores atribuíram este declínio à “redução da incidência de doenças das artérias coronárias, melhor controlo da pressão arterial, maior utilização de terapias baseadas em provas, e possivelmente alterações nos limiares de admissão”. A taxa de mortalidade por todas as causas durante 1 ano, contudo, manteve-se elevada em cerca de 30% para pacientes hospitalizados devido a HF.1,5 Os homens negros e certas regiões do país tiveram piores taxas de hospitalização; os investigadores colocaram a hipótese de que as diferenças de inacessibilidade ou qualidade dos cuidados poderiam contribuir para esta disparidade.1 Os melhores resultados (custos reduzidos e taxas de readmissão) são vistos com uma abordagem amultidisciplinar que inclui médicos, farmacêuticos, enfermeiros, nutricionistas, e fisioterapeutas.6 Este artigo é uma breve revisão da farmacoterapia ADHF com um olhar adicional sobre as considerações farmacoeconómicas e as controvérsias de alta.
Patofisiologia
ADHF é definido como um agravamento súbito dos sintomas de IC e é geralmente causado por edema pulmonar cardiogénico com rápida fluidacumulação nos pulmões, embora possa ocorrer sem edema pulmonar.7 A hipertensão, a isquemia e/ou a função ventriculardisfunção causam uma diminuição do débito cardíaco, o que leva a uma activação da via neuro-hormonal. O sistema simpático aumenta a norepinefrina para melhorar a perfusão periférica viavasoconstrição e activa o sistema renina-angiotensina-aldosterona para aumentar a perfusão renal através da retenção de água.8 O aumento anacute da pressão de enchimento ventricular esquerdo causa a fuga de proteínas-poorfluido para os alvéolos pulmonares e interstitio, mas não ocorre qualquer comprometimento da integridade da membrana pulmonar. Os mecanismos compensatórios aumentam a taxa de coração e a resistência vascular sistémica numa tentativa de melhorar o débito cardíaco, e segue-se um ciclo vicioso.7,8
As causas comuns de TDAH incluem disfunção ordiastólica do ventrículo esquerdo com ou sem doença arterial coronária (DAC) ou anomalias orvalvulares. Embora a maioria dos pacientes hospitalizados com TDAH tenham um agravamento da TDAH pré-existente, até 20% dos pacientes não têm priordiagnóstico de TDAH.9
TDAH também pode ocorrer em pacientes sem qualquer doença cardíaca pré-existente, incluindo condições tais como hipertensão grave, sobrecarga de fluidos, doença renal grave, ou estenose da artéria renal. A ocorrência de um evento que provoca uma alteração no fluxo de sangue através do coração; a TDAH pode ser induzida por crise hipertensiva, IM ou isquemia, obstrução atrial, regurgitação mitral aguda, sobrecarga de fluidos, ornonadência a medicamentos para a IC. Certos medicamentos, tais como os beta-bloqueadores, bloqueadores dos canais de cálcio não dihidropiridínicos, e anti-inflamatórios não-esteróides (AINEs), também podem precipitar a ADHF.7,10
 br>>>/p>
br>>>/p>
Classificação
ADHF pode ser categorizada em fases hemodinâmicas dependendo do índice cardíaco e da pressão da cunha capilar pulmonar. As fases são classificadas como os subconjuntos hemodinâmicos Forrester (TABELA 1).11 O índice cardíaco (IC) indica o grau de perfusão; os pacientes são caracterizados como “quentes” ou “frios”, dependendo da presença dehypoperfusion. Um IC de <2,2 L/min/m2 garante uma classificação de “frio”, indicando hipoperfusão. Sinais e sintomas consistentes com a hipoperfusão incluem fadiga, hipotensão, coolextremities, diminuição da função renal, e alteração do estado mental. A pressão da cunha capilar pulmonar (PCWP) indica o estado do fluido; os pacientes são classificados como “secos” ou “molhados” dependendo da presença de edema, que é definido como PCWP >18 mmHg. Os sinais e sintomas de sobrecarga de volume incluem tosse, dispneia, nocturnaldispneia paroxística, pressão venosa jugular elevada, edema periférico, ascite, hepatomegalia e esplenomegalia.
A apresentação mais comum, que constitui dois terços das admissões de ADHF, é o subconjunto II (quente e húmido).8 Em comparação com o subconjunto I (quente e seco), o subconjunto IV (frio e húmido) aumenta a taxa de mortalidade em duas vezes e meia.12Três parâmetros laboratoriais fundamentais indicam um risco acrescido de hospitalidade de acordo com o ensaio Acute Decompensated Heart Failure NationalRegistry (ADHERE): um nitrogénio ureico no sangue de ≥43 g/dL, pressão sistólica no sangue <115 mmHg, e/ou creatinina sérica >2,75 mg/dL.13
Farmacoterapia
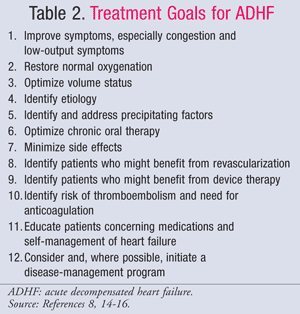
A gestão farmacológica da TDAH é orientada pelo estado hemodinâmico do paciente, que é avaliado utilizando valores de IC e PCWP (TABELA 1).11 Os objectivos e medicamentos para o tratamento da TDAH estão resumidos nas TABELAS 2 e 3,8,14-16Embora o padrão de cuidados não tenha mudado significativamente ao longo dos anos passados, um novo enfoque sobre o impacto farmacoeconómico da TDAH mostrou que nem todos os tratamentos são iguais. A farmacoterapia deve tornar-se baseada no subconjunto diagnosticado, quer tratando a sobrecarga de fluidos, quer a hipoperfusão. Os pacientes do subconjunto IV são classificados como tendo simultaneamente sobrecarga de fluidos e disfunção de perfusão e, portanto, requerem terapia para ambos os sintomas.
Subset II ou IV-Wet: Os diuréticos intravenosos (IV)loop diuretics são a base do tratamento de ADHF para pacientes com sobrecarga de fluidos (PCWP >18 mmHg), apesar dos dados contraditórios relativos ao benefício da mortalidade e morbilidade. Uma meta-análise de 14 pequenos ensaios mostrou uma diminuição da mortalidade e hospitalizações de doentes tratados indiuréticos17; contudo, uma análise recente dos dados observacionais do ensaio ADHERE mostrou que os doentes hospitalizados tratados com diuréticos intravenosos tinham um período de internamento global mais longo e um período de internamento na UCI mais longo.18 Independentemente disso, a actualização de 2009 das directrizes do American College of Cardiology/American HeartAssociation (ACC/AHA) para o tratamento da insuficiência cardíaca recomenda a administração precoce de diuréticos intravenosos.14 As doses de Bolus de diuréticos em laço são preferíveis. A furosemida é mais comummente utilizada; no entanto, a bumetanida e a torsemida são igualmente eficazes. Se os doentes tiverem uma resposta inadequada à dose máxima recomendada de bolus de uma loopdiurética, a infusão contínua de furosemida pode ser iniciada a 5 mg/h e, se necessário, ser estimulada a 20 mg/h.14
A superioridade da administração de furosemida como infusão contínua ainda não foi estabelecida; o ensaio DOSE (Diuretic Optimization StrategiesEvaluation), que estudou 308 doentes hospitalizadosrandomizados para receberem ou bolus ou furosemida intravenosa, não mostrou uma diferença tão significativa entre os parâmetros de segurança e eficácia, mas estudos mais modestos indicaram um pequeno aumento do débito urinário com infusão contínua.19 Os efeitos não geridos da diurese rápida, tais como desequilíbrios electrolíticos e disfunção renal, podem levar a uma hospitalização prolongada para além da resolução dos sintomas de ADHF, soelectrolitos e creatinina sérica devem ser monitorizados frequentemente.
Outra estratégia para aumentar a diurese é adicionar uma segunda diurética com um mecanismo de acção diferente, tal como a metolazona ou a espironolactona. A metolazona, um diurético semelhante à tiazida, é utilizada com maior frequência para o controlo do volume agudo; contudo, a espironolactona e os antagonistas de outrasaldosteronas são preferidos na terapia de insuficiência cardíaca crónica.20-22
Em doentes com hipertensão contínua e/ou sintomas persistentes, apesar de uma diurese agressiva, pode ser adicionado um vasodilatador para toreduzir a congestão pulmonar. Nitroprussiato de sódio, nesiritide, e IVnitroglicerina são vasodilatadores venosos que aliviam rapidamente os sintomas congestivos através da redução do PCWP. Se um paciente apresenta baixo débito cardíaco e alta resistência vascular sistémica, recomenda-se vasodilatadores venosos ou inotropesares, embora os vasodilatadores sejam a terapia preferida. Devido ao risco de toxicidade por cianeto devido a infusões de nitroprussiato prolongadas e altas doses, os vasodilatadores preferidos são nesiritide e nitroglicerina. Dos dois, o nesiritideo produziu uma maior melhoria do estado clínico inglês sobre a nitroglicerina na vasodilatação no ensaio de gestão da insuficiência cardíaca congestiva aguda (VMAC), apesar da propensão da droga para causar hipotensão.13 Portanto, o nesiritide é o agente preferido num paciente com sobrecarga de fluidos e baixo débito cardíaco.
A utilidade do nesiride foi questionada devido ao seu elevado custo de aquisição.23 Faltam dados clínicos sobre os resultados, mas um modelo farmacoeconómico mostra que o elevado custo inicial do nesiritide é compensado pela menor taxa de readmissão hospitalar no prazo de 21 dias quando comparado com os pacientes que receberam dobutamina.24 Da mesma forma, uma análise retrospectiva dos dados de ADHERE mostrou que os pacientes tratados com nitroglicerina ou nesiritide foram dispensados do hospital mais cedo do que os pacientes tratados com dobutamina ou milrinone e também tinham um menor risco de morte.13 Uma vez que foram tratados mais pacientes gravemente doentes, é difícil atribuir a incidência de aumento da mortalidade à droga.
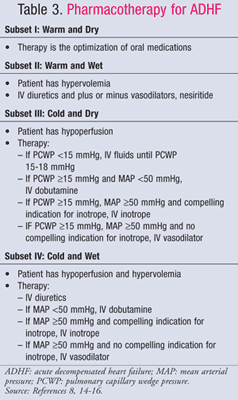
Subset III ou IV-Frio: Dobutamina e milrinona são as inotropos de escolha para aumentar a perfusão e preservar a perfusão de órgãos finais em pacientes com diminuição do débito cardíaco. As indicações convincentes para inotropos incluem pressão arterial sistólica<90 mmHg, hipotensão sintomática apesar de pressões de enchimento adequadas (PCWP 15-18 mmHg), agravamento da função renal, ou resposta inadequada aos vasodilatadores IV. A selecção prudente de doentes é necessária porque os resultados pobres ocorrem quando os inotrópicos são dados a doentes com débito cardíaco preservado. O ensaio OPTIME-CHF mostrou um aumento não significativo da mortalidade e das arritmias quando foram dadas infusões de milrinone aos doentes como parte dos cuidados padrão.25 Os milrinones devem ser escolhidos para tratar doentes que recebem beta-bloqueadores concomitantes, uma vez que exercem um efeito sobre o débito cardíaco e a resistência vascular sistémica através da inibição da fosfodiesterase, enquanto que a dobutamina é um agonista abeta1. A dobutamina, contudo, é a melhor escolha para pacientes hipotensos, uma vez que a milrinona pode causar quedas significativas na pressão sanguínea.15
Planeamento da descarga
A etapa final no tratamento da ADHF é o planeamento e acompanhamento da descarga. Tanto as directrizes da ACC/AHA como as da Sociedade de Insuficiência Cardíaca da América (HFSA) defendem a importância de um planeamento adequado da descarga.14,15 As principais etapas dos cuidados de descarga baseados em evidências incluem o tratamento de factores agravantes, tais como a descontinuidade dos bloqueadores dos canais de cálcio não dihidropiridínicos ou AINEs, a obtenção de um estado de volume ideal, a optimização da terapia farmacológica e a transição para a terapia oral ambulatorial (QUADRO 4).15 As linhas de orientação ACC/AHA recomendam que sejam dadas instruções escritas ou material educativo aos pacientes e/ou prestadores de cuidados na alta, abordando o seguinte: nível de actividade, dieta, medicamentos de descarga, consulta de acompanhamento, controlo de peso e o que fazer se os sintomas piorarem.14As orientações também indicam o benefício de iniciar a terapia de redução da mortalidade para a IC durante a admissão hospitalar, tais como inibidores da enzima de conversão da angiotensina (ECA) e beta-bloqueadores. Estudos mostram que os cuidados baseados em orientações diminuem a mortalidade,26 mas não mostram redução nas taxas de readmissão para pacientes com IC.27,28
 br>>
br>>
Apoio à descarga, ou gestão de casos hospitalares, está a ser utilizado para o planeamento da descarga. O apoio à alta é uma abordagem amultidisciplinar, baseada em equipas, que trata do apoio à medicação, educação do paciente, planeamento de acompanhamento e coordenação de informação. Uma meta-análise de 18 ensaios randomizados e controlados (RCT) analisando o planeamento da alta com apoio pós-descarga envolvendo 3.304 doentes, encontrou uma redução significativa das readmissões por inalação (risco relativo 0,75, 95% CI 0,68-0,88).29 A validade externa da meta-análise é difícil de determinar, mas pode oferecer algumas estratégias rentáveis. Uma estratégia é de 223 pacientes com HF que comparou o apoio tradicional à alta com os materiais de ensino de uma hora, um a um, com um educador de enfermagem antes da alta.30 O grupo de intervenção da enfermeira teve riscos mais baixos de re-hospitalização ou morte 180 dias após a alta e foi estimado em poupar 2.823 dólares por paciente. Pelo contrário, estudos observacionais em larga escala não encontraram qualquer relação entre pacientes que receberam materiais educativos e diminuíram as taxas de readmissão.26,31 As actuais directrizes ACC/AHA não declaram explicitamente como dar alta a pacientes após a TDAH, a não ser através da entrega de materiais educativos.14 As recomendações das directrizes podem não fornecer procedimentos de alta que ajudem os hospitais a cumprir as expectativas do CMS.
Embora os materiais educativos na alta não tenham demonstrado benefícios de amortalidade, cada agente oral adicional utilizado para o tratamento de PHF, como um beta-bloqueador ou antagonista da aldosterona, pode desrazoospitalizações e/ou mortalidade de 25% a 35%. As directrizes do ACC/AHA indicam que muitos doentes com IC são dispensados antes de se atingir o volume ideal ou enviados para casa sem o benefício de terapias que salvam vidas, o que perpetua a rápida readmissão de tais doentes.14 Um farmacêutico hospitalar deve ser um defensor dos doentes da equipa de apoio à descarga, ajudando na reconciliação de medicamentos, descontinuando medicamentos contra-indicados e recomendando a farmacoterapia de IC baseada em eventos. Os medicamentos devem ser iniciados o mais possível, idealmente no ambiente hospitalar; o início destes medicamentos pode exacerbar os sintomas de IC precipitando a TDAH, o que realça ainda mais a importância de um acompanhamento atempado para esta população de doentes.
Conclusão
ADHF é um fardo para os doentes, prestadores de cuidados de saúde, e para os pagadores. A farmacoterapia para ADHF não mudou recentemente, mas a utilização de equipas de apoio à alta e o rápido acompanhamento após a alta proporcionam oportunidades de intervenção do farmacêutico, tanto dentro como fora do hospital. Os farmacêuticos comunitários podem desempenhar um papel importante na continuidade dos cuidados, ajudando os pacientes em transição dos cuidados primários do hospital. Os farmacêuticos estão preparados para oferecer recomendações adequadas baseadas em directrizes, ajudar na reconciliação de medicamentos e proporcionar educação sobre a alta de medicamentos. Com as recentes mudanças no reembolso do CMS,os farmacêuticos precisam de assumir um papel maior no tratamento desta doença crónica.
1. Winslow R, Wang SS. A insuficiência cardíaca coloca menos no hospital. Wall Street Journal. 19 de Outubro, 2011. http://online.wsj.com/article/SB10001424052970203658804576639360226103584.html. Acedido a 1 de Setembro de 2012.
2. Lloyd-Jones D, Adams RJ, Brown TM, et al. Actualização das estatísticas de doenças cardíacas e acidentes vasculares cerebrais-2010. Um relatório da American HeartAssociation. Circulação. 2010;121:e46-e215.
3. Michota FA Jr, Amin A. Colmatar a lacuna entre a evidência e a prática na gestão da insuficiência cardíaca descompensada aguda. J Hospital Med. 2008;3(suppl):S7-S15.
4. Rau J. Medicare para penalizar 2.217 hospitais por excesso de readmissões. Kaiser Health News.August 13, 2012.www.kaiserhealthnews.org/Stories/2012/August/13/medicare-hospitals-readmissions-penalties.aspx.Accessed 1 de Setembro, 2012.
5. Chen J, Normand ST, Wang Y, Krumholz HM. Tendências nacionais e regionais na hospitalização por insuficiência cardíaca e taxas de mortalidade para beneficiários de cuidados médicos, 1998-2008. JAMA. 2011;306:1669-1678.
6. Amin A. Quem está a gerir a insuficiência cardíaca descompensada aguda? A necessidade de uma abordagem multidisciplinar. J Hospital Med. 2008;6(suppl):S1-S6.
7. Pinto DS, Lewis S. Pathophysiology of acute decompensated heart failure. In: Basow DS, ed. UpToDate. Waltham, MA: UpToDate; 2012.
8. Crouch MA, Didomenico RJ, Rodgers JE. Aplicando directrizes de consenso na gestão da insuficiência cardíaca aguda descompensada. Programa ACPE #204-000-06-407-H01. Bethesda, MD: ASHP Advantage;2007.
9. Joseph SM, Cedars AM, Ewald GA, et al. Insuficiência cardíaca descompensada aguda: gestão médica contemporânea. Tex Heart Inst J. 2009;36:510-520.
10. Pinto DS, Lewis S. Avaliação da insuficiência cardíaca aguda descompensada. In: Basow DS, ed. UpToDate. Waltham, MA: UpToDate; 2012.
11. Forrester JS, Diamond G, Chatterjee K, et al. Medicaltherapy of acute myocardial infarction by application of hemodynamicsubsets. N Engl J Med. 1976;295:1356-1362.
12. Nohria A, Mielniczuk LM, Stevenson LW. Avaliação e monitorização de doentes com síndromes de insuficiência cardíaca aguda. Am J Cardiol. 2005;96:32G-40G.
13. Abraham WT, Adams KF, Fonarow GC, et al. In-hospitalmortality in patients with acute decompensated heart failure requiringintravenous vasoactive medications: an analysis from the AcuteDecompensated Heart Failure National Registry (ADHERE). J Am Coll Cardiol. 2005;46:57-64.
14. Hunt SA, Abraham WT, Chin MH, et al. 2009 focalizou a actualização incorporada nas directrizes ACC/AHA 2005 para o diagnóstico e gestão da insuficiência cardíaca em adultos: um relatório da AmericanCollege of Cardiology Foundation/American Heart Association Task Forceon Practice Guidelines. Circulação. 2009;119;e391-e479.
15. Sociedade Americana para a Insuficiência Cardíaca. Avaliação e gestão de doentes com insuficiência cardíaca descompensada aguda: HFSA 2010-directriz prática compreensiva sobre insuficiência cardíaca. J Falha do Cartão. 2010;16:e134-e156.
16. Colucci W. Tratamento da insuficiência cardíaca aguda descompensada: Componentes da terapia. In: Basow DS, ed. UpToDate. Waltham, MA: UpToDate; 2012.
17. Faris R, Flather MD, Purcell H, et al. Diuréticos para insuficiência cardíaca. Cochrane Database Syst Rev. 2012;(1):CD003838.
18. Gheorghiade M, Filippatos G. Reassessing treatment of acute heart failure syndromes: the ADHERE registration. Eur Heart J. 2005;7:813-819.
19. Felker GM, Lee KL, Bull DA, et al. Estratégias diuréticas em doentes com insuficiência cardíaca aguda descompensada. N Engl J Med. 2011;364:797-805.
20. Eficácia da espironolactona adicionada ao inibidor da enzima conversora da anangiotensina e um diurético de laço para insuficiência cardíaca congestiva severa (o Randomized Aldactone EvaluationStudy ). Am J Cardiol. 1996;78:902-907.
21. Pitt B, Remme W, Zannad F, et al. Eplerenone, bloqueador aldosterona asselectivo, em doentes com função ventricular esquerda após enfarte do miocárdio. N Engl J Med. 2003;348:1309-1321.
22. Zannad F, McMurray JJ, Krum H, et al; EMPHASIS-HFStudy Group. Eplerenona em doentes com insuficiência cardíaca sistólica e sintomas ligeiros. N Engl J Med. 2011;364:11-21.
23. Gerhard T, Zineh I, Winterstein AG, Hartzema AG.Pharmacoeconomic modeling of nesiritide versus dobutamina fordecompensted heart failure. Farmacoterapia. 2006;26:34-43.
24. Lissovoy G, Stier DM, Ciesla G, et al. Economicimplications of nesiritide versus dobutamine in the treatment ofpatients with acutely decompensated congestive heart failure. Am J Cardiol. 2003;92:631-633.
25. Cuffe MS, Califf RM, Adams KF Jr, et al. Short-termintravenous milrinone for acute exacerbation of heart failure: arandomized controlled trial. JAMA. 2002;287:1541-1547.
26. Kfoury AG, French TK, Horne BD, et al. Incrementalsurvival benefit with adherence to standardized heart failure coremeasures: um estudo de avaliação de desempenho de 2958 pacientes. Cartão J Falha. 2008;14:95-102.
27. Patterson ME, Hernandez AF, Hammill BG, et al. Processof care performance measures and long-term outcomes in patientshospitalized with heart failure. Cuidados médicos. 2010;48:210.
28. Fonarow GC, Abraham WT, Albert NM, et al. Associação entre medidas de desempenho e resultados clínicos em pacientes hospitalizados com insuficiência cardíaca. JAMA. 2007;297:61-70.
29. Phillips CO, Wright SM, Kern DE, et al. Comprehensivedischarge planning with postdischarge support for older patients withcongestive heart failure: a meta-analysis. JAMA. 2004;291:1358-1367.
30. Koelling TM, Johnson ML, Cody RJ, Aaronson KD.Discharge education melhora os resultados clínicos em pacientes com insuficiência cardíaca crónica. Circulação. 2005;111:179-185.
31. Jha AK, Orav EJ, Epstein AM. Relatório público do planeamento da descarga e taxas de readmissões. N Engl J Med. 2009;361:2637-2645.