Síntese, Nomenclatura, e Propriedades do Grupo Funcional Amide
Neste post, tentaremos fornecer uma ampla visão geral das amidas. Daremos uma breve visão geral da nomenclatura amida, duas propriedades importantes de amidas que diferem muito das aminas, e passaremos por três estratégias chave para a síntese amida.
Tabela de conteúdos
- Nomenclatura do Grupo Funcional Amida: Amidas primárias, secundárias e terciárias
- Síntese de Amidas, Parte 1. Substituição de Acilídeos Nucleófilos (ou Anidridos) por Aminas
- Notas
li>Amidas vs Aminas: Menos Básico, Mais Ácido
Síntese de Amidas, Parte 2: Hidrólise Parcial de NitrilosSí>Síntese de Amidas, Parte 3: Uso de um Reagente Desidratante (como DCC)li>Síntese de Amidas, Parte 3: Três Métodos Eficazes para a Síntese de Amidasli>Deixe-nos Considerar Brevemente um Quarto Método, Menos Importante: Força Bruta
li>Quiz Yourself!li>(Advanced) References and Further Reading
1. Nomenclature of The Amide Functional Group: Amidas primárias, secundárias e terciárias
“Amidas” são o que chamamos uma amina que tem um único grupo carbonilo anexado. O grupo funcional amida é para aminas como ésteres são para álcoois.
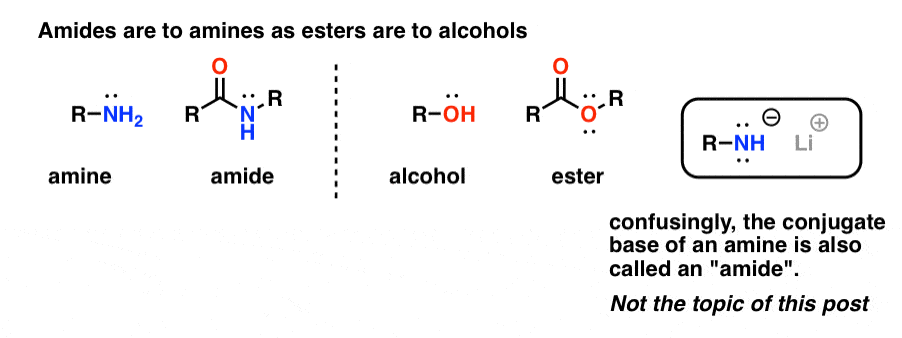
Confusivamente, a palavra “amida” é também usada para se referir à base conjugada de aminas, tais como amida de sódio (NaNH2) e di-isopropilamida de lítio (LDA). Estas últimas são por vezes diferenciadas, referindo-se a elas como “bases amida”. Outras utilizam pronúncias ligeiramente diferentes para diferenciar as duas (ayyy-myde e aaah-midd). Como com qualquer outro homónimo, a chave é contexto.
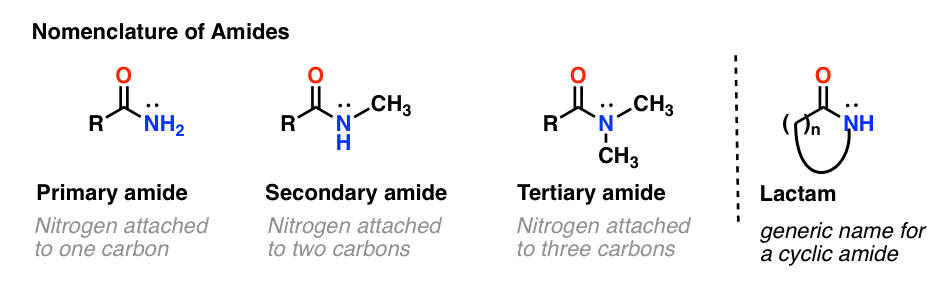
As com aminas, a nomenclatura usada para uma amida depende do número de carbonos ligados ao azoto.
Uma amida primária (1°) tem o azoto ligado a um único carbono; uma amida secundária (2°) tem o azoto ligado a dois carbonos; uma amida terciária (3°) tem o azoto ligado a três carbonos. Uma amida cíclica é chamada lactam.
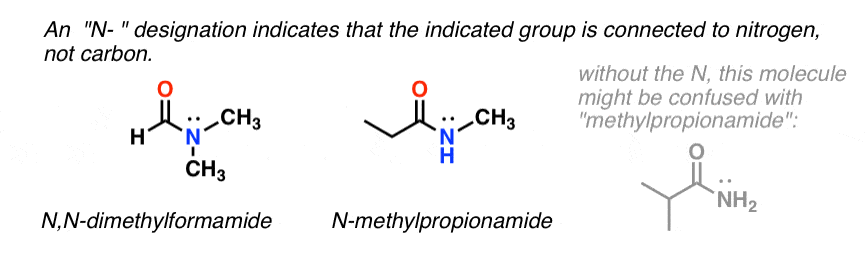
Quando a amida nitrogénio tem outros substitutos que não o hidrogénio, especificamo-los usando o prefixo N- para evitar confusão. Por exemplo, N-metilpropionamida especifica a fixação de um grupo metilo sobre o azoto; sem o prefixo N-, poder-se-ia assumir que o grupo metilo estava ligado ao carbono, que seria uma molécula totalmente diferente.
Amidas vs Aminas: Less Basic, More Acidic
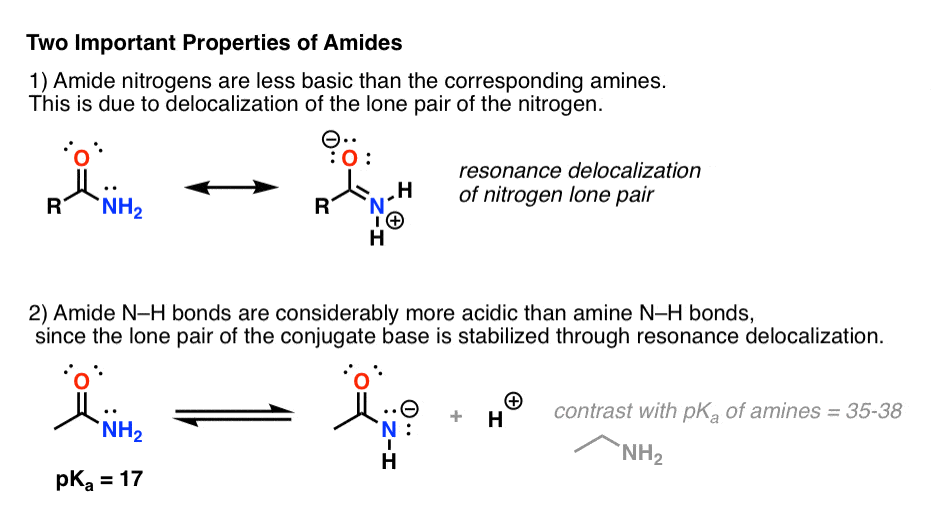
Attaching a carbonyl group to an amine has two drastic effects on the properties of the nitrogen.
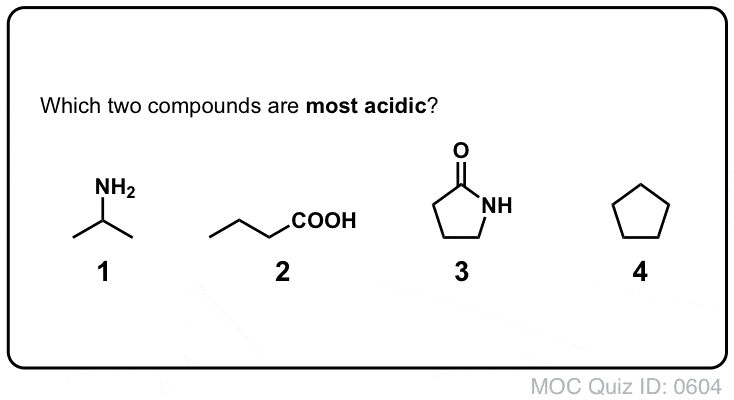
- First, amide nitrogens are considerably less basic than amine nitrogens. Este é principalmente o resultado da deslocalização do par único de nitrogénio para a ligação pi do carbonilo. De facto, a posição mais básica de uma amida não é o nitrogénio mas sim o oxigénio (!).
- Segundo, as ligações N-H das amidas são muito mais ácidas do que as ligações N-H das aminas. Porquê? Deslocalização de novo. O grupo carbonilo anexo permite que o par único da base conjugada seja deslocalizado por ressonância. A pKa de acetamida (17) é cerca de 20 ordens de magnitude mais ácida que o amoníaco (38).
Uma terceira, propriedade mais subtil das amidas é que normalmente têm uma rotação restrita sobre a ligação C-N. A forma de ressonância onde existe uma ligação C-N dá uma contribuição tão significativa para o híbrido de ressonância que se pode pensar que a ligação C-N tem “carácter de dupla ligação parcial”.
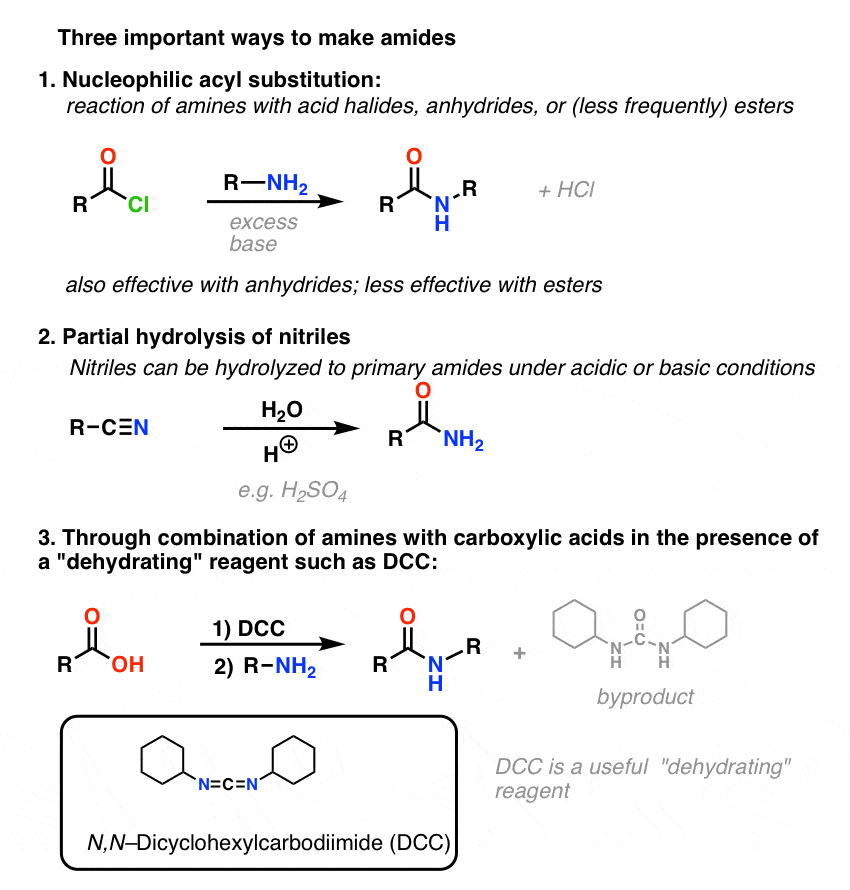
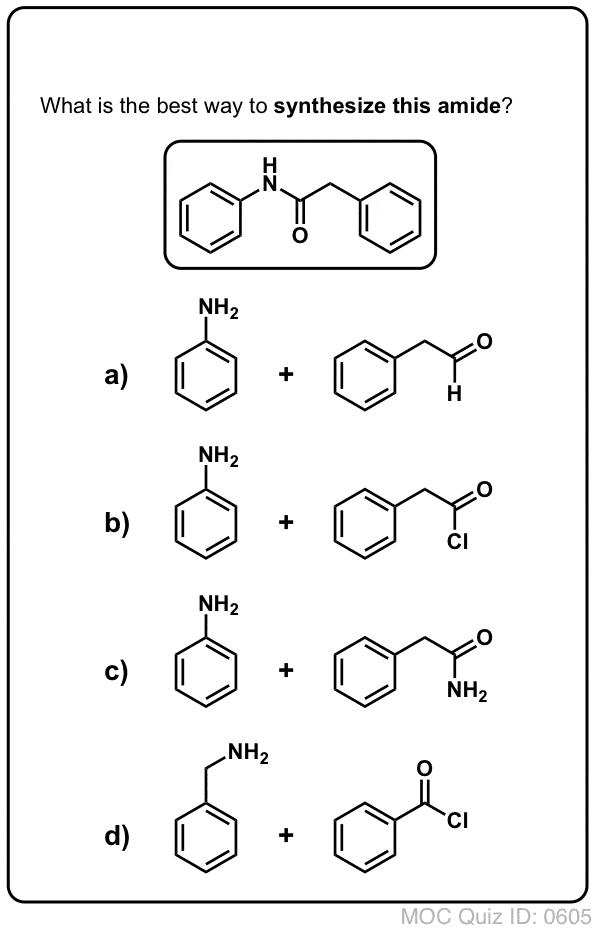
Síntese de Amides, Parte 1. Substituição de Acyl Acyl Halides Nucleófilos (ou Anidridos) por Aminas
Grupos de Acyl ligados a um bom grupo de saída como cloretos ácidos ou anidridos ácidos podem facilmente ser submetidos a substituição de acyl nucleófilos por nucleófilos de aminas.
Se apenas o ácido carboxílico estiver disponível para começar, utilizar um reagente como o cloreto de tionilo (SOCl2) para converter um ácido carboxílico em cloreto ácido é um bom primeiro passo na transformação de um ácido carboxílico em amida. (PCl3, PCl5, cloreto de oxalilo e uma série de outros reagentes também podem funcionar). Alternativamente, tratar um ácido carboxílico com um halogeneto de acilo irá fornecer um anidrido, que também pode ser eficaz.
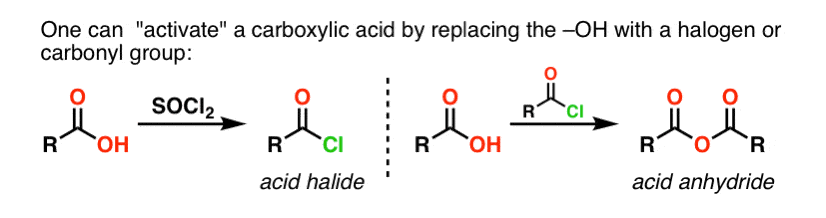
Halides (por exemplo Cl- ) e carboxilatos (RCO2- ) são bases muito mais fracas, e portanto muito melhor deixar grupos do que HO-. Assim, ao adicionar uma amina a um halogeneto de acilo ou anidrido ácido, a substituição do acilo nucleófilo pode ocorrer em condições muito mais suaves, resultando na nossa amida desejada.
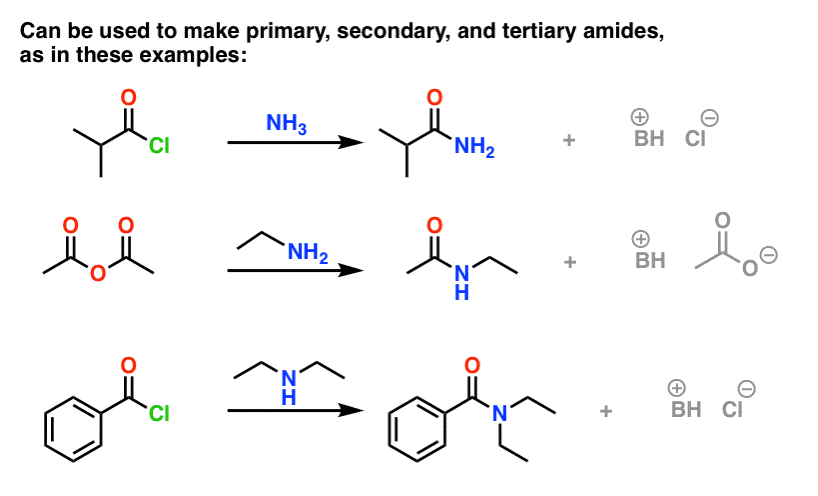
(Pode-se obter amidas através da reacção de ésteres com aminas, mas dado que os alcóxidos são mais pobres deixando grupos do que os halogenetos ou carboxilatos, este método requer condições mais forçantes. )
Uma coisa a notar com os halogenetos ácidos é que o processo gera um único equivalente de HCl como subproduto. Na ausência de qualquer base adicional, o rendimento máximo do processo seria de 50%, uma vez que o HCl protonaria qualquer amina e a tornaria um sal de amónio não-nucleofílico.
Uma forma de assegurar que a reacção prossegue até à conclusão é adicionar um segundo equivalente de amina. Existem outras formas práticas de resolver esta questão, que remeti para uma nota de rodapé .
Se precisar de uma actualização do mecanismo de substituição de acilo nucleófilos, passe aqui para uma imagem pop-up ou abra um link de imagem aqui:
.
Síntese de Amidas, Parte 2: Hidrólise parcial de nitrilos
Uma forma de pensar em nitrilos é que são ácidos carboxílicos mascarados. Se tratados com ácido aquoso e muito calor – condições de marreta – podem ser hidrolisados a ácidos carboxílicos.
Um dos intermediários neste processo é uma amida primária.
Assim, se utilizarmos uma técnica de marreta ligeiramente mais suave, por vezes é possível salvar a amida da nossa mistura de reacção antes de esta ser hidrolisada ao ácido carboxílico.
A imagem abaixo mostra como se pode sintetizar uma amida a partir de um precursor de halogeneto de alquilo, através da reacção SN2 do ‘good-ol’:
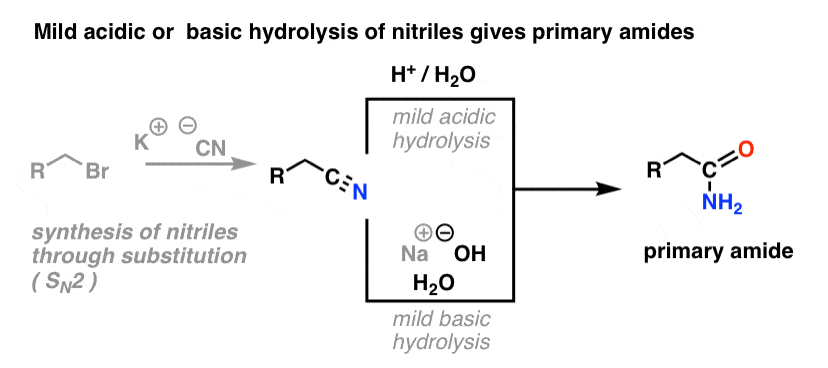 hidrólise ligeira ou básica de nitrilos dá amidas primárias
hidrólise ligeira ou básica de nitrilos dá amidas primárias
O que se entende por “ligeira”? Um conjunto de condições para a hidrólise de fenilacetamida (PhCH2CN) a PhCH2CONH2 dá as condições de reacção como “HCl, H2O, 40-50°C, 1h”.
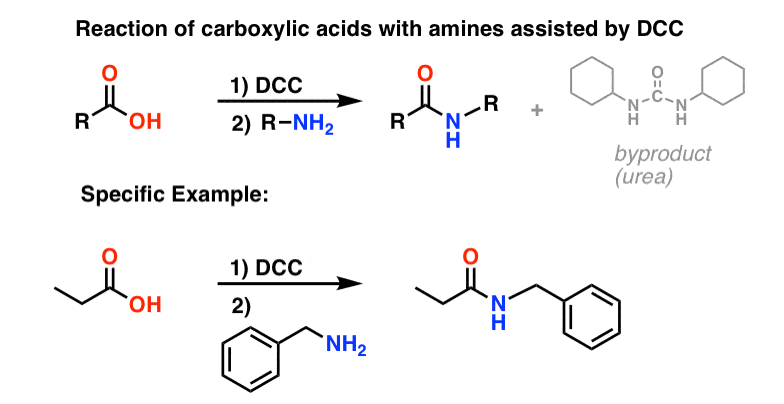
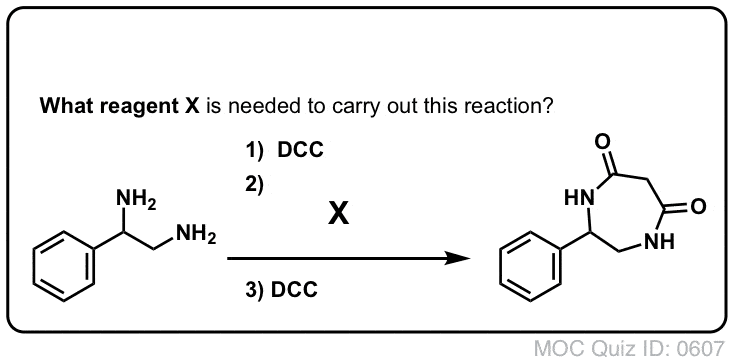
Síntese de Amidas, Parte 3: Utilização de um Reagente Desidratante (como DCC)
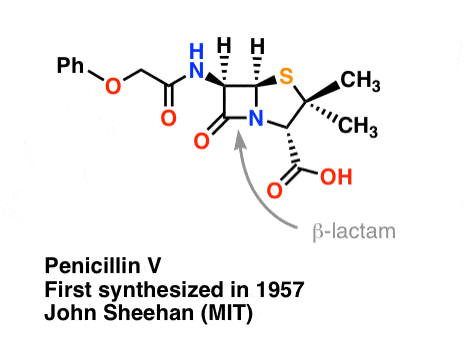
A síntese da penicilina V em 1957 pelo grupo de John Sheehan no MIT representa uma das realizações heróicas da química orgânica do pós-guerra. O principal problema foi a construção de um amido cíclico (o anel de lactam β) que é extremamente instável em condições ácidas. Isto não foi de pequena importância, pois o β-lactam é também a chave para o mecanismo de acção da penicilina: interferir com a síntese da parede celular bacteriana. Tentativas de fazer este amido cíclico convertendo um ácido carboxílico em um halogeneto de acilo com SOCl2, PCl3, PCl5, e uma série de outros métodos falharam todos.
Em resposta, o grupo de Sheehan inventou inteligentemente um reagente desidratante muito suave: N, N’-dicyclohexylcarbodiimide (DCC) que permitiu a formação de amidas em condições muito suaves a pH neutro.
Hoje em dia, o DCC (e o seu primo mais prático (nota), EDC ) são amplamente utilizados para a síntese de amidas sensíveis – particularmente peptídeos – em condições muito suaves.
Em condições de reacção, o oxigénio carboxilado liga-se ao carbono electrofílico do DCC, fazendo o que chamamos um “éster activo” – por outras palavras, um éster que tem de facto um grupo de saída decente (ao contrário da maioria dos ésteres, que não têm). O éster activo é então atacado pela amina numa clássica substituição nucleófila de acilo, que leva à formação da amida.
Vista-se o subproduto, note-se que existem dois hidrogénios (cada um ligado ao azoto) e um oxigénio (ligado ao carbono central). É para onde o H2O foi!
Porque este post está a ficar ridiculamente longo, guardei o mecanismo para esta imagem pop-up.
p>Desde que esta reacção ocorra em condições neutras, é extremamente útil na síntese de peptídeos, que podem ser submetidos a racemização (epimerização, na verdade) tanto em condições básicas como ácidas.
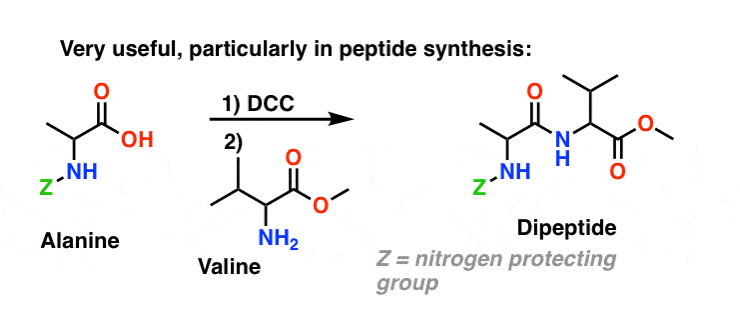
Sumário: Três métodos eficazes para a síntese de amidas
P>Valina valina a dipeptídeo utilizando dcc como agente de acoplamento>h2>Sumário: Três métodos eficazes para a síntese de amidas
Valina valina a dipeptídeo utilizando dcc como agente de acoplamento
Este artigo conclui o nosso post sobre os pontos principais da nomenclatura, propriedades e síntese de amidas. Para um método de síntese de amida, leia on.
Deixe-nos considerar brevemente um quarto método, menos importante: Força Bruta
Desde que é normalmente abordado nos livros de texto, vamos concluir considerando uma quarta possibilidade – a mais simples imaginável. E se tomarmos um ácido carboxílico e o combinarmos com uma amina, na esperança de que se forme uma amida. O que acontece?
Aminas são bases, e os ácidos carboxílicos são, bem, ácidos. Junte os dois e obtém um sal inócuo.
Às vezes é possível fazer amidas através do aquecimento das luzes vivas do dia com este sal num tubo selado, expulsando um equivalente de água. Este método chama-se pirólise.
O método não é nada se não for directo, e tem toda a subtileza de um howitzer.
O problema com a pirólise é que o grupo HO- de um ácido carboxílico é um grupo de saída terrível.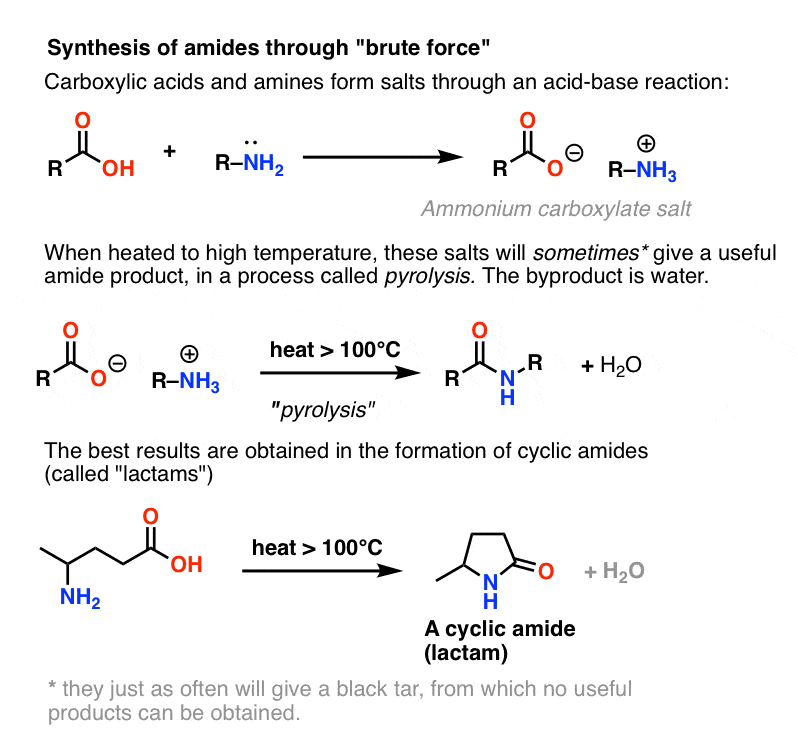
Para formar uma amida desta espécie, o oxigénio carboxílico (O- ) deve, de alguma forma, partir. Isto não é uma coisa fácil de fazer, pois a base conjugada de O- é o duplo ânion O2- . Em qualquer lista de grupos de saída, O2- classificar-se-ia algures entre, “merdoso” e “f&cking horrível”.
No entanto, se se atingir este sal com o equivalente químico do Martelo de Thor: força bruta, calor elevado, pode ocorrer uma série de transferências de prótons do sal de amónio. eventualmente libertando H2O e formando a ligação C-N.
Este processo chama-se pirólise (piro = fogo, lise = quebra).
Em certos casos, especialmente amidas simples, e também na formação de lactaminas simples, o processo pode ser satisfatório.
Em muitos outros casos, contudo, resulta na formação de alcatrão negro no fundo do seu frasco, do qual nenhum produto útil pode ser obtido.
Como qualquer químico orgânico lhe pode dizer, há muitas formas diversas de criar alcatrão negro intratável no fundo do seu frasco, e este é apenas um método. Pense no quanto ainda tem de descobrir!

“Hammer of Thor” Google Image Search foi relacionado com a química, mas surpreendentemente NSFW.
Notas
Um artigo divertido, relacionado: Amides: Humilde mas útil (de Chemical & Engineering News).
Há também um efeito indutivo, em que o oxigénio electronegativo (electronegatividade de 3,44) reboca sobre os electrões do carbono ligado, que por sua vez reboca sobre os electrões do azoto.
Nota 2. Uma forma muito comum de realizar esta reacção é utilizar o que se chama, condições Schotten-Baumann, em que se absorvem os reagentes em solvente como éter dietílico ou dicorometano, e adiciona-se uma solução aquosa de NaOH, resultando numa mistura bifásica. Quaisquer sais de amónio que se formem podem dissolver-se na fase aquosa, após o que são neutralizados pela base em excesso e regressam à fase orgânica. As aminas são geralmente muito mais nucleófilas do que os iões hidróxidos, pelo que a hidrólise do cloreto ácido para dar um ácido carboxílico não é geralmente um problema.
Nota 3.
“Na altura da minha síntese bem sucedida da penicilina V em 1957, comparei o problema de tentar sintetizar a penicilina pelos métodos clássicos com o de tentar reparar a mola principal de um relógio fino com bigorna de ferreiro, martelo, e pinça” – John C. Sheehan
Nota 4. O problema com a utilização de DCC é que o subproduto, DCU, é uma enorme dor de cabeça para se livrar. A maioria dos subprodutos são facilmente removidos utilizando a cromatografia em coluna. O DCU não. Dando pouca atenção à polaridade do solvente, o DCU emerge lentamente de uma coluna, em gotejamentos e drenagens, contaminando cada fracção à medida que avança. EDC é uma variante do DCC que tem uma unidade de amina terciária; assim, uma simples lavagem com ácido durante o trabalho removerá toda a ureia, poupando muito tempo e dor de cabeça.
A imagem seguinte mostra o último passo da síntese de Sheehan usando DCC.
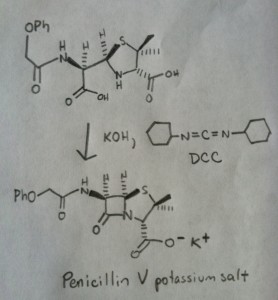
Image: Carmen Drahl/Química & Notícias de Engenharia
Quiz Yourself!
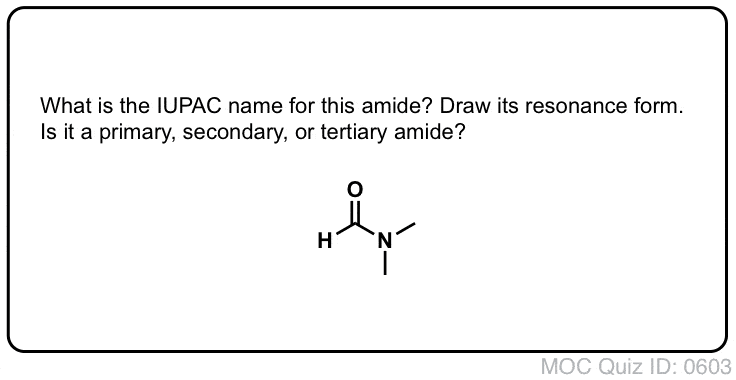 Click to Flip
Click to Flip 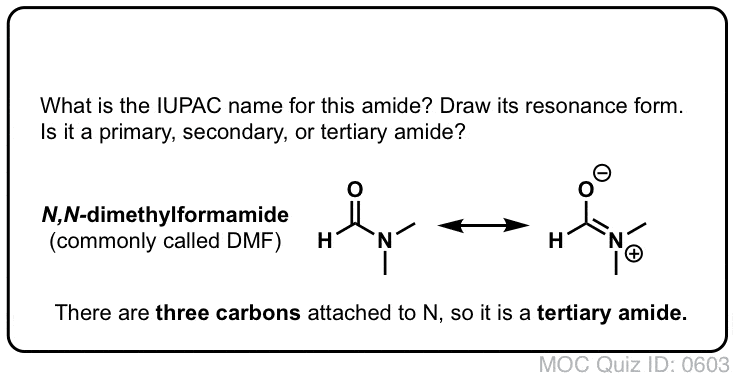
/div>
 Click to Flip
Click to Flip 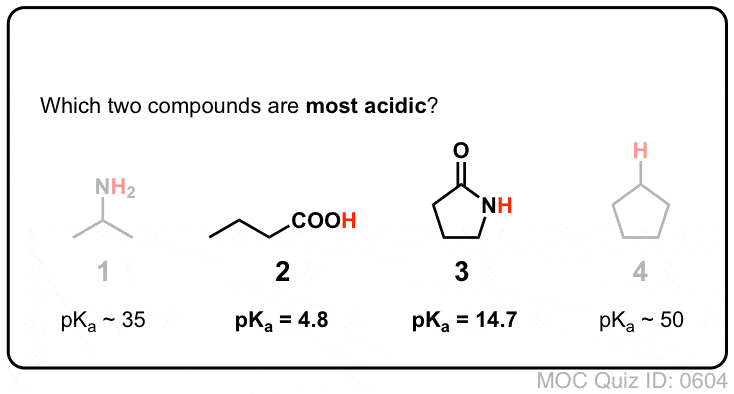
 Click to Flip
Click to Flip 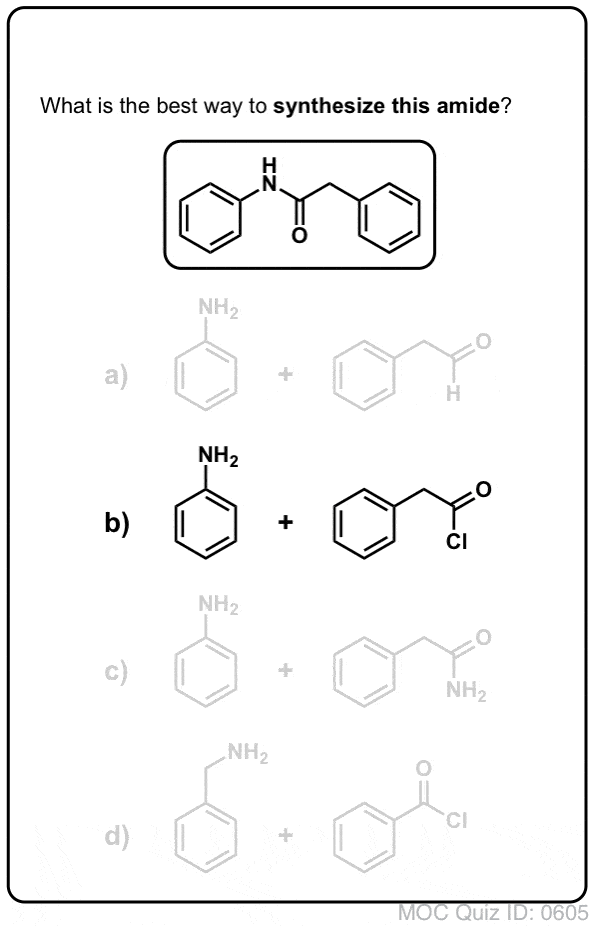
 Click to Flip
Click to Flip 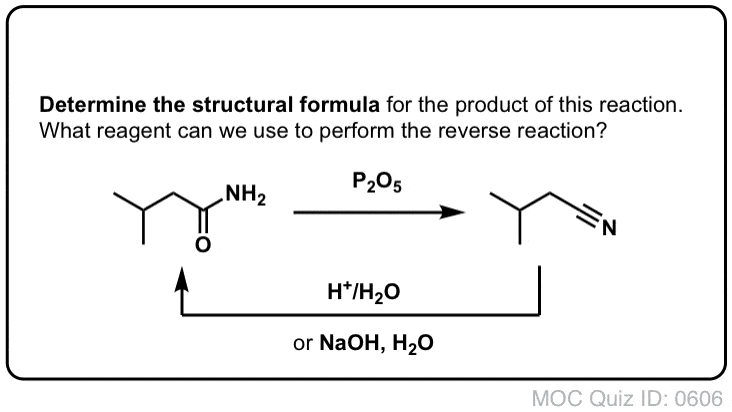
 Click to Flip
Click to Flip 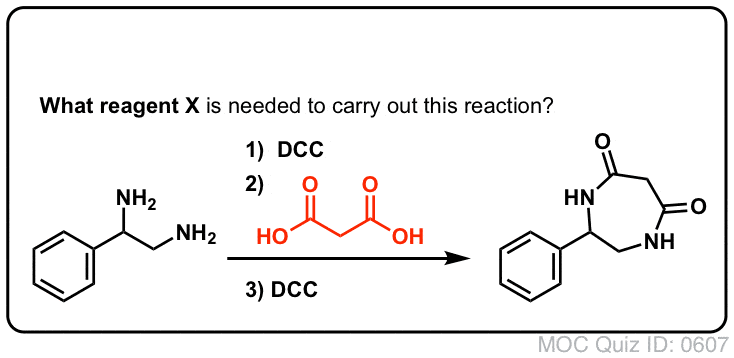
Referências e Leitura Adicional
Hidrólise de nitrilo:
- PHENYLACETAMIDE
Wilhelm Wenner
Org Sintetizador. 1952, 32, 92
DOI: 10.15227/orgsyn.032.0092
As condições aqui usadas para a hidratação do nitrilo ao amido são bastante suaves – isto usa uma temperatura de 40 °C durante aproximadamente 1 hr. - O truque da corda de nylon: Demonstração de polimerização de condensação
Paul W. Morgan e Stephanie L. Kwolek
Journal of Chemical Education 1959, 36 (4), 182
DOI: 1021/ed036p182
O clássico ‘truque da corda de nylon’ em que se puxa um fio de nylon de uma mistura bifásica de hexametilenodiamina e cloreto de sebacoyl pode ser considerado um tipo de reacção Schotten-Baumann, na medida em que forma uma poliamida! Esta foi desenvolvida pela primeira vez por Stephanie Kwolek, que foi uma química distinta na DuPont durante mais de 40 anos e foi responsável pela descoberta do Kevlar e pelo desenvolvimento da química das aramidas e outros materiais de alta resistência.DCC: - Reacções de Carbodiimidas. II. As Reacções de Diciclohexylcarbodiimida com Ácidos Carboxílicos na Presença de Aminas e Fenóis
DeLos F. DeTar e Richard Silverstein
Journal of the American Chemical Society 1966, 88 (5), 1020-1023
DOI:1021/ja00957a028 - Notes- A Convenient Synthesis of Water-Soluble Carbodiimides.
John Sheehan, Philip Cruickshank, e Gregory Boshart
The Journal of Organic Chemistry 1961, 26 (7), 2525-2528
DOI:1021/jo01351a600
O maior inconveniente com DCC é que a separação da DCU (dicyclohexylurea) assim produzida pode ser incómoda. Assim, foram desenvolvidos outros reagentes, tais como EDC (1-Etil-3-(3′-dimetilaminopropil)carbodiimida), para os quais a ureia resultante é solúvel em água e facilmente removível por extracção.
li>Hidrólise de nitrilo dirigida por Haleto
James M. Photis
Tetrahedron Lett. 1980, 21 (37), 3539-3540
DOI: 10.1016/0040-4039(80)80228-0
Este é um procedimento útil para a hidrólise selectiva de nitrilos para amidas primárias, especialmente no caso de cianetos aromáticos (por exemplo PhCOCN). Conversão Fáctil e Altamente Selectiva de Nitrílicos em Amidas via Hidratação com Ácido Indirecto-Catalisado Usando TFA ou AcOH-H2SO4
Jarugu Narasimha Moorthy e Nidhi Singhal
The Journal of Organic Chemistry 2005, 70 (5), 1926-1929
DOI: 10.1021/jo048240aSchotten-Bauman Reaction:
#4 e #5 são os trabalhos originais de Schotten e Baumann sobre uma síntese simples de bifase amida.li> Ueber die Oxydation des Piperidins
Schotten, C.
Ber. 1884, 17 (2), 2544-2547
DOI: 10.1002/cber.188401702178 li> Ueber eine einfache Methode der Darstellung von Benzoësäureäthern
Baumann, E.
Ber. 1886, 19 (2), 3218-3222
DOI: 10.1002/cber.188601902348 Síntese Total Enantioselectiva de (-)-Kibdelone C
John R. Butler, Chao Wang, Jianwei Bian, e Joseph M. Ready
Journal of the American Chemical Society 2011, 133 (26), 9956-9959
DOI: 1021/ja204040k
A humilde reacção Schotten-Baumann é até utilizada em sínteses totais exigentes – neste caso, é utilizada para fazer o lactam em 4 de 5 e 6!li> BENZOYL PIPERIDINE
Marvel, C. S.; Lazier, W. A.
Org. Synth. 1929, 9, 16
DOI: 10.15227/orgsyn.009.0016
Este procedimento da Organic Syntheses, uma fonte de procedimentos laboratoriais orgânicos sintéticos testados independentemente e reprodutíveis, é um clássico da Schotten-Baumann amide synthesis.li> A High-Throughput Process for Valsartan
Ulrich Beutler, Matthias Boehm, Peter C. Fuenfschilling, Thomas Heinz, Jean-Paul Mutz, Ulrich Onken, Martin Mueller, e Werner Zaugg
Organic Process Research & Development 2007, 11 (5), 892-898
DOI: 1021/op700120n
Organic Process & Research Development (“OPRD”) é uma grande revista de química de processo ou de escalonamento. Este artigo mostra como a reacção Schotten-Baumann (4 a 3) é preferida para reacções em grande escala, pois é simples, robusta, fácil de realizar, e não tem grandes exotermas (ao contrário da reacção Grignard, por exemplo).
li> Um Novo Método de Formação de Ligações Peptídicas
John C. Sheehan e George P. Hess
Journal of the American Chemical Society 1955, 77 (4), 1067-1068
DOI: 1021/ja01609a099
Papel original sobre a síntese de ligações peptídeo/ligações de amida usando DCC.DeTar publicou uma série de artigos que estudam o mecanismo das reacções de formação de ligações mediadas por DCC e outros carbodiimidas, e aqui estão os dois primeiros:li> Reacções de Carbodiimidas. I. Os Mecanismos das Reacções de Ácido Acético com Diciclohexylcarbodiimida
DeLos F. DeTar e Richard Silverstein
Journal of the American Chemical Society 1966, 88 (5), 1013-1019
DOI: 10.1021/ja00957a027
li> The Chemistry of Carbodiimides.
G. Khorana
Chemical Reviews 1953, 53 (2), 145-166
DOI: 10.1021/cr60165a001
Uma antiga revisão do Prof. Har Gobind Khorana, que mais tarde recebeu o Prémio Nobel da Medicina pelo seu trabalho demonstrando que os nucleótidos no ADN e o código RNA para a síntese de proteínas. ESTERIFICAÇÃO DE ÁCIDOS CARBOXÍLICOS COM DICICICLOHEXYLCARBODIIMIDE/4-DIMETYLAMINOPYRIDINE: tert-BUTYL ETHYL FUMARATE
Neises e Wolfgang Steglich
Org. Synth. 1985, 63, 183
DOI: 10.15227/orgsyn.063.0183
Este é um procedimento de esterificação selectiva usando DCC – isto evita a transesterificação que ocorreria em condições normais de esterificação Fischer. Este procedimento é de Sínteses Orgânicas, uma fonte de reacções orgânicas sintéticas fiáveis e testadas independentemente.li> Sínteses de Peptídeo Sólido de Fase. I. A Síntese de um Tetrapéptido
B. Merrifield
Journal of the American Chemical Society 1963, 85 (14), 2149-2154
DOI: 10.1021/ja00897a025
Este é um dos trabalhos mais citados no JACS, e por uma boa razão – estabelece basicamente os alicerces do SPPS, e o que é agora uma indústria de mil milhões de dólares. Este trabalho conduziu a um Prémio Nobel da Química para o autor, Prof. R. Bruce Merrifield (Rockefeller U.). Os acoplamentos peptídeos são feitos usando nada mais nada menos que DCC.
li> Síntese total de um antibiótico monocíclico de peptídeo lactona, etamicina
John C. Sheehan e Stephen L. Ledis
Journal of the American Chemical Society 1973, 95 (3), 875-879
DOI:1021/ja00784a041
EDC foi utilizado para a maior parte dos acoplamentos do peptídeo na síntese deste peptídeo, que é um dos primeiros peptídeos cíclicos a ser produzido sinteticamente.