Apathie ist definiert als verminderte Motivation, die nicht auf eine verminderte Bewusstseinslage, kognitive Beeinträchtigung oder emotionalen Stress zurückzuführen ist.1 Depressionen sind mit erheblichem emotionalem Stress verbunden, der sich durch Weinerlichkeit, Traurigkeit, Angst, Unruhe, Schlaflosigkeit, Magersucht, Gefühle der Wert- und Hoffnungslosigkeit und wiederkehrende Gedanken an den Tod äußert.2 Die traditionelle diagnostische Nomenklatur und die Messinstrumente für Depressionen, einschließlich des DSM-IV2 und der Hamilton Rating Scale for Depression (Ham-D),3 behandeln Apathie als einen Aspekt der Depression, aber sie kann ein unterscheidbares klinisches Konstrukt sein, das bei einigen Patienten einen anderen Behandlungsansatz erfordert.4-7
Marin et al.7 untersuchten Patienten mit Alzheimer-Krankheit (AD), Schlaganfall und Major Depression mit Hilfe der Apathy Evaluation Scale8 und der Ham-D. Sie fanden heraus, dass die Beziehung zwischen Apathie und Depression zwischen den Diagnosegruppen variierte. Apathie und Depression waren innerhalb der Gruppen signifikant korreliert, obwohl die absoluten Werte von Apathie und Depression stark variierten. Patienten mit Alzheimer-Krankheit hatten häufig hohe Apathie- und niedrige Depressionswerte, während Patienten mit linkshemisphärischem Schlaganfall oder Major Depression häufig hohe Depressionswerte bei niedrigen Apathiewerten hatten. Patienten mit rechtshemisphärischem Schlaganfall bildeten die einzige Gruppe, in der die beiden Symptome gleich stark ausgeprägt waren, und es war die einzige Gruppe, in der Apathie und Depression nicht korreliert waren. Die Autoren schlugen vor, dass Apathie und Depression klinisch unterschiedliche neuropsychiatrische Syndrome sind.
Neurodegenerative Erkrankungen erleichtern die Untersuchung von Apathie und Depression, da sie eine nachweisbare Hirnpathologie hervorrufen und häufig mit neuropsychiatrischen Symptomen einhergehen.5,9-13 Das Neuropsychiatrische Inventar (NPI)14 wurde entwickelt, um neuropsychiatrische Symptome bei dementiellen Erkrankungen zu erfassen und enthält separate Subskalen für Apathie und Depression. In zwei früheren Studien fanden wir heraus, dass Patienten mit frontotemporaler Demenz (FTD) und progressiver supranukleärer Lähmung (PSP) von Patienten mit Alzheimer durch ihre stärkere Apathie und relativ geringere Depression unterschieden werden können.9,11 Wir stellten die Hypothese auf, dass sich Apathie oder fehlende Emotionen von Depressionen unterscheiden und spekulierten, dass die beiden Symptome durch unterschiedliche neuroanatomische oder neurochemische Substrate hervorgerufen werden und sich bei einer Vielzahl von neurologischen Erkrankungen unterschiedlich manifestieren.
METHODEN
Probanden
Insgesamt 154 Patienten wurden an vier akademischen Zentren untersucht. Die Teilnahme an der Studie erforderte die informierte Zustimmung sowohl des Patienten als auch des Betreuers.
30 AD-Patienten und 28 FTD-Patienten stellten sich in einer Demenzklinik der University of California in Los Angeles, der University of California in Los Angeles-Harbor Medical Center oder des West Los Angeles Veterans Affairs Medical Center vor. Alle 30 AD-Patienten und 22 der FTD-Patienten wurden bereits zuvor beschrieben.9 Wahrscheinliche AD wurde auf der Grundlage von Kriterien diagnostiziert, die vom National Institute of Neurological and Communicative Disorders and Stroke und der Alzheimer’s Disease and Related Disorders Association (NINCDS-ADRDA) aufgestellt wurden.15 Frontotemporale Demenz wurde auf der Grundlage von Kriterien diagnostiziert, die von den Gruppen in Lund und Manchester entwickelt wurden.16
Vierzig Parkinson-Patienten wurden aufgrund des On-Off-Syndroms, eines hartnäckigen Tremors oder einer Bradykinesie bei maximaler Dosierung von Anti-PD-Medikamenten zur Pallidotomie in eine Klinik für Bewegungsstörungen an der University of California in Los Angeles überwiesen. Die Patienten wurden von zwei Neurologen und einem Neurochirurgen untersucht. Zu den Einschlusskriterien gehörten eine Anamnese, die auf eine idiopathische Parkinson-Krankheit hindeutet, einschließlich zwei der vier Kardinalzeichen (Ruhetremor, Rigidität, Akinesie/Bradykinesie und Gangstörung/posturale Instabilität) und eine eindeutige Anamnese des Ansprechens auf Levodopa.
Zweiundzwanzig Patienten mit PSP wurden in einer Ambulanz des National Institute of Neurological Disorders and Stroke (NINDS) gesehen und wurden bereits zuvor beschrieben.11 Alle PSP-Patienten erfüllten die Blin-Kriterien für wahrscheinliche PSP.17,18
Vierunddreißig Patienten mit Morbus Huntington (HD) stellten sich in einer Spezialklinik an der University of California, San Diego, vor und hatten alle die typische choreiforme Bewegungsstörung sowie mindestens einen Verwandten ersten Grades, der ebenfalls an HD erkrankt war.
Die Patienten wurden auf chronische psychische Erkrankungen, Kopftrauma, zerebrovaskuläre Erkrankungen, extrapyramidale Störungen, die nicht beschrieben wurden, Vitaminmangel, Hypothyreose, Syphilis und andere medizinische Erkrankungen untersucht. Nicht alle Patienten mit HD, PSP und PD hatten ausreichende Gedächtnisstörungen, um die DSM-IV-Kriterien für Demenz zu erfüllen; sie hatten jedoch alle degenerative Hirnerkrankungen, wie sie durch ihre klinischen Diagnosen definiert waren. Unser primärer Fokus lag nicht auf dem Grad der Demenz, sondern auf der Beziehung von Apathie und Depression. Sekundäre Analysen untersuchten die Beziehung dieser Symptome zur kognitiven Beeinträchtigung.
Assessment
Verhaltensdaten wurden während der Interviews mit den Pflegern mit Hilfe des NPI erhoben. Dieses Instrument bewertet 10 Verhaltensweisen, die bei dementiellen Erkrankungen auftreten, darunter Wahnvorstellungen, Halluzinationen, Unruhe, Depression, Angst, Euphorie, Apathie, Enthemmung, Reizbarkeit und abweichendes motorisches Verhalten (einschließlich Strampeln, Grübeln und Zwänge). Eine Häufigkeitsbewertung (1-4) multipliziert mit einer Schwerebewertung (1-3) ergibt einen Subskalenwert für jedes Verhalten, und die Summierung der Subskalenwerte ergibt den Gesamt-NPI-Wert. Es wurde auch ein anderer Analyseansatz verwendet, bei dem wir 0 für die mittlere Abwesenheit und 1 oder mehr für die mittlere Anwesenheit des Symptoms zugewiesen haben. Der NPI hat sich im Vergleich zu einer Vielzahl anderer diagnostischer Ansätze als valide erwiesen und weist eine hohe Interrater- und Test-Retest-Reliabilität auf.14 Ein Schulungsvideo und geskriptete Fragen wurden verwendet, um eine standortübergreifende Reliabilität zu gewährleisten.
Die Apathie-Subskala umfasst Items wie z. B. Interessensverlust, mangelnde Motivation, weniger spontan, weniger liebevoll, weniger enthusiastisch, mangelnde Emotionen und keine Lust, neue Dinge zu tun. Die Subskala Depression umfasst Items wie traurig, deprimiert, weinerlich, niedergeschlagen, sich wie ein Versager fühlend, hoffnungslos in Bezug auf die Zukunft, sich wie eine Last fühlend und sich den Tod wünschend. Die Subskala „Depression“ enthält keine Items, die sich auf Apathie beziehen, und korreliert nachweislich stark mit der Hamilton-Depressionsskala.14 Die Subskala „Apathie“ enthält keine Items, die sich auf Traurigkeit beziehen.
Die kognitiven Funktionen wurden mit der Mini-Mental State Examination (MMSE) erfasst.19 Ein perfekter Wert bei der MMSE ist 30, und abnehmende Werte weisen auf eine schwerere kognitive Beeinträchtigung hin. Der NPI und der MMSE wurden in der Regel am gleichen Tag durchgeführt.
Datenanalyse
Die beiden zentralen Fragen der Studie waren 1) wie diese beiden Symptome miteinander in Beziehung stehen und 2) ob ihre Beziehung über verschiedene Demenzsyndrome hinweg konsistent ist oder nicht. Es wurden Spearman-Korrelationen für alle 10 NPI-Subskalen-Scores und den MMSE-Gesamtscore ermittelt. Es wurde eine separate Matrix für jede der fünf Demenzgruppen und für die kombinierte Gesamtgruppe erstellt. Eine Kruskal-Wallis-Einweg-Varianzanalyse (ANOVA) über die mittleren Subskalenwerte wurde verwendet, um Gruppenunterschiede im Schweregrad der Depression und Apathie zu bestimmen. Die Analysen sind explorativ, und ein Signifikanzniveau von 0,5 wurde als aussagekräftig akzeptiert.
ERGEBNISSE
Die klinischen Merkmale der 154 Patienten sind in Tabelle 1 dargestellt. Es gab fast gleich viele Männer und Frauen in der FTD- und HD-Gruppe, aber es gab mehr Frauen in der AD-Gruppe und mehr Männer sowohl in der PD- als auch in der PSP-Gruppe. Die AD-Gruppe war im Durchschnitt etwa 10 Jahre älter als die FTD-, PD- und PSP-Gruppe und 30 Jahre älter als die HD-Gruppe. Die MMSE-Scores waren bei AD und FTD ähnlich, und diese beiden Gruppen hatten MMSE-Scores, die 10 Punkte niedriger waren als die PD-, HD- und PSP-Gruppen.
Der Schweregrad von Apathie und Depression unterschied sich signifikant zwischen den Gruppen (Tabelle 1). Eine Kruskal-Wallis Einweg-ANOVA wurde verwendet, um die mittleren NPI-Subskalenwerte zwischen den Gruppen zu vergleichen. Es wurden signifikante Unterschiede zwischen den vier Gruppen gefunden, wobei Patienten mit Morbus Parkinson und Huntington die geringste Apathie und die schwerste Depression aufwiesen (Abbildung 1).
Die Häufigkeit von Apathie und Depression und die Beziehung zwischen den beiden Symptomen variierte zwischen den Diagnosegruppen. Eine große Anzahl von AD-Patienten und noch mehr FTD- und PSP-Patienten hatten Apathie ohne Depression, während viele PD- und HD-Patienten eine Depression ohne Apathie hatten. In allen Diagnosegruppen gab es mehr Patienten mit dem einen oder dem anderen Symptom als mit beiden Symptomen. Die Disparität zwischen Apathie und Depression war besonders dramatisch bei Patienten mit PD und PSP. Nur wenige Morbus-Parkinson-Patienten hatten Apathie allein (n=2; 5 %) im Vergleich zu der Anzahl, die eine Depression allein (11; 28 %) oder eine Depression plus Apathie (11; 28 %) hatten, und nur wenige PSP-Patienten hatten eine Depression, aber sie hatten eine hohe Häufigkeit von Apathie. Von 22 Patienten mit PSP hatten 17 (77 %) Apathie allein,11 1 hatte eine Depression und 3 hatten eine Depression plus Apathie (Tabelle 1).
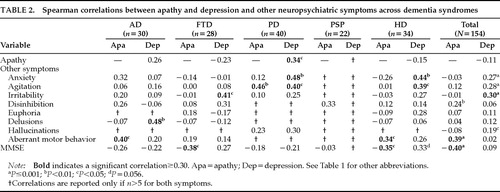
Apathie korrelierte nicht mit Depression in der kombinierten Stichprobe von Demenzpatienten (r=-0,11, P=0,18). Es gab eine nicht-signifikante negative Korrelation in den Gruppen FTD (r=-0,23, P=0,23) und HD (r=-0,15, P=0,40), und es gab eine nicht-signifikante positive Korrelation in der AD-Gruppe (r=0,26, P=0,16). Die PD-Gruppe war die einzige Demenzgruppe, die eine signifikante Korrelation zwischen den beiden Symptomen zeigte (r=0,34, P=0,03; Tabelle 2). Somit unterschied sich das Muster der Korrelation zwischen Apathie und Depression über die Diagnosegruppen hinweg, und das Vorhandensein des einen sagte das Vorhandensein des anderen nicht voraus.
Der NPI misst acht neuropsychiatrische Symptome zusätzlich zu Apathie und Depression. Einige dieser Symptome korrelierten mit Apathie und andere, andere Symptome korrelierten mit Depression. In der Gesamtstichprobe korrelierte Apathie mit Enthemmung und abweichendem motorischen Verhalten, und Depression korrelierte mit Angst, Unruhe, Reizbarkeit und Halluzinationen (Tabelle 2).
Apathie korrelierte mit einer geringeren kognitiven Funktion, gemessen durch den MMSE in der Gesamtstichprobe (r= -0,40, P<0.0001), in der FTD-Gruppe (r= -0,38, P<0,05) und in der HD-Gruppe (r= -0,35, P<0,05). Die AD- und PD-Gruppen hatten einen Trend zu einer niedrigeren kognitiven Funktion mit zunehmender Apathie, und die PSP-Gruppe hatte keine Korrelation zwischen Apathie und kognitiver Funktion. Apathie korrelierte nicht mit dem fortschreitenden Alter.
Depressionen hatten keine signifikante Korrelation mit den MMSE-Scores in der kombinierten Stichprobe. Bei AD und PD gab es nicht-signifikante Trends zu einem Zusammenhang zwischen Depression und geringerer kognitiver Funktion. FTD- und HD-Patienten zeigten nicht-signifikante Trends zu einem Zusammenhang zwischen dem Schweregrad der Depression und einer besseren kognitiven Funktion, und es gab zu wenige PSP-Patienten mit Depression, um eine aussagekräftige Analyse durchzuführen.
DISKUSSION
Apathie ist bei neurodegenerativen Erkrankungen weit verbreitet,5,9-13 und diese Studie unterstützt und erweitert die Ergebnisse der wenigen früheren Studien, die sich mit dem Thema Apathie und Depression als unabhängige klinische Phänomene beschäftigen.5,7,11,20 Im Gegensatz zum Ham-D, der in vielen früheren Studien verwendet wurde, enthält die Depressions-Subskala des NPI keine apathiebezogenen Items, und die Apathie-Subskala enthält keine depressionsbezogenen Fragen. Wir fanden keine Korrelation zwischen Apathie und Depression bei 154 Patienten mit fünf neurodegenerativen Erkrankungen. Außerdem waren die beiden Symptome in unterschiedlicher Weise mit anderen neuropsychiatrischen Symptomen assoziiert. Apathie war mit Enthemmung und abweichendem motorischen Verhalten assoziiert; Depression war mit Angst, Unruhe, Reizbarkeit und Halluzinationen verbunden. Apathie und Enthemmung mögen wie sich gegenseitig ausschließende Verhaltensweisen erscheinen, aber beide werden durch Frontallappensysteme vermittelt und treten häufig zusammen auf, besonders bei Patienten mit FTD. Auch die Problemverhaltensweisen, die zu Managementschwierigkeiten oder verminderter Funktionsfähigkeit führen, können primär mit einer Dysfunktion des Frontallappens zusammenhängen, und frühere Studien haben herausgefunden, dass Apathie mit diesen Symptomen assoziiert ist.21,22
In dieser und früheren Studien war Apathie signifikant mit einer erhöhten kognitiven Beeinträchtigung (gemessen durch den MMSE) bei AD und PD korreliert,5,13,20,23 aber nicht bei PSP11 oder HD.22 Die Beziehung zwischen Depression und kognitiver Funktion bei Demenz ist umstritten. Einige Studien haben einen Zusammenhang zwischen Depression und schwereren kognitiven Beeinträchtigungen gefunden,24 andere hingegen nicht.25 Wir fanden keinen konsistenten Zusammenhang zwischen Depression und Kognition in der Gesamtstichprobe oder bei einzelnen Erkrankungen. Der MMSE testet jedoch nicht adäquat die Funktion des Frontallappens, die bei vielen dementiellen Erkrankungen häufig beeinträchtigt ist, und stellt kein valides Maß für diesen Teil des kognitiven Verfalls dar.
Die Beziehung zwischen Apathie und Depression scheint krankheitsspezifisch zu sein. AD, FTD und PSP wiesen häufiger und schwerer Apathie auf, während PD und HD häufiger und schwerer Depression aufwiesen. PSP-Patienten zeigten die häufigste und schwerste Apathie und die geringste Depression. Eine frühere Studie, die verschiedene Maßstäbe für Apathie und Krankheitsschwere verwendete, fand heraus, dass HD-Patienten schwerer apathisch waren als AD-Patienten.22
Die anatomische Lokalisation der regionalen Dysfunktion, die mit Apathie und Depression assoziiert ist, scheint sich erheblich zu überlappen. Es wird berichtet, dass Depressionen häufiger auftreten, wenn fokale Läsionen anterior und linksseitig sind.26 Dieser Befund ist ähnlich, aber nicht identisch mit den Ergebnissen von Stoffwechselstudien bei jüngeren Patienten, die zeigen, dass schwere Depressionen mit frontalem und insbesondere linksseitigem Hypometabolismus assoziiert sind.27 Parkinson-Krankheit mit Depressionen ist mit einem reduzierten Glukosestoffwechsel im inferioren frontalen28 und medialen präfrontalen Kortex assoziiert.29 Paralimbische Areale wie der orbital-inferiore präfrontale und temporale Kortex wurden ebenfalls mit Depressionen bei Patienten mit HD in Verbindung gebracht.30 Apathie resultiert aus der Schädigung medialer präfrontaler, anteriorer cingulärer und anteriorer temporaler paralimbischer Areale, insbesondere der Amygdala und verwandter subkortikaler Strukturen.31-33 Apathie bei AD-Patienten wurde in einer Studie23 mit frontotemporaler Hypoperfusion und in einer anderen mit rechter temporoparietaler Hypoperfusion korreliert.21 Apathie kann auch bei Schlaganfällen auftreten, die den hinteren Teil der inneren Kapsel betreffen.20 Apathie wurde erst kürzlich untersucht, und es gibt möglicherweise mehrere Formen von Apathie, die durch ein Netzwerk verwandter Strukturen vermittelt werden. Die anatomischen Korrelate der Apathie müssen weiter untersucht werden, aber die Beobachtungen hier deuten darauf hin, dass die frontalen Regionen, die bei FTD involviert sind, und die diencephalen Strukturen, die bei PSP betroffen sind, besonders relevant sind.
Ein Teil der Überschneidungen, die zwischen Depression und Apathie berichtet wurden, könnte auf die Verwendung von Depressionsinstrumenten zurückzuführen sein, die Apathie-Items enthalten. Eine andere mögliche Erklärung ist, dass ähnliche Schaltkreise an beiden Symptomen beteiligt sein könnten, sich aber im Grad der Neurotransmitter-Beteiligung zwischen den verschiedenen Störungen unterscheiden könnten. Serotonerge Wirkstoffe lindern häufig Depressionen, können aber die Apathie verstärken, während dopaminerge Wirkstoffe zwar die Apathie lindern können34,35 , aber als Antidepressiva unwirksam sind; bei Erkrankungen mit Acetylcholinmangel, wie z. B. Alzheimer, kann ein cholinomimetischer Wirkstoff nützlich sein, um die Apathie zu reduzieren, aber er beeinflusst nicht die Stimmung.36 Eine mögliche Erklärung für das unterschiedliche therapeutische Ansprechen von Depression und Apathie ist, dass Depression entsteht, wenn ein Ungleichgewicht in der paralimbischen Neurotransmitterfunktion zu exzessiven negativen Emotionen führt, während Apathie auftritt, wenn der Kortex funktionell vom relevanten paralimbischen Input getrennt ist.
Einschränkungen und Stärken dieser Studie sollten anerkannt werden. Erstens war die Verhaltensbeurteilung ein primäres Ziel bei der Erhebung dieser Daten, aber die hier vorgestellten spezifischen Hypothesen wurden nicht prospektiv aufgestellt und die Analysen sind post hoc. Zweitens sind Depression und Apathie subjektive menschliche Erfahrungen, und die von der NPI verwendeten Informantenstrategien der Pflegekräfte sind möglicherweise nicht ganz genau – obwohl es Hinweise darauf gibt, dass Pflegekräfte in der Lage sind, gültige Bewertungen von Depression und Apathie abzugeben.8,37 Drittens hatten die PD-, HD- und PSP-Patienten signifikant weniger kognitive Beeinträchtigungen, was einige der Unterschiede erklären könnte, die wir als krankheitsspezifisch beschrieben haben. Viertens können Psychopharmaka Apathie und Depressionen verursachen, und wir können nicht sicherstellen, dass einige unserer Patienten diese nicht einnahmen; allerdings wurden diese Untersuchungen im Allgemeinen beim ersten Besuch vor der medikamentösen Behandlung durchgeführt. Schließlich haben wir keine Autopsiedaten, um unsere diagnostische Genauigkeit zu bestätigen.
Die Studie wird durch die Anwesenheit einer großen Gruppe von Patienten mit neurodegenerativen Erkrankungen und einer großen Variation in der klinischen und pathologischen Ausprägung ihrer Krankheiten gestärkt, was uns erlaubt, Rückschlüsse auf die Beziehung zwischen Apathie und Depression bei Vorhandensein von unterschiedlich beeinträchtigten Nervenbahnen zu ziehen. Darüber hinaus ermöglicht die Verwendung eines reliablen und validen Instruments, das die beiden Konstrukte trennt, einen aussagekräftigen Vergleich.
Wir kommen zu dem Schluss, dass Apathie bei neurodegenerativen Erkrankungen häufig vorkommt und von Depression trennbar ist. Sie kann mit dopaminergen oder cholinergen Medikamenten behandelbar sein, und ihr Vorhandensein sollte im Rahmen einer neuropsychiatrischen Routineuntersuchung abgeklärt werden. Apathie sollte nicht auf eine Depression zurückgeführt werden, und die Diagnose einer Depression sollte auf den Symptomen von Traurigkeit und Gefühlen von Hilflosigkeit, Hoffnungslosigkeit und Wertlosigkeit basieren.
HINWEISE
Dieses Projekt wurde von einem Department of Veterans Affairs Neuroscience Fellowship, einem National Institute on Aging Alzheimer’s Disease Center grant (AG10123) und dem Sidell-Kagan Research Fund unterstützt.
TABLE 1.
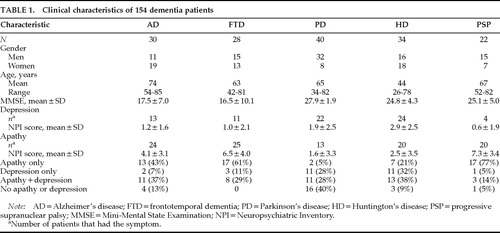
TABLE 2.
Eingegangen am 12. Juni 1997; überarbeitet am 13. August 1997; angenommen am 14. August 1997. Von den Abteilungen für Psychiatrie/Biobehavioral Sciences und Neurologie der University of California-Los Angeles School of Medicine, dem West Los Angeles Veterans Affairs Medical Center Psychiatry Service und dem Harbor-UCLA Medical Center, Los Angeles, Kalifornien; der Abteilung für Psychiatrie der University of Iowa College of Medicine, Iowa City, Iowa; und dem National Institute of Neurological Disorders and Stroke, Bethesda, Maryland. Korrespondenz an Dr. Cummings, Reed Neurological Research Center, UCLA School of Medicine, 710 Westwood Plaza, Los Angeles, CA 90095-1769.
1. Marin RS: Differentialdiagnose und Klassifikation der Apathie. Am J Psychiatry 1990; 147:22-30Crossref, Medline, Google Scholar
2. American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders, 4. Auflage. Washington, DC, American Psychiatric Association, 1994Google Scholar
3. Hamilton M: A rating scale for depression. J Neurol Neurosurg Psychiatry 1960; 23:56-62Crossref, Medline, Google Scholar
4. Marin RS, Firinciogullari S, Biedrzycki RC: The sources of convergence between measures of apathy and depression. J Affect Disord 1993; 28:117-124Crossref, Medline, Google Scholar
5. Starkstein SE, Mayberg HS, Preziosi TJ, et al: Reliability, validity, and clinical correlates of apathy in Parkinson’s disease. J Neuropsychiatry Clin Neurosci 1992; 4:134-139Link, Google Scholar
6. Marin RS: Apathy: a neuropsychiatric syndrome. J Neuropsychiatry Clin Neurosci 1991; 3:243-254Link, Google Scholar
7. Marin RS, Firinciogullari S, Biedrzycki RC: Group differences in the relationship between apathy and depression. J Nerv Ment Dis 1994; 182:235-239Crossref, Medline, Google Scholar
8. Marin RS, Biedrzycki RC, Firinciogullari S: Reliability and validity of the apathy evaluation scale. Psychiatry Res 1991; 38:143-162Crossref, Medline, Google Scholar
9. Levy ML, Miller BL, Cummings JL, et al: Alzheimer disease and frontotemporal dementias: behavioral distinctions. Arch Neurol 1996; 53:687-690Crossref, Medline, Google Scholar
10. Mega MS, Cummings JL, Fiorello T, et al: The spectrum of behavioral changes in Alzheimer’s disease. Neurology 1996; 46:130-135Crossref, Medline, Google Scholar
11. Litvan I, Mega MS, Cummings JL, et al: Neuropsychiatrische Aspekte der progressiven supranukleären Lähmung. Neurology 1996; 47:1184-1189Crossref, Medline, Google Scholar
12. Bozzola FG, Gorelick PB, Freels S: Persönlichkeitsveränderungen bei der Alzheimer-Krankheit. Arch Neurol 1992; 49:297-300Crossref, Medline, Google Scholar
13. Devanand DP, Brockington CD, Moody BJ, et al: Behavioral syndromes in Alzheimer’s disease. International Psychogeriatrics 1992; 4(suppl)2:161-184Google Scholar
14. Cummings JL, Mega M, Gray K, et al: The Neuropsychiatric Inventory: comprehensive assessment of psychopathology in dementia. Neurology 1994; 44:2308-2314Crossref, Medline, Google Scholar
15. McKhann G, Drachman D, Folstein M, et al: Clinical diagnosis of Alzheimer’s disease: report of the NINCDS-ADRDA work group under the auspices of Department of Health and Human Services Task Force on Alzheimer’s Disease. Neurology 1984; 34:939-944Crossref, Medline, Google Scholar
16. Brun A, Englund B, Gustafson L, et al: Consensus statement: Klinische und neuropathologische Kriterien für die frontotemporale Demenz: die Lund- und Manchester-Gruppe. J Neurol Neurosurg Psychiatry 1994; 57:416-418Crossref, Medline, Google Scholar
17. Litvan I, Agid Y, Jankovic J, et al: Accuracy of clinical criteria for the diagnosis of progressive supranuclear palsy (Steele-Richardson-Olszewski syndrome): report of the NINDS-SPSP International Workshop. Neurology 1996; 47:1-9Crossref, Medline, Google Scholar
18. Blin J, Baron JC, Dubois B, et al: Positronen-Emissions-Tomographie-Studie bei progressiver supranukleärer Lähmung. Hirnhypometabolisches Muster und klinisch-metabolische Korrelationen. Arch Neurol 1990; 47:747-752Crossref, Medline, Google Scholar
19. Folstein MF, Folstein SE, McHugh PR: „Mini-Mental State“: eine praktische Methode zur Beurteilung des kognitiven Zustands von Patienten für den Kliniker. J Psychiatr Res 1975; 12:189-198Crossref, Medline, Google Scholar
20. Starkstein SE, Fedoroff JP, Price TR, et al: Apathy following cerebrovascular lesions. Stroke 1993; 24:1625-1630Crossref, Medline, Google Scholar
21. Ott BR, Noto RB, Fogel BS: Apathie und Verlust der Einsichtsfähigkeit bei der Alzheimer-Krankheit: eine SPECT-Bildgebungsstudie. J Neuropsychiatry Clin Neurosci 1996; 8:41-46Link, Google Scholar
22. Paulsen JS, Stout JC, DeLaPena J, et al: Frontale Verhaltenssyndrome bei kortikalen und subkortikalen Demenzen. Assessment 1996; 3:327-337Crossref, Google Scholar
23. Craig AH, Cummings JL, Fairbanks L, et al: Cerebral blood flow correlates of apathy in Alzheimer disease. Arch Neurol 1996; 53:1116-1120Crossref, Medline, Google Scholar
24. Cooper JK, Mungas D, Weiler PG: Relation of cognitive status and abnormal behaviors in Alzheimer’s disease. J Am Geriatr Soc 1990; 38:867-870Crossref, Medline, Google Scholar
25. Sultzer DL, Levin HS, Mahler ME, et al: Assessment of cognitive, psychiatric, and behavioral disturbances in patients with dementia: the Neurobehavioral Rating Scale. J Am Geriatr Soc 1992; 40:549-555Crossref, Medline, Google Scholar
26. Starkstein SE, Robinson RG: Depression in cerebrovascular disease, in Depression in Neurologic Disease, edited by Starkstein SE, Robinson RG. Baltimore, Johns Hopkins University Press, 1993, S. 28-49Google Scholar
27. Baxter LR, Schwartz JM, Phelps ME, et al: Reduction of prefrontal cortex glucose metabolism common to three types of depression. Arch Gen Psychiatry 1989; 46:243-250Crossref, Medline, Google Scholar
28. Mayberg HS, Starkstein SE, Sadzot B, et al: Selective hypometabolism in the inferior frontal lobe in depressed patients with Parkinson’s disease. Ann Neurol 1990; 28:57-64Crossref, Medline, Google Scholar
29. Ring HA, Bench CJ, Trimble MR, et al: Depression in Parkinson’s disease: a positron emission study. Br J Psychiatry 1994; 165:333-339Crossref, Medline, Google Scholar
30. Mayberg HS: Neuroimaging studies of depression in neurologic disease, in Depression in Neurologic Disease, edited by Starkstein SE, Robinson RG. Baltimore, Johns Hopkins University Press, 1993, pp 186-216Google Scholar
31. Cummings JL: Frontal-subcortical circuits and human behavior. Arch Neurol 1993; 50:873-880Crossref, Medline, Google Scholar
32. Duffy JD: Die neuronalen Substrate der Motivation. Psychiatric Annals 1997; 27:24-29Crossref, Google Scholar
33. Marin RS: Apathie: Konzept, Syndrom, neuronale Mechanismen und Behandlung. Seminars in Clinical Neuropsychiatry 1996; 1:304-314Medline, Google Scholar
34. Marin RS, Fogel BS, Hawkins J, et al: Apathy: a treatable syndrome. J Neuropsychiatry Clin Neurosci 1995; 7:23-30Link, Google Scholar
35. Watanabe MD, Martin EM, DeLeon OA, et al: Erfolgreiche Methylphenidat-Behandlung der Apathie nach subkortikalen Infarkten. J Neuropsychiatry Clin Neurosci 1995; 7:502-504Link, Google Scholar
36. Kaufer DI, Cummings JL, Christine D: Effect of tacrine on behavioral symptoms in Alzheimer’s disease: an open-label study. J Geriatr Psychiatry Neurol 1996; 9:1-6Crossref, Medline, Google Scholar
37. Logsdon RG, Teri L: Depression bei Patienten mit Alzheimer-Krankheit: Pfleger als Ersatzberichterstatter. J Am Geriatr Soc 1995; 43:150-155Crossref, Medline, Google Scholar