Basicidad de las aminas heterocíclicas
Cuando un átomo de nitrógeno se incorpora directamente a un anillo aromático, su basicidad depende del contexto de enlace. En un anillo de piridina, por ejemplo, el par solitario del nitrógeno ocupa un orbital híbrido sp2, y no forma parte del sexteto aromático – es esencialmente un nitrógeno imina. Su par de electrones está disponible para formar un enlace con un protón, por lo que el átomo de nitrógeno de la piridina es algo básico.

En un anillo de pirrol, por el contrario, el par solitario de nitrógeno forma parte del sexteto aromático. Esto significa que estos electrones son muy estables justo donde están (en el sistema aromático), y están mucho menos disponibles para unirse a un protón (y si recogen un protón, el sistema aromático se destruye). Por estas razones, los nitrógenos del pirrol no son fuertemente básicos.

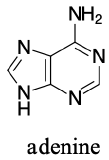
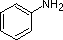
Los ejemplos de la anilina, la piridina y el pirrol son buenos modelos para predecir la reactividad de los átomos de nitrógeno en sistemas de anillos más complejos (una enorme diversidad de los cuales se encuentran en la naturaleza). La cadena lateral del triptófano, por ejemplo, contiene un nitrógeno no básico «tipo pirrol», mientras que la adenina (una base del ADN/ARN) contiene los tres tipos.

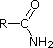
Los electrones del par solitario del nitrógeno de un nitrilo están contenidos en un orbital híbrido sp. El carácter 50% s de un orbital híbrido sp significa que los electrones están cerca del núcleo y, por lo tanto, no son significativamente básicos.
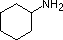
Un repaso de los conceptos básicos de ácido-base debería ser útil para la siguiente discusión. Al igual que el amoníaco, la mayoría de las aminas son bases de Brønsted y de Lewis, pero su fuerza de base puede cambiar enormemente por los sustituyentes. Es habitual comparar cuantitativamente las basicidades utilizando los pKa de sus ácidos conjugados en lugar de sus pKb. Dado que pKa + pKb = 14, cuanto más alto sea el pKa más fuerte será la base, en contraste con la habitual relación inversa del pKa con la acidez. La mayoría de las aminas alquílicas simples tienen pKa en el rango de 9,5 a 11,0, y sus soluciones acuosas son básicas (tienen un pH de 11 a 12, dependiendo de la concentración). Los cuatro primeros compuestos de la siguiente tabla, incluido el amoníaco, entran en esa categoría.
Los últimos cinco compuestos (celdas coloreadas) son bases significativamente más débiles como consecuencia de tres factores. El primero de ellos es la hibridación del nitrógeno. En la piridina el nitrógeno está hibridado sp2, y en los nitrilos (última entrada) un nitrógeno híbrido sp forma parte del triple enlace. En cada uno de estos compuestos (sombreados en rojo) el par de electrones no enlazantes se localiza en el átomo de nitrógeno, pero el aumento del carácter s lo acerca al núcleo del nitrógeno, reduciendo su tendencia a enlazarse con un protón.
|
Compuesto |
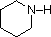 |
 |
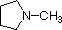 |
NH3 |  |
 |
 |
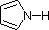 |
 |
CH3C≡N | pKa | 11.0 | 10,7 | 10,7 | 9,3 | 5.2 | 4,6 | 1,0 | 0,0 | -1,0 | -10. |
|---|
Basicidad de las aminas comunes (pKa de los iones de amonio conjugados)
Por último, la bajísima basicidad del pirrol (sombreado en azul) refleja la excepcional deslocalización del par de electrones del nitrógeno asociada a su incorporación en un anillo aromático. El indol (pKa = -2) y el imidazol (pKa = 7,0), véase más arriba, también tienen anillos aromáticos heterocíclicos similares. El imidazol es más de un millón de veces más básico que el pirrol porque el nitrógeno sp2 que forma parte de un doble enlace es estructuralmente similar a la piridina, y tiene una basicidad comparable.
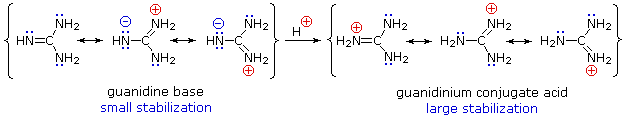
Aunque la deslocalización por resonancia generalmente reduce la basicidad de las aminas, un ejemplo dramático del efecto inverso se encuentra en el compuesto guanidina (pKa = 13,6). Aquí, como se muestra a continuación, la estabilización por resonancia de la base es pequeña, debido a la separación de cargas, mientras que el ácido conjugado se estabiliza fuertemente por deslocalización de cargas. En consecuencia, las soluciones acuosas de guanidina son casi tan básicas como las soluciones de hidróxido de sodio.