20 de agosto de 2018
Cánula nasal de alto flujo (HFNC) – Parte 1: Cómo funciona
 El uso de la cánula nasal de alto flujo calentada y humidificada (HFNC) se ha hecho cada vez más popular en el tratamiento de pacientes con insuficiencia respiratoria aguda a través de todos los grupos de edad. Empecé a utilizarla como becario de cuidados intensivos pediátricos, pero tenía pocos conocimientos sobre su funcionamiento real. Unos años después de utilizarlo con éxito en niños, principalmente con bronquiolitis grave, me di cuenta de que empezamos a utilizarlo también en la unidad de cuidados intensivos de adultos. Parece que en los últimos años han salido muchos estudios que revisan los mecanismos de acción así como su uso en una variedad de condiciones. En esta parte resumiremos cómo funciona y para la parte 2 discutiremos las principales indicaciones para su uso en pacientes adultos y pediátricos.
El uso de la cánula nasal de alto flujo calentada y humidificada (HFNC) se ha hecho cada vez más popular en el tratamiento de pacientes con insuficiencia respiratoria aguda a través de todos los grupos de edad. Empecé a utilizarla como becario de cuidados intensivos pediátricos, pero tenía pocos conocimientos sobre su funcionamiento real. Unos años después de utilizarlo con éxito en niños, principalmente con bronquiolitis grave, me di cuenta de que empezamos a utilizarlo también en la unidad de cuidados intensivos de adultos. Parece que en los últimos años han salido muchos estudios que revisan los mecanismos de acción así como su uso en una variedad de condiciones. En esta parte resumiremos cómo funciona y para la parte 2 discutiremos las principales indicaciones para su uso en pacientes adultos y pediátricos.
La cánula nasal de alto flujo calentado y humidificado o como la mayoría la llama, cánula nasal de alto flujo (HFNC), no es sólo una cánula nasal estándar aumentada a tasas de flujo muy altas. En realidad, toma gas y puede calentarlo a 37 o C con una humedad relativa del 100% y puede suministrar 0,21 – 1,00% de fi02 a caudales de hasta 60 litros/min. El flujo y la fi02 pueden ser titulados independientemente en base a los requerimientos de flujo y fi02 de su paciente.

Hay 2 empresas principales, que fabrican estos dispositivos: Vapotherm, que tiene un dispositivo que puede suministrar caudales de hasta 50 litros/min y Fisher Paykall, que ofrece tanto el Optiflow como el AIRVO 2, que pueden suministrar caudales de hasta 60 litros/min.
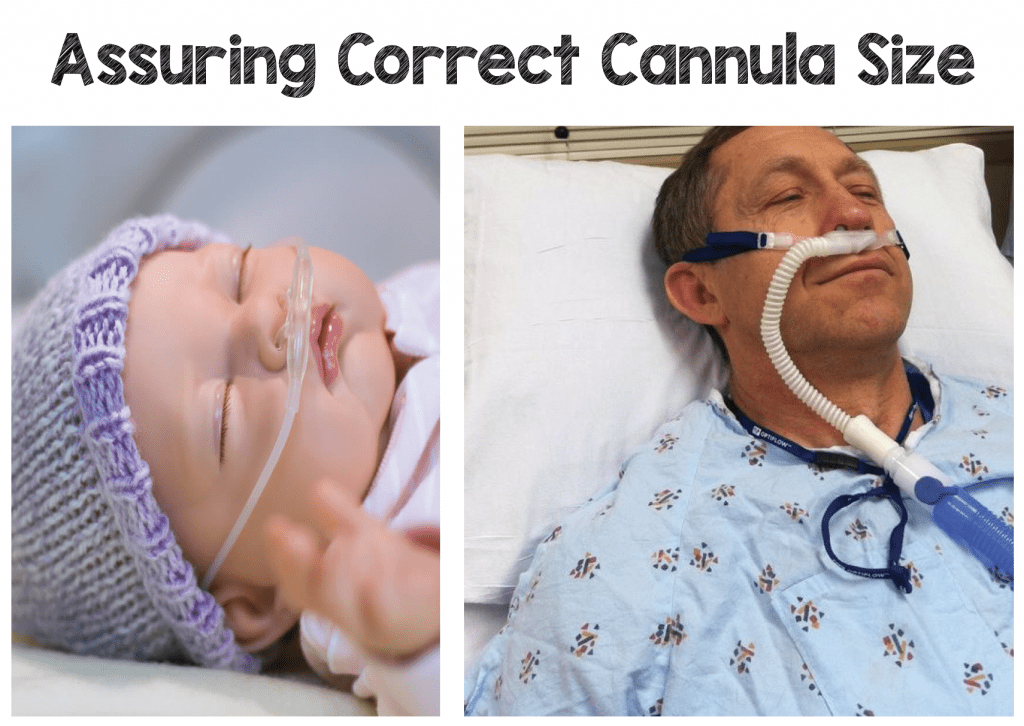
 Cada empresa ofrece tamaños de cánula más pequeños para neonatos prematuros, así como para niños de diversas edades, hasta cánulas para adultos. Cada cánula debe encajar perfectamente en las fosas nasales del paciente y evitar el arrastre del aire ambiente alrededor de la cánula, lo que puede ocurrir con las cánulas nasales estándar. Cada fabricante tendrá también un caudal máximo para cada tamaño de cánula correspondiente al tamaño y la edad del paciente.
Cada empresa ofrece tamaños de cánula más pequeños para neonatos prematuros, así como para niños de diversas edades, hasta cánulas para adultos. Cada cánula debe encajar perfectamente en las fosas nasales del paciente y evitar el arrastre del aire ambiente alrededor de la cánula, lo que puede ocurrir con las cánulas nasales estándar. Cada fabricante tendrá también un caudal máximo para cada tamaño de cánula correspondiente al tamaño y la edad del paciente.
Cómo funciona:
Oxígeno calentado &
Oxígeno humidificado:
El oxígeno calentado y humidificado tiene una serie de beneficios en comparación con la terapia de oxígeno estándar. La oxigenoterapia estándar suministrada a través de una cánula nasal u otro dispositivo, como un no respirador, es fría (no calentada) y seca (no humidificada). Esto puede provocar la inflamación de las vías respiratorias, lo que puede aumentar la resistencia de las vías respiratorias y perjudicar la función mucociliar, lo que puede provocar una disminución de la eliminación de las secreciones (1). Además, los individuos pueden gastar una cantidad significativa de calorías para calentar y humidificar el gas durante la respiración normal (2).
La HFNC puede calentar (hasta 37oC) y humidificar el gas, lo que puede disminuir la inflamación de las vías respiratorias, mantener la función mucociliar, mejorar el aclaramiento de la mucosa y reducir el gasto calórico en la insuficiencia respiratoria aguda (1-2).
Demanda respiratoria:
Un beneficio obvio, pero que vale la pena mencionar, es que el alto flujo puede proporcionar un flujo de gas muy alto. Esto es importante, ya que los pacientes con insuficiencia respiratoria aguda pueden ser extremadamente taquipneicos y, por lo tanto, sus flujos inspiratorios máximos, que normalmente pueden ser de 30 L/min – 60 L/min, pueden alcanzar hasta 120 L/min (3). Así que si usted coloca a su paciente taquipneico con una tasa de PIF de 120L/min y un volumen minuto >20L/min en una máscara NRB de 15L/min, puede que no le esté ayudando tanto como cree. Voy a entrar en este punto un poco más adelante en esta revisión cuando discutamos el concepto de dilución de oxígeno.
Capacidad Residual Funcional:
Puede que haya estado buscando la viñeta que dice que el Hi Flow proporciona PEEP y no la encuentra? Se ha debatido sobre la cantidad real de PEEP que puede proporcionar un dispositivo de alto flujo. Se ha demostrado que el HFNC proporciona hasta 1 mm de Hg de PEEP por cada 10L/min de flujo suministrado con la respiración bucal cerrada. (4-5)
No estoy seguro de que esto sea cierto para todos los pacientes, y esto se debe a que hay muchos factores que pueden afectar a la cantidad de PEEP que realmente se puede administrar a un paciente. Factores como el tamaño del paciente (obeso, adulto, niño), la tasa de flujo de un litro que se suministra (L/Min) y la respiración con la boca abierta frente a la respiración con la boca cerrada (la presión puede escapar cuando la boca del paciente está abierta) pueden afectar a la cantidad de PEEP que se suministra (4)
El debate puede continuar, pero parece que la HFNC puede aumentar el volumen residual funcional (FRC) de un paciente o el volumen pulmonar al final de la espiración, algo que la PEEP suele mejorar. Un estudio realizado por Riera J. et al. demostró que el uso de la HFNC aumentó la impedancia pulmonar al final de la espiración (EELI), lo que implica una mejora del FRC (6). Utilizaron la Tomografía de Impedancia Eléctrica (TIE), un método de imagen no invasivo y en tiempo real que proporciona una imagen de ventilación transversal del pulmón para demostrar un aumento de la Impendencia Pulmonar Espiratoria Final (EELI).
También parece que el uso de HFNC puede disminuir la precarga al aumentar la presión intratorácica, de nuevo otra característica comúnmente atribuida a la PEEP. Roca et al demostraron en un estudio de intervalos secuenciales en 10 pacientes (insuficiencia cardíaca NYHA III pero no en una exacerbación aguda de la ICC) que el uso de Hi Flow provocaba un colapso inspiratorio de la vena cava inferior (VCI) respecto a la línea de base de los pacientes medido por ecocardiograma (7).
El Hi Flow parece provocar un reclutamiento alveolar y un aumento de la FRC, así como un incremento de la presión intratorácica, probablemente como resultado de la PEEP añadida, aunque no se sabe con certeza si tal vez otro mecanismo puede ser el responsable de estos hallazgos.
Más ligero:
Los pacientes suelen preferir el uso de la HFNC al de la ventilación con presión positiva no invasiva (CPAP o BPAP) porque la máscara ajustada puede resultar incómoda para algunos pacientes. Incluso pueden preferirla a la NC estándar porque los gases calentados y humidificados no resecan su mucosa como la oxigenoterapia estándar (5). Esto puede conducir a un mayor cumplimiento con la HFNC y quizás a una mejora en la oxigenación y el trabajo de respiración de su paciente.
Dilución de O2:
Me enseñaron en mi rotación en la UCI como interno que cada 1 litro de cánula nasal entregará ~4% de fiO2 por encima del aire ambiente (21%). Por lo tanto, 1 litro/min a través de la CN debería suministrar ~ 25% de fi02, y 2 litros/min deberían suministrar 29% de fiO2 (véase la Tabla 1 a continuación). Durante años creí que esta «regla de 1:4» era cierta, pero veamos si tiene sentido para un paciente con dificultad respiratoria aguda

Imagínese a un varón de 70 kg que respira a 30-40 lpm con volúmenes tidales normales (~500 mL’s) y desarrolla cierta hipoxemia. La ventilación minuto de este paciente estaría entre 15-20 litros/minuto. Usted decide poner a este paciente en 6 litros/minuto de NC, lo que teóricamente debería proporcionar una fiO2 de ~ 45% (6L x 4% = 24 + Aire ambiente (21%) = 45%) si se cumple la «regla de 1:4». Si este paciente respira 15-20L por la boca y por las fosas nasales (alrededor de la cánula nasal) al 21%, ¿cree que este paciente recibirá realmente un 45% de fiO2 en la tráquea?
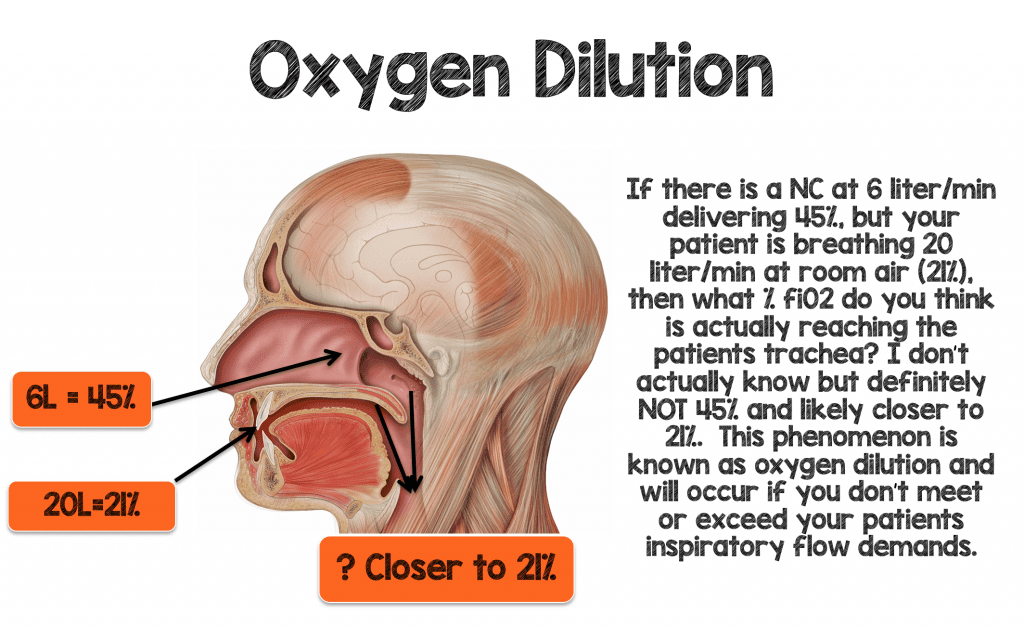
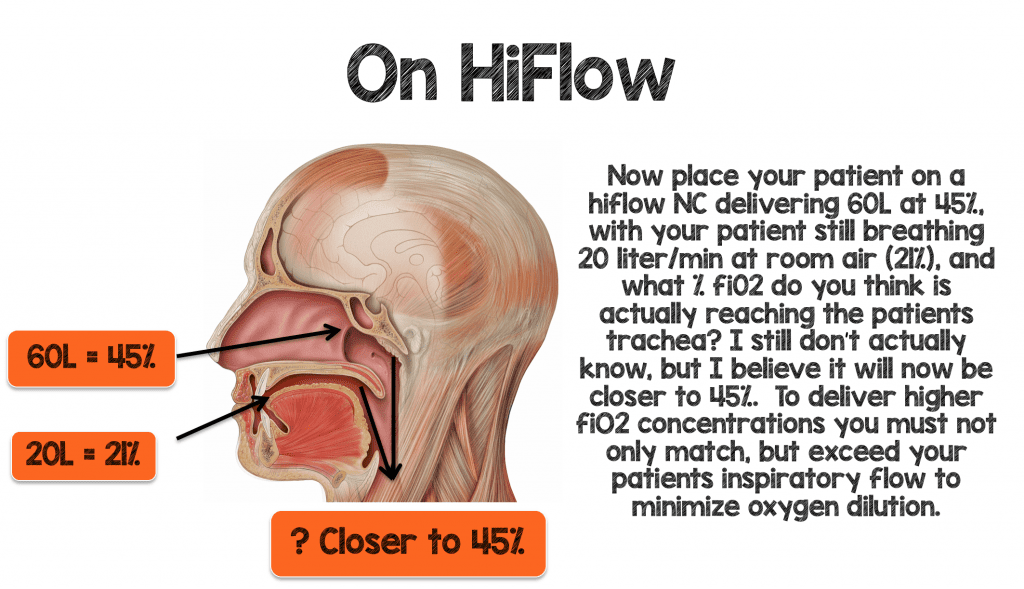
Para suministrar mayores cantidades de fiO2 de forma eficaz a su paciente, no sólo tiene que igualar, sino superar las demandas inspiratorias y de ventilación por minuto de su paciente para minimizar la dilución de oxígeno.
Limpieza del espacio muerto:
Normalmente volvemos a respirar un tercio de nuestro volumen tidal previamente expirado y en lugar de respirar un 21% (aire ambiente) y cantidades insignificantes de dióxido de carbono; podemos volver a respirar más bien un 15-16% de oxígeno y un 5-6% de dióxido de carbono. Esto se debe a que la respiración exhalada previamente (con poco oxígeno y algo de dióxido de carbono) no se exhala completamente y permanece en la vía aérea superior. Cuando el paciente toma su siguiente respiración de gas atmosférico no todo ese gas entra en los alvéolos. De hecho, es una mezcla del nuevo gas atmosférico (21% 02, CO2 insignificante) y su gas previamente exhalado (<21% de oxígeno y algo de CO2). En los pacientes con insuficiencia respiratoria aguda, el porcentaje de gas que volvemos a respirar es mayor y, en consecuencia, podemos volver a respirar mayores cantidades de dióxido de carbono al extraer nuestras respiraciones de un depósito mixto de nuestra vía aérea superior. Otra forma de decir esto es que nuestro espacio muerto aumenta con la insuficiencia respiratoria aguda.
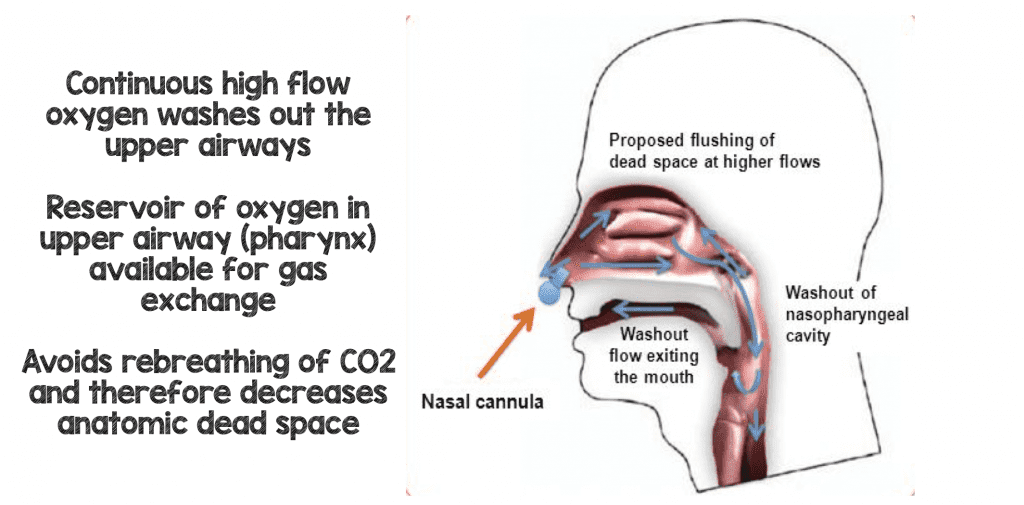
Uno de los principales beneficios de la HFNC (algunos argumentan que es realmente el principal beneficio) es que le da un flujo continuo de gas fresco a altas tasas de flujo reemplazando o lavando el espacio muerto faríngeo del paciente (el viejo gas bajo en oxígeno y alto en CO2). Cada respiración que el paciente vuelve a realizar ahora será lavada de dióxido de carbono y sustituida por gas rico en oxígeno mejorando la eficiencia respiratoria (8).

Post invitado co-escrito por

Thomas Lettich, D.O.
Médico residente de Medicina Interna/Pediatría
Centro Médico Geisinger
Danville, Pensilvania
- Chidekel, A et al. The Effects of Gas Humidification with High-Flow Nasal Cannula on Cultured Human Airway Epithelial Cells. Medicina pulmonar 2012. PMID: 22988501
- Dysart, K et al. Research in High Flow Therapy: Mecanismos de Acción. Medicina respiratoria 2009. PMID: 19467849
- Katz, JA et al. Trabajo inspiratorio con y sin presión positiva continua en las vías respiratorias en pacientes con insuficiencia respiratoria aguda. Anesthesiology 1985. PMID: 3904528
- Parke R et al. Presiones suministradas por el oxígeno de alto flujo nasal durante todas las fases del ciclo respiratorio. Cuidados respiratorios 2013. PMID: 23513246
- Frat JP et al. Terapia de oxígeno nasal de alto flujo y ventilación no invasiva en el manejo de la insuficiencia respiratoria aguda hipoxémica. Anales de medicina traslacional 2017). PMID: 28828372
- Riera J et al. Efecto de la cánula nasal de alto flujo y la posición del cuerpo en el volumen pulmonar final: Un estudio de cohortes mediante tomografía de impedancia eléctrica. Medicina respiratoria 2013. PMID: 23050520
- Roca O et al. Patients with New York Heart Association Class III Heart Failure may Benefit with High Flow Nasal Cannula Supportive Therapy: High Flow Nasal Cannula in Heart Failure. Journal Crit Care 2013. PMID: 23602035
- Möller W et al. El alto flujo nasal despeja el espacio muerto anatómico en modelos de vía aérea superior. Revista de fisiología aplicada 2015). PMID: 25882385
Apoye el espectáculo pagando & Reclamando 0,5hrs de CME/CEH haciendo clic en el logotipo de abajo

Post revisado por pares por: Salim R. Rezaie, MD (Twitter: @srrezaie)
- Bio
- Últimas publicaciones
Frank Lodeserto MD
- El ensayo RELAx: ¿Cuál es la PEEP óptima en pacientes sin SDRA? – 1 de febrero de 2021
- Actualización de COVID-19: La vacuna de Pfizer COVID-19 – 15 de diciembre de 2020
- Linfohistiocitosis Hemofagocítica (HLH): Un diagnóstico de cebra que todos deberíamos conocer – 30 de julio de 2020