Síntesis, nomenclatura y propiedades del grupo funcional amida
En este post, intentaremos proporcionar una amplia visión general de las amidas. Proporcionaremos un breve resumen de la nomenclatura de las amidas, dos propiedades importantes de las amidas que difieren en gran medida de las aminas, y repasaremos tres estrategias clave para la síntesis de amidas.
Tabla de contenidos
- Nomenclatura del grupo funcional amida: Amidas primarias, secundarias y terciarias
- Amidas vs Aminas: Menos básicas, más ácidas
- Síntesis de amidas, parte 1. Sustitución nucleofílica de haluros de acilo (o anhídridos) con aminas
- Síntesis de amidas, parte 2: hidrólisis parcial de nitrilos
- Síntesis de amidas, parte 3: Uso De Un Reactivo Deshidratante (Como El DCC)
- Resumen: Tres Métodos Efectivos Para La Síntesis De Amidas
- Consideremos Brevemente Un Cuarto Método Menos Importante: La fuerza bruta
- Notas
- ¡Consúltese a sí mismo!
- Referencias (avanzadas) y lecturas adicionales
1. Nomenclatura del grupo funcional amida: Amidas primarias, secundarias y terciarias
Las «amidas» son lo que llamamos a una amina que tiene un único grupo carbonilo unido. El grupo funcional amida es a las aminas lo que los ésteres son a los alcoholes.
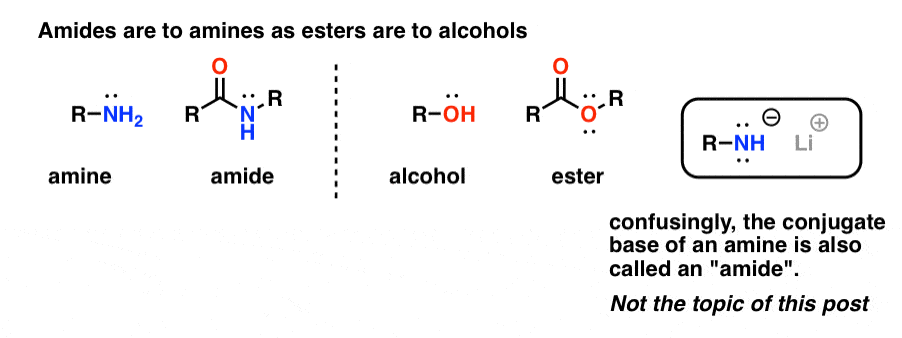
Confusamente, la palabra «amida» también se utiliza para referirse a la base conjugada de las aminas, como la amida de sodio (NaNH2) y la di-isopropilamida de litio (LDA). Estas últimas se diferencian a veces refiriéndose a ellas como «bases amidas». Otros utilizan una pronunciación ligeramente diferente para diferenciarlas (ayyy-myde y aaah-midd). Como con cualquier otro homónimo, la clave es el contexto.
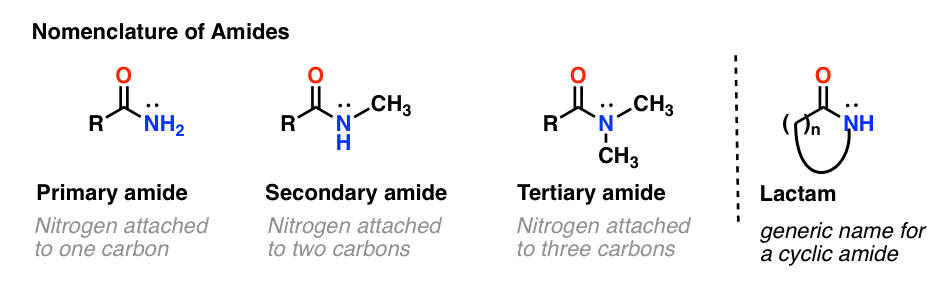
Al igual que con las aminas, la nomenclatura utilizada para una amida depende del número de carbonos unidos al nitrógeno.
Una amida primaria (1°) tiene el nitrógeno unido a un solo carbono; una amida secundaria (2°) tiene el nitrógeno unido a dos carbonos; una amida terciaria (3°) tiene el nitrógeno unido a tres carbonos. Una amida cíclica se denomina lactama.
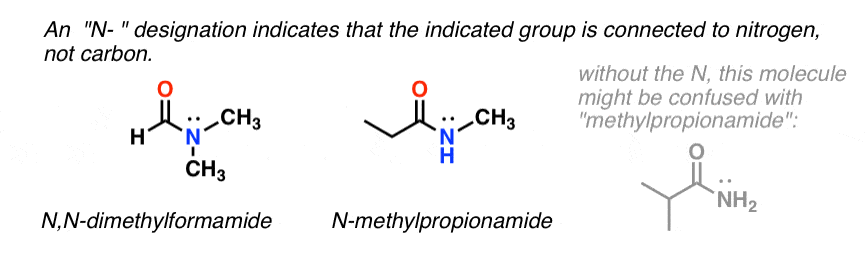
Cuando el nitrógeno de la amida tiene sustituyentes distintos del hidrógeno, los especificamos utilizando el prefijo N- para evitar confusiones. Por ejemplo, la N-metilpropionamida especifica la unión de un grupo metilo en el nitrógeno; sin el prefijo N-, se podría asumir que el grupo metilo está unido al carbono, lo que sería una molécula completamente diferente.
Amidas vs Aminas: Menos básicas, más ácidas
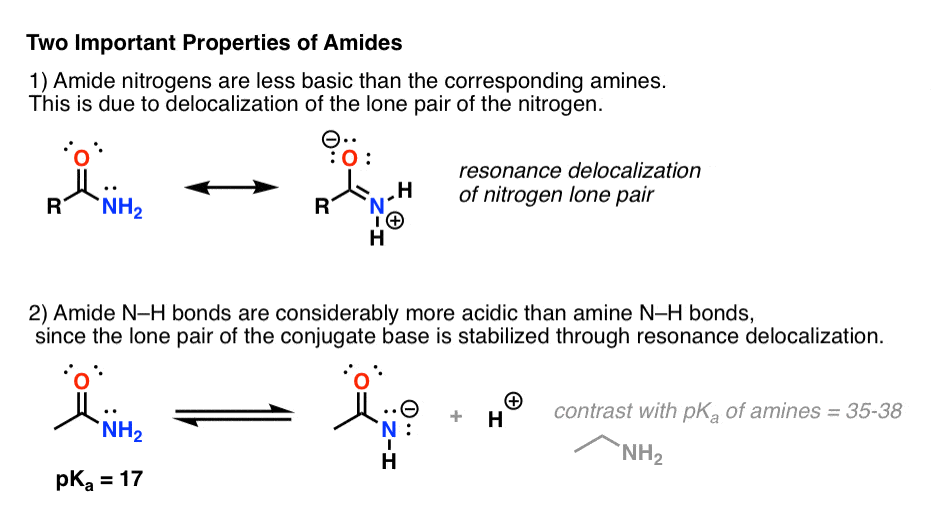
Añadir un grupo carbonilo a una amina tiene dos efectos drásticos en las propiedades del nitrógeno.
- En primer lugar, los nitrógenos de las amidas son considerablemente menos básicos que los de las aminas. Eso es principalmente el resultado de la deslocalización del par solitario del nitrógeno en el enlace pi del carbonilo. De hecho, la posición más básica de una amida no es el nitrógeno sino el oxígeno (¡!).
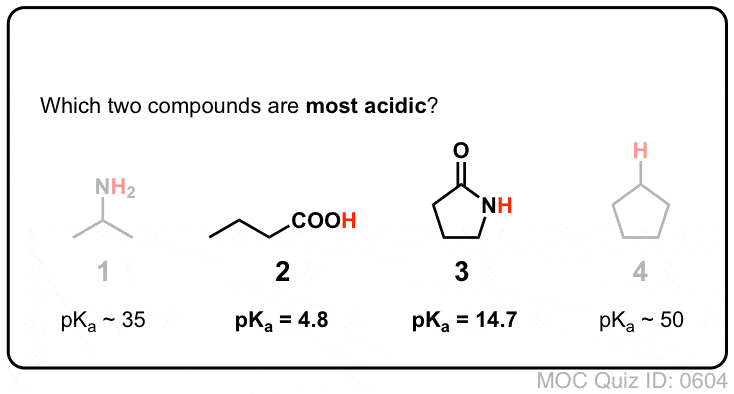
- En segundo lugar, los enlaces N-H de las amidas son mucho más ácidos que los enlaces N-H de las aminas. ¿Por qué? De nuevo la deslocalización. El grupo carbonilo unido permite que el par solitario de la base conjugada se deslocalice por resonancia. El pKa de la acetamida (17) es unos 20 órdenes de magnitud más ácido que el del amoníaco (38).
- FENILACETAMIDA
Wilhelm Wenner
Org Synth. 1952, 32, 92
DOI: 10.15227/orgsyn.032.0092
Las condiciones utilizadas aquí para la hidratación del nitrilo a la amida son bastante suaves – se utiliza una temperatura de 40 °C durante aproximadamente 1 h. - Hidrólisis de nitrilo dirigida por haluro
James M. Photis
Tetrahedron Lett. 1980, 21 (37), 3539-3540
DOI: 10.1016/0040-4039(80)80228-0
Este es un procedimiento útil para la hidrólisis selectiva de nitrilos a amidas primarias, especialmente en el caso de cianuros de aroilo (por ejemplo, PhCOCN). - Conversión fácil y altamente selectiva de nitrilos a amidas mediante hidratación indirecta catalizada por ácido utilizando TFA o AcOH-H2SO4
Jarugu Narasimha Moorthy y Nidhi Singhal
The Journal of Organic Chemistry 2005, 70 (5), 1926-1929
DOI: 10.1021/jo048240aReacción Schotten-Bauman:
#4 y #5 son los trabajos originales de Schotten y Baumann sobre una síntesis de amidas bifásica simple. - Ueber die Oxydation des Piperidins
Schotten, C.
Ber. 1884, 17 (2), 2544-2547
DOI: 10.1002/cber.188401702178 - Ueber eine einfache Methode der Darstellung von Benzoësäureäthern
Baumann, E.
Ber. 1886, 19 (2), 3218-3222
DOI: 10.1002/cber.188601902348 - Síntesis total enantioselectiva de (-)-Kibdelona C
John R. Butler, Chao Wang, Jianwei Bian y Joseph M. Ready
Journal of the American Chemical Society 2011, 133 (26), 9956-9959
DOI: 1021/ja204040k
La humilde reacción de Schotten-Baumann se utiliza incluso en síntesis totales exigentes – ¡en este caso, se utiliza para hacer la lactama en 4 a partir de 5 y 6! - BENZOIL PIPERIDINA
Marvel, C. S.; Lazier, W. A.
Org. Synth. 1929, 9, 16
DOI: 10.15227/orgsyn.009.0016
Este procedimiento de Organic Syntheses, una fuente de procedimientos de laboratorio orgánicos sintéticos reproducibles y probados de forma independiente, es una síntesis de amida clásica de Schotten-Baumann. - Un proceso de alto rendimiento para Valsartan
Ulrich Beutler, Matthias Boehm, Peter C. Fuenfschilling, Thomas Heinz, Jean-Paul Mutz, Ulrich Onken, Martin Mueller y Werner Zaugg
Investigación de procesos orgánicos & Desarrollo 2007, 11 (5), 892-898
DOI: 1021/op700120n
Organic Process & Research Development («OPRD») es una gran revista de química de procesos o de escalado. Este artículo muestra cómo la reacción de Schotten-Baumann (4 a 3) es la preferida para las reacciones a gran escala, ya que es sencilla, robusta, fácil de llevar a cabo y no tiene grandes exotermos (a diferencia de la reacción de Grignard, por ejemplo). - El truco de la cuerda de nailon: Demostración de la polimerización por condensación
Paul W. Morgan y Stephanie L. Kwolek
Journal of Chemical Education 1959, 36 (4), 182
DOI: 1021/ed036p182
El clásico «truco de la cuerda de nailon» en el que se tira de una cuerda de nailon a partir de una mezcla bifásica de hexametilendiamina y cloruro de sebacoyl puede considerarse un tipo de reacción de Schotten-Baumann, ¡en el sentido de que se forma una poliamida! Esto fue desarrollado por primera vez por Stephanie Kwolek, que fue un distinguido químico en DuPont durante más de 40 años y fue responsable de descubrir el Kevlar y desarrollar la química de las aramidas y otros materiales de alta resistencia a la tracción.DCC: - Un nuevo método de formación de enlaces peptídicos
John C. Sheehan y George P. Hess
Journal of the American Chemical Society 1955, 77 (4), 1067-1068
DOI: 1021/ja01609a099
Documento original sobre la síntesis de enlaces peptídicos/amídicos mediante DCC.DeTar ha publicado una serie de trabajos en los que estudia el mecanismo de las reacciones de formación de enlaces mediadas por DCC y otras carbodiimidas, y aquí están los dos primeros: - Reacciones de las carbodiimidas. I. Los mecanismos de las reacciones del ácido acético con la diciclohexilcarbodiimida
DeLos F. DeTar y Richard Silverstein
Journal of the American Chemical Society 1966, 88 (5), 1013-1019
DOI: 10.1021/ja00957a027 - Reacciones de carbodiimidas. II. Reacciones de la diciclohexilcarbodiimida con ácidos carboxílicos en presencia de aminas y fenoles
DeLos F. DeTar y Richard Silverstein
Journal of the American Chemical Society 1966, 88 (5), 1020-1023
DOI:1021/ja00957a028 - La química de las carbodiimidas.
G. Khorana
Chemical Reviews 1953, 53 (2), 145-166
DOI: 10.1021/cr60165a001
Una antigua reseña del profesor Har Gobind Khorana, que posteriormente recibió el Premio Nobel de Medicina por su trabajo de demostración de que los nucleótidos del ADN y el ARN codifican la síntesis de proteínas. - ESTERIFICACIÓN DE ÁCIDOS CARBOXÍLICOS CON DICICLOHEXICARBODIÍMIDO/4-DIMETILAMINOPIRIDINA: tert-BUTIL FUMARATE
Neises y Wolfgang Steglich
Org. Synth. 1985, 63, 183
DOI: 10.15227/orgsyn.063.0183
Este es un procedimiento para la esterificación selectiva usando DCC – esto evita la transesterificación que ocurriría bajo las condiciones habituales de esterificación de Fischer. Este procedimiento es de Organic Syntheses, una fuente de reacciones orgánicas sintéticas fiables y probadas de forma independiente. - Síntesis de péptidos en fase sólida. I. La síntesis de un tetrapéptido
B. Merrifield
Journal of the American Chemical Society 1963, 85 (14), 2149-2154
DOI: 10.1021/ja00897a025
Este es uno de los artículos más citados en JACS, y por una buena razón: básicamente sienta las bases de la SPPS, y de lo que ahora es una industria de mil millones de dólares. Este trabajo dio lugar a un Premio Nobel de Química para su autor, el profesor R. Bruce Merrifield (Universidad Rockefeller). Los acoplamientos de péptidos se realizan utilizando nada menos que DCC. - Notas- Una síntesis conveniente de carbodiimidas solubles en agua.
John Sheehan, Philip Cruickshank y Gregory Boshart
The Journal of Organic Chemistry 1961, 26 (7), 2525-2528
DOI:1021/jo01351a600
El mayor inconveniente con el DCC es que la separación de la DCU (diciclohexilurea) así producida puede ser engorrosa. Por ello, se han desarrollado otros reactivos, como la EDC (1-etil-3-(3′-dimetilaminopropil)carbodiimida), para la que la urea resultante es soluble en agua y se elimina fácilmente por extracción. - Síntesis total de un antibiótico de lactona peptídica monocíclica, la etamicina
John C. Sheehan y Stephen L. Ledis
Journal of the American Chemical Society 1973, 95 (3), 875-879
DOI:1021/ja00784a041
El EDC se utilizó para la mayoría de los acoplamientos peptídicos en la síntesis de este péptido, que es uno de los primeros péptidos cíclicos producidos sintéticamente.
Una tercera propiedad más sutil de las amidas es que suelen tener restringida la rotación sobre el enlace C-N. La forma de resonancia donde hay un enlace C-N hace una contribución tan significativa al híbrido de resonancia que se puede pensar que el enlace C-N tiene «carácter parcial de doble enlace».
Síntesis de amidas, parte 1. Sustitución nucleófila de haluros de acilo (o anhídridos) con aminas
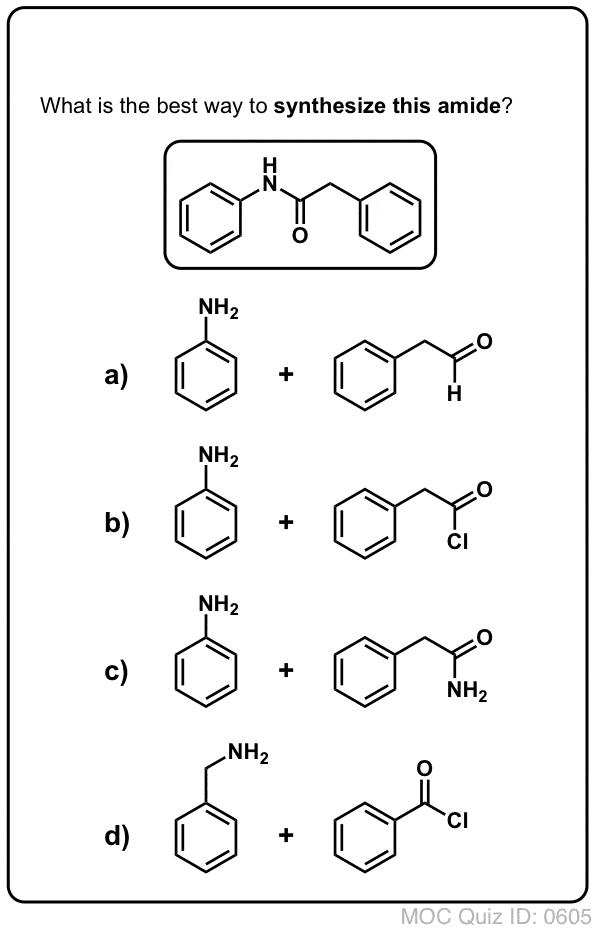
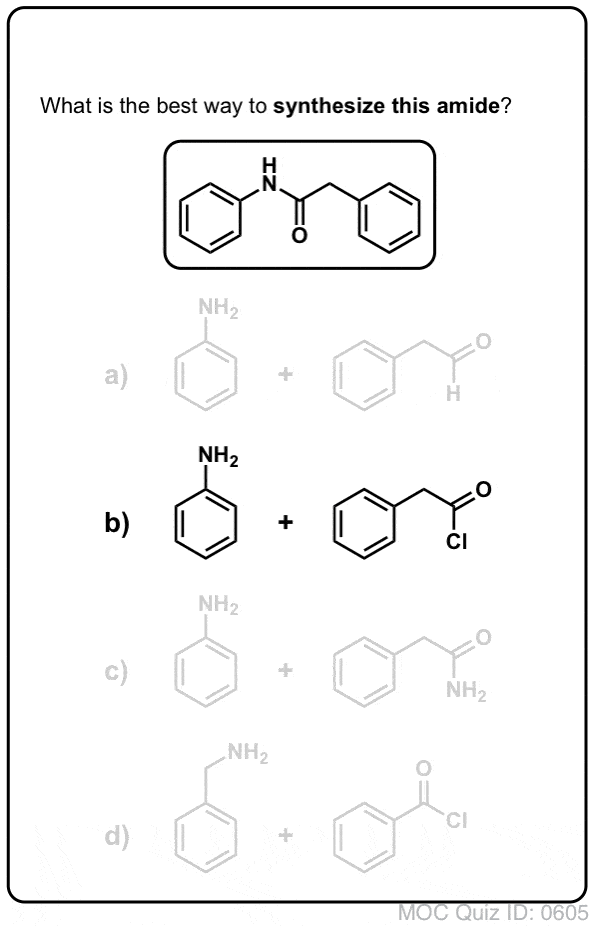
Los grupos acilo unidos a un buen grupo saliente, como los cloruros ácidos o los anhídridos ácidos, pueden sufrir fácilmente una sustitución nucleófila de acilo con nucleófilos de amina.
Si sólo se dispone del ácido carboxílico para empezar, utilizar un reactivo como el cloruro de tionilo (SOCl2) para convertir un ácido carboxílico en un cloruro de ácido es un buen primer paso para transformar un ácido carboxílico en una amida. (También pueden funcionar el PCl3, el PCl5, el cloruro de oxalilo y una serie de otros reactivos). Alternativamente, el tratamiento de un ácido carboxílico con un haluro de acilo proporcionará un anhídrido, que también puede ser eficaz.
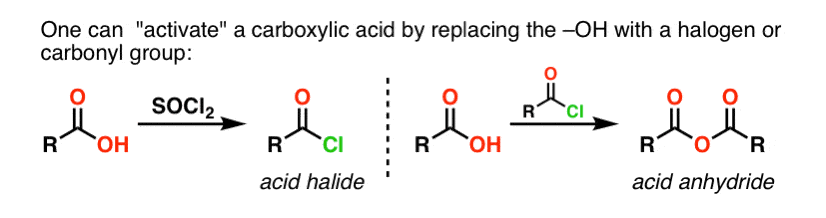
Los haluros (por ejemplo, Cl- ) y los carboxilatos (RCO2- ) son bases mucho más débiles, y por lo tanto mucho mejores grupos de salida que HO-. Así, al añadir una amina a un haluro de acilo o a un anhídrido ácido, puede producirse la sustitución nucleófila del acilo en condiciones mucho más suaves, dando lugar a nuestra amida deseada.
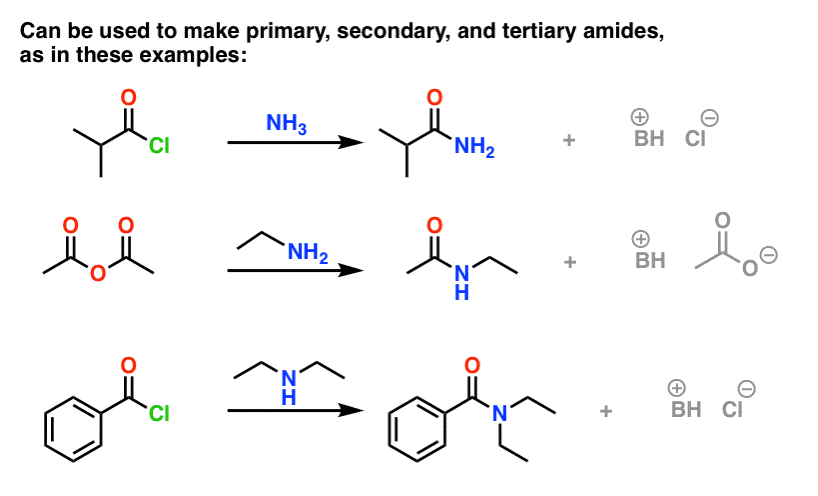
(Se pueden obtener amidas mediante la reacción de ésteres con aminas, pero dado que los alcóxidos son grupos de salida más pobres que los haluros o carboxilatos, este método requiere condiciones más forzadas. )
Una cosa a tener en cuenta con los haluros ácidos es que el proceso genera un único equivalente de HCl como subproducto. En ausencia de cualquier base adicional, el rendimiento máximo del procedimiento sería del 50%, ya que el HCl protonaría cualquier amina y la convertiría en una sal de amonio no nucleófila.
Una forma de asegurar que la reacción procede hasta su finalización es añadir un segundo equivalente de amina. Hay otras formas prácticas de resolver este problema, que he consignado a una nota a pie de página.
Si necesita un repaso del mecanismo de la sustitución nucleófila del acilo pase el ratón por aquí para ver una imagen emergente o abra el enlace de la imagen aquí:
.
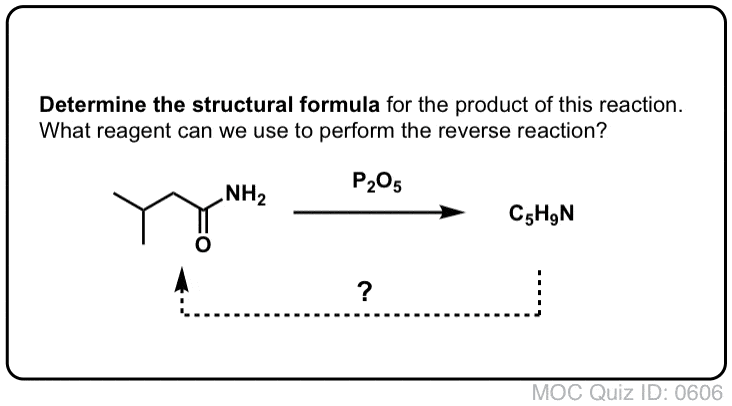
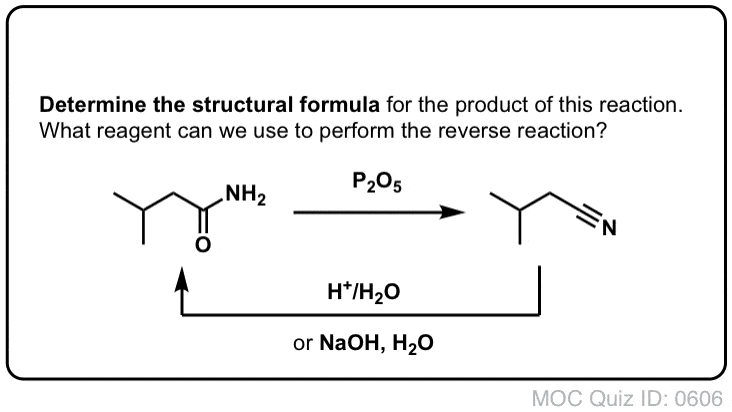
Síntesis de amidas, parte 2: hidrólisis parcial de nitrilos
Una forma de pensar en los nitrilos es que son ácidos carboxílicos enmascarados. Si se tratan con ácido acuoso y mucho calor -condiciones de mazo- pueden hidrolizarse a ácidos carboxílicos.
Uno de los intermedios en este proceso es una amida primaria.
Así que si utilizamos una técnica de mazo un poco más amable y gentil, a veces es posible rescatar la amida de nuestra mezcla de reacción antes de que se hidrolice al ácido carboxílico.
La imagen de abajo muestra cómo se puede sintetizar una amida a partir de un precursor de haluro de alquilo, a través de la buena reacción SN2:
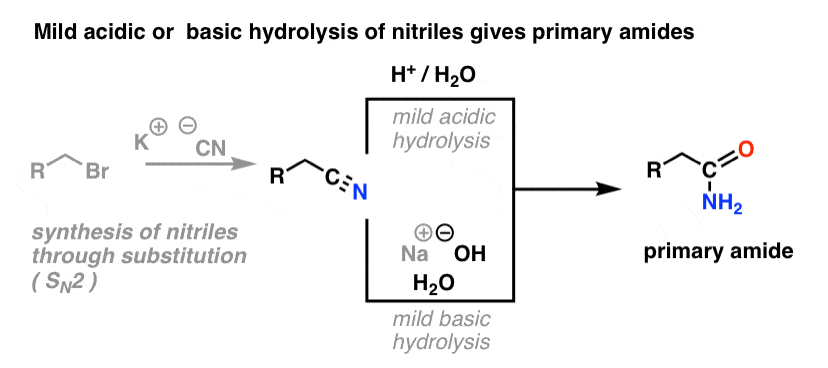
¿Qué se entiende por «suave»? Un conjunto de condiciones para la hidrólisis de fenilacetamida (PhCH2CN) a PhCH2CONH2 da las condiciones de reacción como «HCl, H2O, 40-50°C, 1h «.
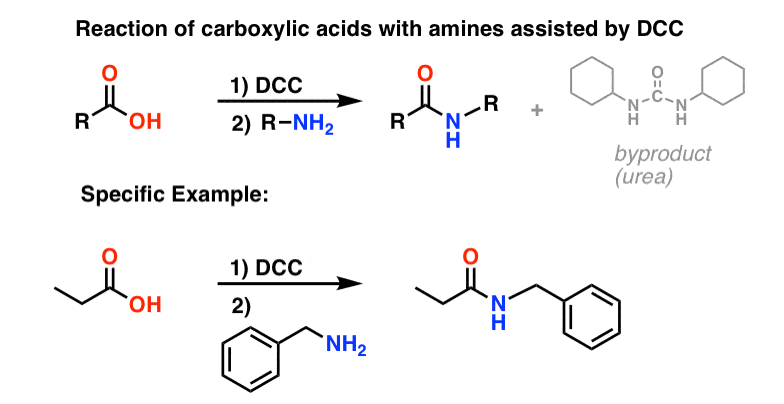
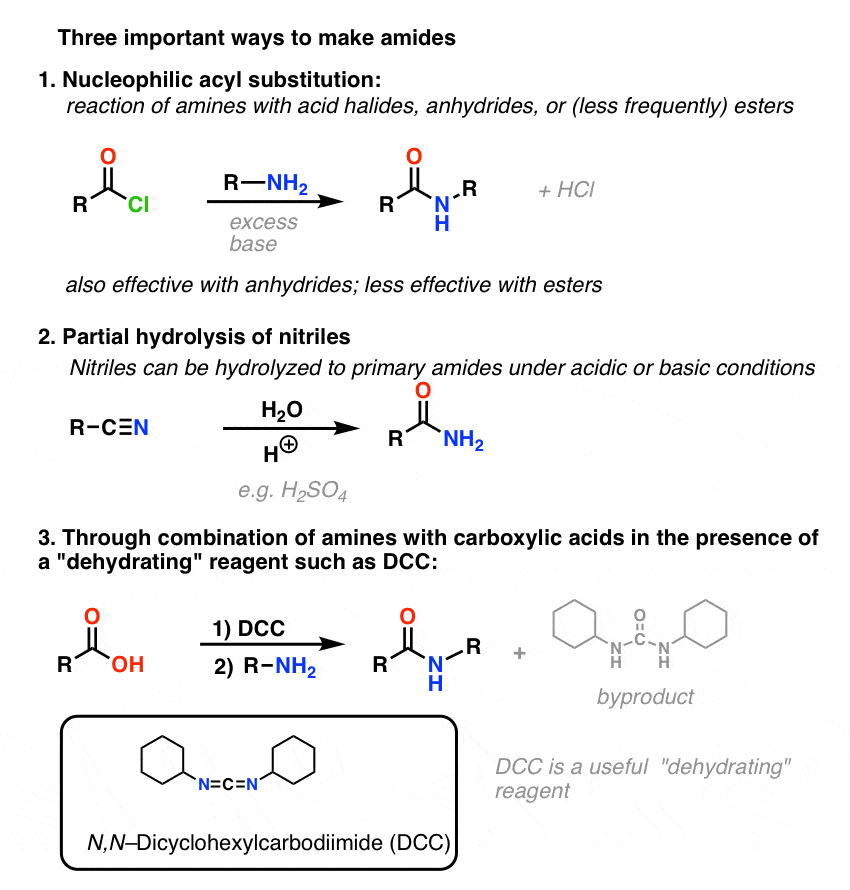
Síntesis de amidas, parte 3: uso de un reactivo deshidratante (como el DCC)
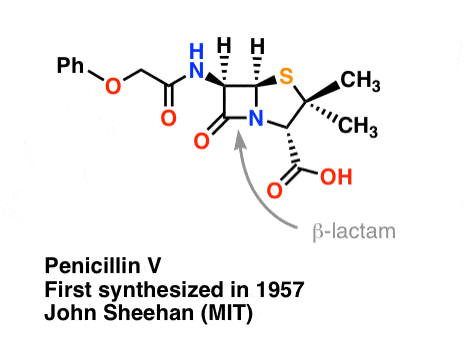
La síntesis de la penicilina V en 1957 por el grupo de John Sheehan en el MIT es uno de los logros heroicos de la química orgánica de la posguerra. El problema clave era la construcción de una amida cíclica (el anillo β-lactámico) que es extremadamente inestable en condiciones ácidas. Esto no era de poca importancia, ya que la β-lactama es también la clave del mecanismo de acción de la penicilina: interferir en la síntesis de la pared celular bacteriana. Los intentos de fabricar esta amida cíclica mediante la conversión de un ácido carboxílico en un haluro de acilo con SOCl2, PCl3, PCl5 y otros muchos métodos fracasaron.
En respuesta, el grupo de Sheehan inventó inteligentemente un reactivo deshidratante muy suave: La N, N’-diclohexilcarbodiimida (DCC), que permitía la formación de amidas en condiciones muy suaves a pH neutro.
Hoy en día, la DCC (y su primo (nota) más práctico, el EDC ) se utilizan ampliamente para la síntesis de amidas sensibles -en particular péptidos- en condiciones muy suaves.
En las condiciones de reacción, el oxígeno del carboxilato se une al carbono electrófilo del DCC, haciendo lo que llamamos un «éster activo» – en otras palabras, un éster que realmente tiene un grupo de salida decente (a diferencia de la mayoría de los ésteres, que no lo tienen). El éster activo es entonces atacado por la amina en una clásica sustitución nucleofílica del acilo, lo que lleva a la formación de la amida.
Mirando el subproducto, observe que hay dos hidrógenos (cada uno unido al nitrógeno) y un oxígeno (unido al carbono central). Ahí es donde ha ido a parar el H2O!
Porque este post se está haciendo ridículamente largo tal y como está, me he guardado el mecanismo para esta imagen emergente.
Dado que esta reacción ocurre en condiciones neutras, es extremadamente útil en la síntesis de péptidos, que pueden sufrir racemización (epimerización, en realidad) tanto en condiciones básicas como ácidas.
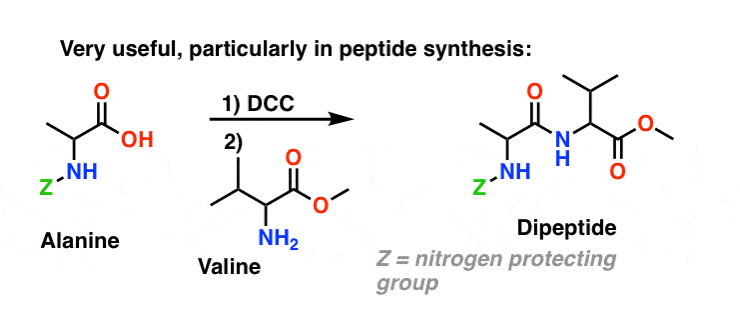
Resumen: Tres métodos efectivos para la síntesis de amidas
Terminemos resumiendo estas tres importantes (pero en absoluto exhaustivas) formas de hacer amidas:
Con esto terminamos nuestro post sobre los puntos principales de la nomenclatura, propiedades y síntesis de amidas. Para un método extra de síntesis de amidas, sigue leyendo.
Consideremos brevemente un cuarto método menos importante: La fuerza bruta
Ya que suele estar contemplado en los libros de texto, concluyamos considerando una cuarta posibilidad, la más sencilla imaginable. Qué pasa si tomamos un ácido carboxílico y lo combinamos con una amina, esperando que se forme una amida. ¿Qué sucede?
Las aminas son bases, y los ácidos carboxílicos son, bueno, ácidos. Si se suman los dos, se obtiene una sal inocua.
A veces se pueden hacer amidas calentando a tope esta sal en un tubo sellado, expulsando un equivalente de agua. Este método se llama pirólisis.
El método no es nada si no es directo, y tiene toda la sutileza de un obús.
El problema con la pirólisis es que el grupo HO- de un ácido carboxílico es un grupo de salida terrible.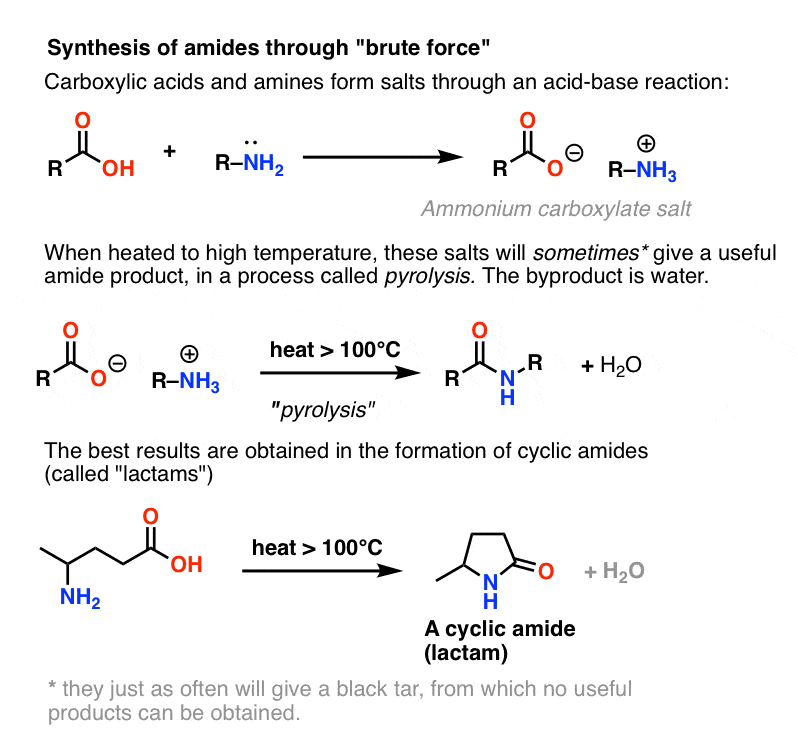
Para formar una amida a partir de esta especie, el oxígeno del carboxilato (O- ) debe salir de alguna manera. Esto no es algo fácil de hacer, ya que la base conjugada del O- es el anión doble O2- . En cualquier lista de grupos de salida, el O2- se situaría en algún lugar entre, «mierda» y «f&jodidamente horrible».
Sin embargo, si uno golpea esta sal con el equivalente químico del Martillo de Thor: fuerza bruta, calor elevado, puede producirse una serie de transferencias de protones desde la sal de amonio. liberando finalmente H2O y formando el enlace C-N.
Este proceso se llama pirólisis (piro = fuego, lisis = ruptura).
En ciertos casos, especialmente amidas simples, y también en la formación de lactamas simples, el proceso puede ser satisfactorio.
En muchos otros casos, sin embargo, da lugar a la formación de un alquitrán negro en el fondo de su matraz del que no se puede obtener ningún producto útil.
Como cualquier químico orgánico puede decirle, hay muchas formas diversas de crear alquitranes negros intratables en el fondo de su matraz, y este es sólo un método. Piensa en todo lo que te queda por descubrir!

La búsqueda de imágenes en Google del «Martillo de Thor» estaba relacionada con la química, pero sorprendentemente NSFW.
Notas
Un divertido artículo relacionado: Amidas: Humble But Useful (de Chemical & Engineering News).
También hay un efecto inductivo, por el que el oxígeno electronegativo (electronegatividad de 3,44) tira de los electrones del carbono unido, que a su vez tira de los electrones del nitrógeno.
Nota 2. Una forma muy común de llevar a cabo esta reacción es utilizar lo que se llama, las condiciones de Schotten-Baumann, donde uno toma los reactivos en disolvente como el éter dietílico o dicorometano, y añade una solución acuosa de NaOH, lo que resulta en una mezcla bifásica. Las sales de amonio que se formen pueden disolverse en la fase acuosa, donde son neutralizadas por el exceso de base y vuelven a la fase orgánica. Las aminas son generalmente mucho más nucleófilas que los iones hidróxido, por lo que la hidrólisis del cloruro ácido para dar un ácido carboxílico no suele ser un problema.
Nota 3.
«En el momento de mi exitosa síntesis de la penicilina V en 1957, comparé el problema de intentar sintetizar la penicilina por métodos clásicos con el de intentar reparar el muelle principal de un reloj fino con el yunque, el martillo y las pinzas de un herrero» – John C. Sheehan
Nota 4. El problema de usar DCC es que el subproducto, DCU, es un tremendo dolor de cabeza para deshacerse de él. La mayoría de los subproductos se eliminan fácilmente mediante cromatografía en columna. El DCU no. Sin tener en cuenta la polaridad del disolvente, el DCU sale de la columna lentamente, a cuentagotas, contaminando todas las fracciones a su paso. El EDC es una variante del DCC que tiene una unidad de amina terciaria; así, un simple lavado con ácido durante el trabajo eliminará toda la urea, ahorrando mucho tiempo y dolores de cabeza.
La siguiente imagen muestra el último paso de la síntesis de Sheehan utilizando DCC.
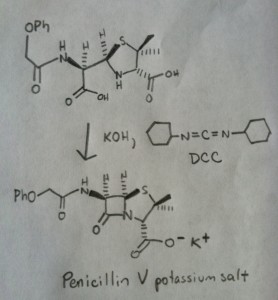
Imagen: Carmen Drahl/Chemical & Noticias de Ingeniería
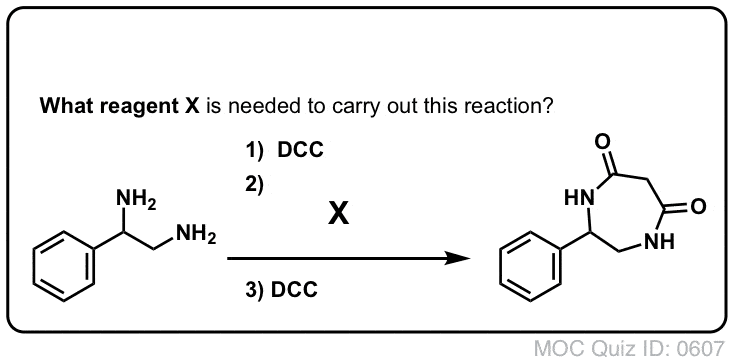
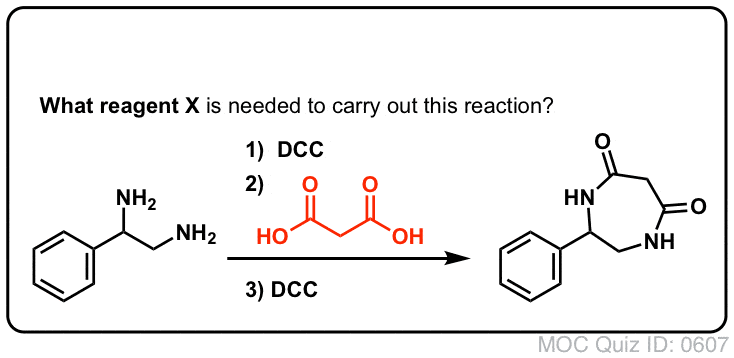
¡Prueba tú mismo!
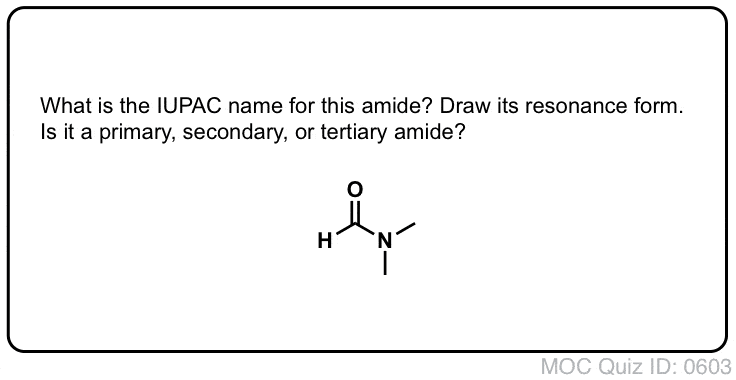
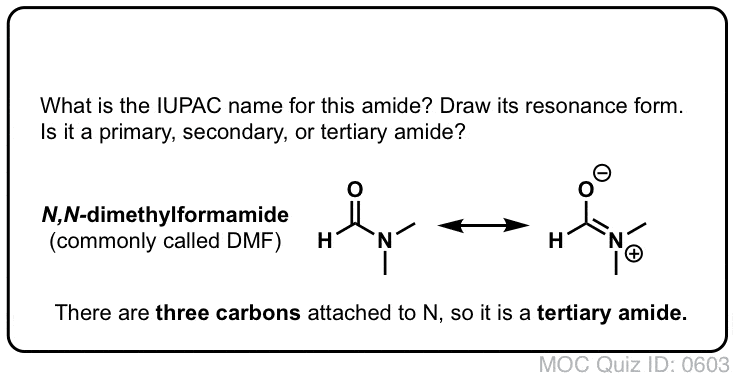
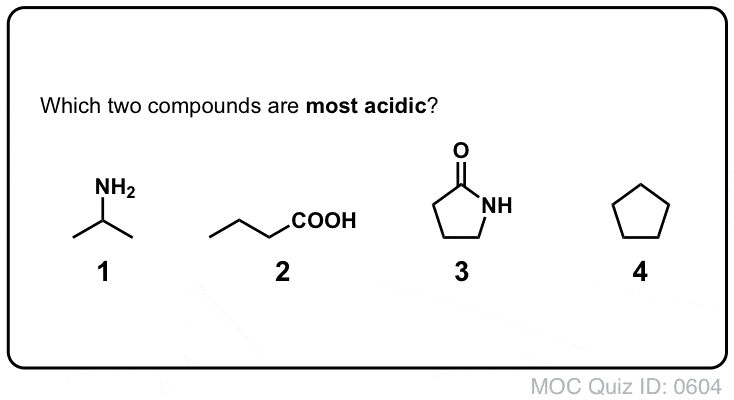
Referencias (avanzadas) y lecturas adicionales
Hidrólisis del nitrilo:
.