La enolización o tautomerismo ceto-enol es un proceso de conversión de una cetona o un aldehído en un enol correspondiente (en condiciones ácidas) o en un enolato (en condiciones básicas). Este proceso puede ocurrir también en los ésteres. Sin embargo, en este post me voy a centrar en los aldehídos y las cetonas para no sobrecargarlo con los detalles y matices.
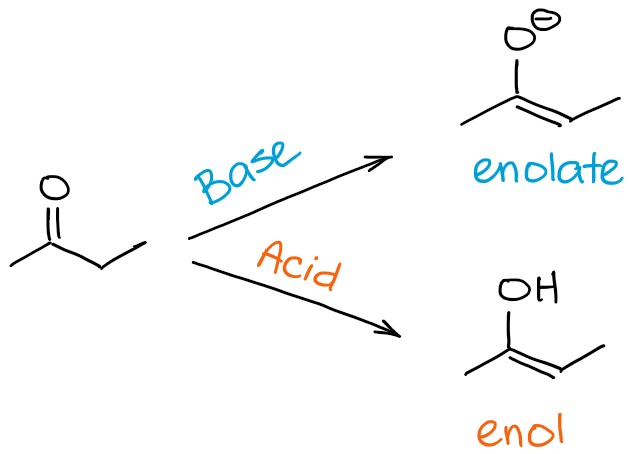
Entonces, ¿cuál es la diferencia entre una enolización y un proceso de tautomerización de ceto-enol? Una respuesta corta es ninguna realmente 😊
Cuando nos referimos a la enolización, nos referimos específicamente al proceso que te lleva de una cetona o un aldehído a un enol o un enolato. Cuando nos referimos a la tautomería ceto-enol, nos referimos al equilibrio en general. Así, al decir que mi molécula sufre la tautomerización ceto-enol, puedo dar a entender la dirección del proceso, pero generalmente no la señalo per se. La dirección de la tautomerización ceto-enol, sin embargo, puede deducirse a menudo del contexto de la reacción.
En pocas palabras, si dices que la molécula «A» sufre una enolización, significa que «A» se convierte en un enol o un enolato. Si se dice que una molécula «B» sufre una tautomerización ceto-enol, puede significar una enolización si B es un carbonilo, o puede significar un proceso inverso si B ya es un enol o un enolato.
Enolización catalizada por bases
Mientras que la enolización puede ocurrir en condiciones básicas o ácidas, la enolización catalizada por bases es una forma más común de hacer esta reacción. Así, creo que es una buena idea repasar primero la enolización en condiciones básicas.
En condiciones básicas, una cetona o un aldehído actúa como un ácido de Brønsted donando un protón de un α-carbono a una base en la solución. Este proceso da un anión enolato estabilizado por resonancia:

Dado que en este equilibrio nuestro carbonilo actúa como un ácido, necesita ser suficientemente ácido para ceder el protón. Alternativamente, la base necesita ser lo suficientemente fuerte para conducir este equilibrio hacia el producto.
¿Cómo de ácidos son los hidrógenos de los α-carbones?
El anión enolato es una especie estabilizada por resonancia, por lo que el grado de estabilización por resonancia juega un papel muy importante en la acidez de los compuestos carbonílicos. Sabemos, que cuanto más contribuyentes de resonancia podemos dibujar para la base conjugada, más estable es. Y cuanto más estable sea la base conjugada, más ácido será el ácido original. Así, los hidrógenos situados entre dos enlaces C=O serán significativamente más ácidos que los situados junto a un solo C=O.
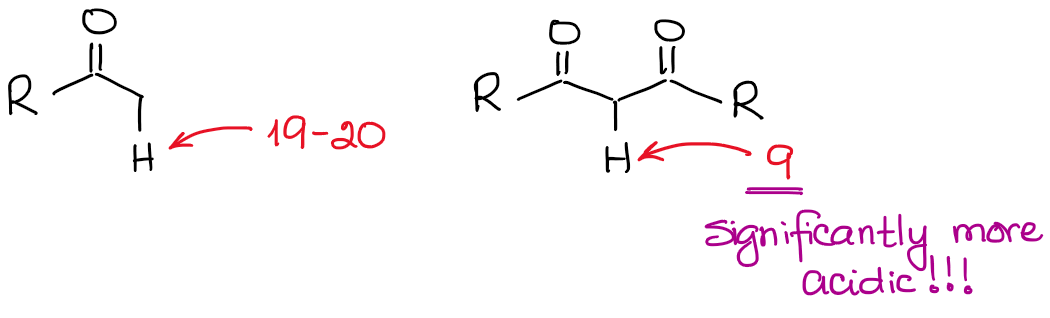
Si comparamos las bases conjugadas en ambos casos, veremos que el dicarbonilo tiene una mejor estabilización de resonancia de la carga negativa a través de un sistema conjugado más extendido.
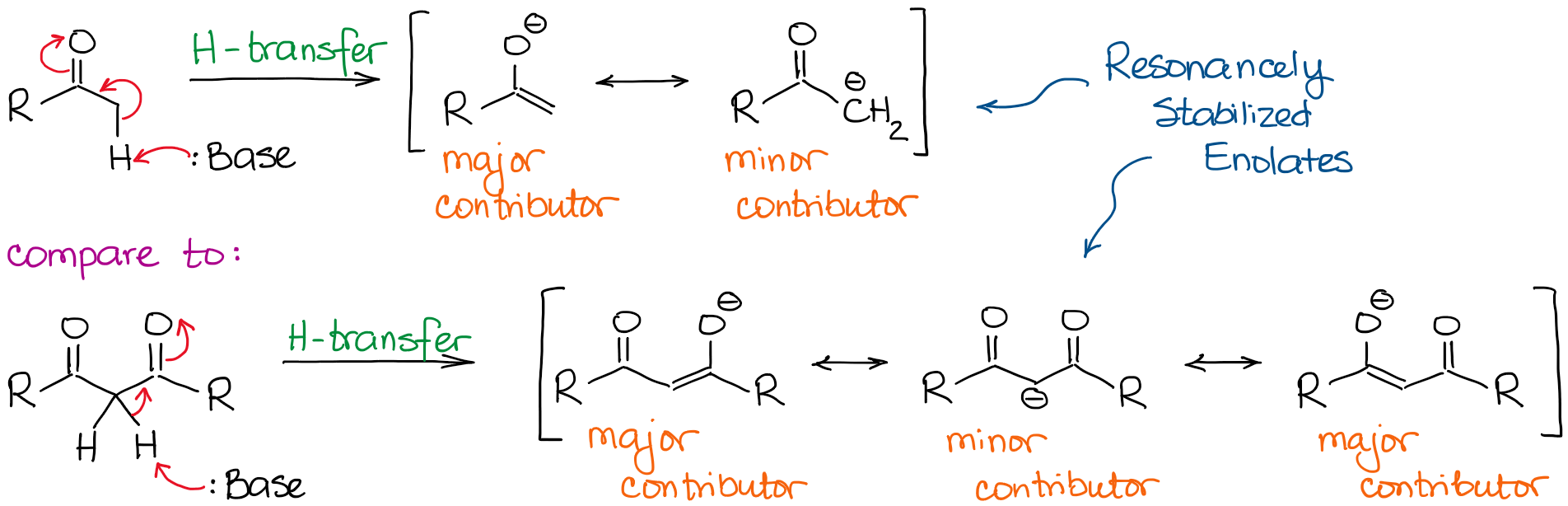
¡Un importante contribuyente de resonancia adicional en el anión dicarbonilo hace que la molécula sea unas 10000000000 veces más ácida! Por lo tanto, la naturaleza de una cetona o un aldehído es bastante clara aquí: cuantos más enlaces C=O junto a un hidrógeno, más ácido se vuelve.
Efecto de una base en el equilibrio de enolización
Las bases tienen fuerzas muy diferentes. Por lo tanto, la elección de una base es importante si quieres conducir tu equilibrio hasta la finalización. Veamos algunas bases que solemos ver en las reacciones de química orgánica:
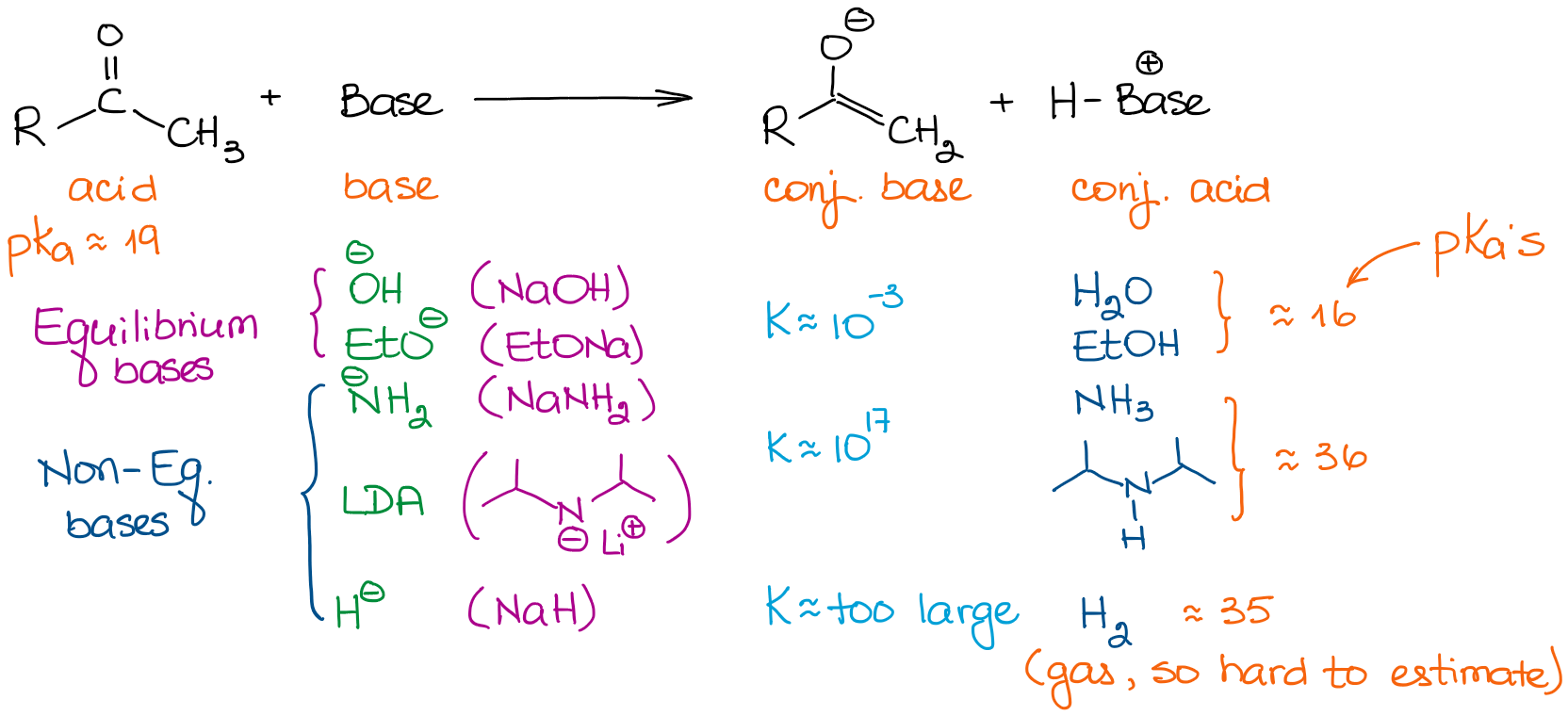
Cuando se trata de aldehídos y cetonas simples, podemos clasificar todas las bases en dos categorías: bases de equilibrio y bases de no equilibrio. Las bases de equilibrio son relativamente débiles. Esto significa que sólo pueden impulsar el equilibrio en una medida muy modesta. Así, la concentración real de un enolato en la solución será muy pequeña. La reacción también estará en un equilibrio constante entre el material de partida y un enolato. Estas bases favorecen la formación de enolatos más estables termodinámicamente. Estos enolatos se denominan enolatos termodinámicos.
Las bases que no están en equilibrio, sin embargo, son muy fuertes. Esto conduce a una reacción de transferencia de protones (ácido-base) con constantes de equilibrio muy grandes. Cuando tenemos una constante de equilibrio superior a 103, el equilibrio se desplaza casi por completo hacia los productos. Así, una enolización con una base como el LDA da prácticamente el 100% de enolización. Por lo tanto, la concentración del aldehído inicial o una cetona es básicamente cero.
Carbonilos con un enlace C=O vs β-Dicarbonilos
Como he mencionado anteriormente, los β-dicarbonilos son significativamente más ácidos que los aldehídos y cetonas regulares. Veamos una constante de equilibrio en los dos casos siguientes:
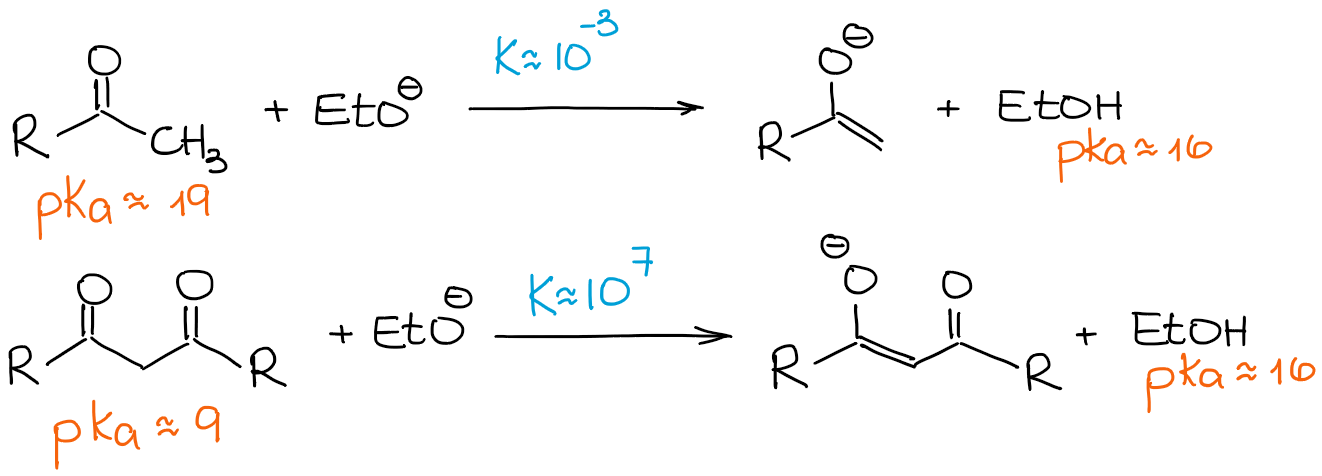
Dado que un β-dicarbonilo es mucho más ácido que un aldehído normal o una cetona, incluso una base débil impulsa el equilibrio hacia los productos dando el 100% de enolización. Por lo tanto, vamos a ver cualquier reacción de enolización de los β-dicarbonilos como un proceso de 100% de enolato y 0% de material de partida, independientemente de una base.
¿Por qué es importante la elección de una base?
Algunas reacciones pueden ser muy sensibles a lo que hay en la solución y a las concentraciones de los reactivos. Por ejemplo, los aldehídos son electrófilos mientras que los enolatos son nucleófilos. Por lo tanto, si utilizo una base débil que no está en equilibrio y que deja mucho material de partida en la solución, puedo empezar a ver una reacción indeseable entre un enolato y un aldehído inicial. Generalmente, sólo vamos a ver las bases débiles de equilibrio utilizadas cuando no vamos a esperar mucha competencia entre los posibles productos. Si son posibles múltiples reacciones y ningún producto principal domina el equilibrio, siempre utilizaremos bases fuertes de no equilibrio.
Bases voluminosas vs bases pequeñas
El tamaño de una base puede ser un factor determinante en el proceso de enolización cuando compiten múltiples posiciones enolables en una molécula. Veamos la enolización de la 2-metilbutanona por dos bases fuertes:
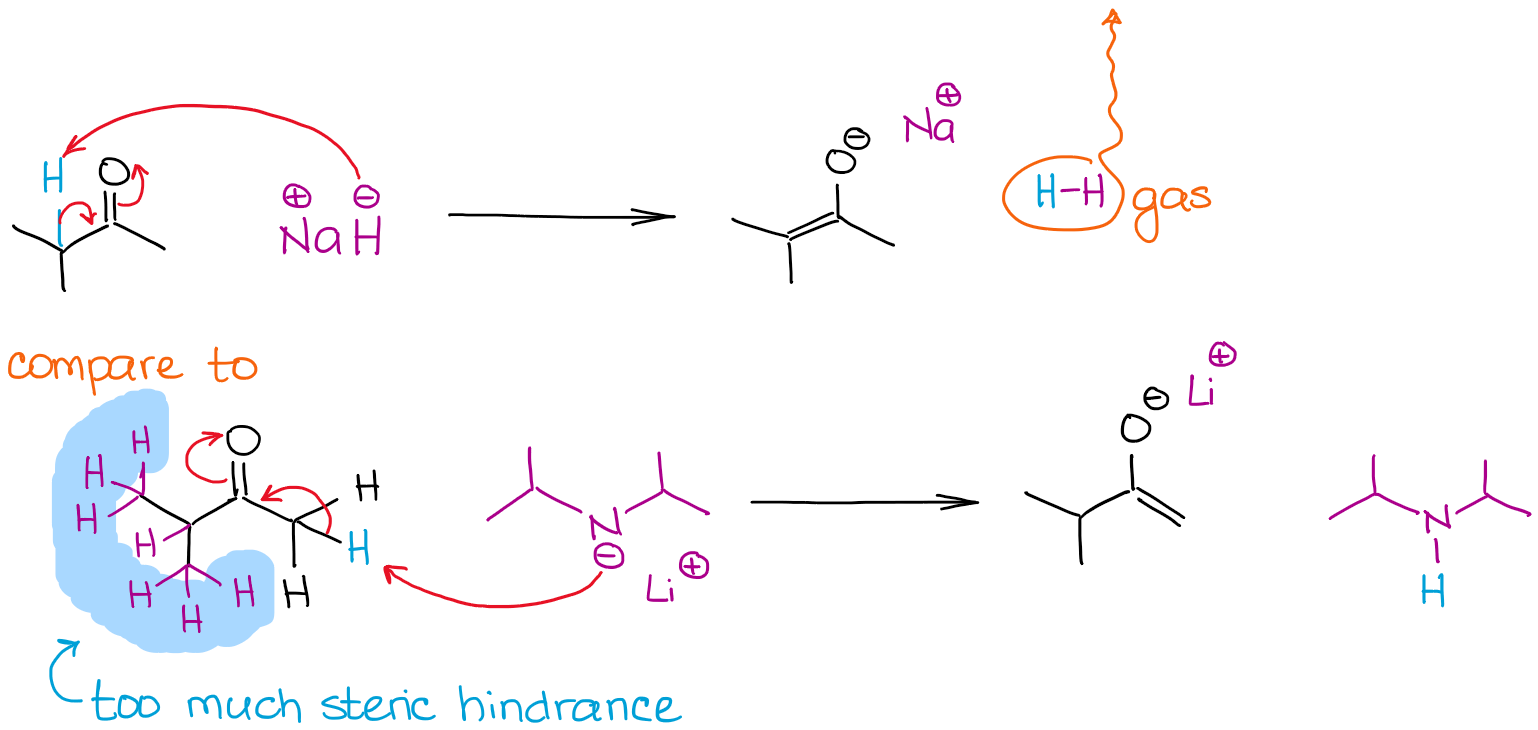
Ambas reacciones dan una enolización del 100% debido al uso de bases muy fuertes que no están en equilibrio. Sin embargo, la reacción con hidruro de sodio (NaH) da un enolato más estable termodinámicamente. A diferencia del LDA, el anión hidruro es muy pequeño por lo que puede alcanzar fácilmente un protón más estéricamente obstaculizado y dar un enolato termodinámico. El LDA es muy voluminoso y por lo tanto es muy sensible a cualquier impedimento estérico. Esto significa, que irá tras los hidrógenos menos obstaculizados estéricamente y más accesibles enolables.
Llamamos al enolato menos estable termodinámicamente como en la reacción con LDA un enolato cinético. Aquí es también donde el orden de adición de los reactivos se vuelve relevante. Para obtener un enolato cinético, siempre hay que añadir un carbonilo a la base, y no al revés. Algunos profesores son quisquillosos al respecto, así que tenlo en cuenta.
Enolados termodinámicos vs cinéticos
A estas alturas ya he mencionado los enolados termodinámicos y cinéticos unas cuantas veces, así que creo que sería una buena idea repasarlos con un poco más de detalle.
¿Qué cuenta exactamente para la estabilidad termodinámica de un enolado?
Los enolatos que más contribuyen a la resonancia tienen una carga negativa en el átomo de oxígeno y un doble enlace C=C.
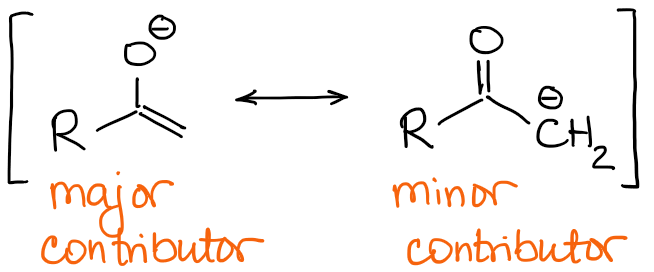
Así, la naturaleza del doble enlace será la principal diferencia entre los enolatos. Si volvemos a mirar el ejemplo con la 2-metilbutanona de arriba, podemos ver que los dos posibles enolados tienen un doble enlace cualitativamente diferente:

Siempre hay que buscar el número de sustituyentes en el doble enlace. Cuantos más sustituyentes tenga un doble enlace, más estable será. Así, el enolato termodinámico siempre tendrá el doble enlace más ocupado.
Un enolato cinético es el que se forma más rápido. Piensa en la reacción con el LDA. El LDA es una base de no equilibrio muy fuerte. Tan pronto como arrebata el protón, no lo va a devolver. También es una base muy voluminosa y no puede agarrar un hidrógeno del centro de la molécula. Por lo tanto, va a ir después de lo que es más accesible estéricamente uno. Por lo tanto, una base como el LDA arrebata un protón rápidamente, desde un sitio menos estéricamente obstaculizado, y no lo devuelve o permite el equilibrio produciendo un enolato menos estable.
¿Por qué es importante añadir un carbonilo a una base para hacer un enolato cinético?
Si quieres un enolato cinético, tu base debe estar siempre en exceso. Los enolatos son básicos en sí mismos. Así que, si tienes un carbonilo en exceso, entonces el enolato puede establecer rápidamente un equilibrio con él.
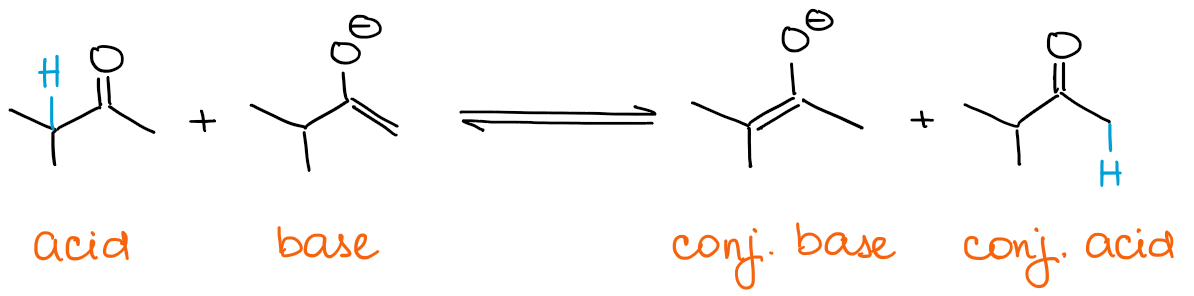
Cualquier equilibrio siempre favorecerá a las especies más estables termodinámicamente. Esto significa que siempre estarás obteniendo un enolato termodinámico si tienes un exceso de un carbonilo y no de una base.
Así que recuerda que:
Bases fuertes débiles y pequeñas = enolato termodinámico
Bases fuertes voluminosas = enolato cinético
Usar esta sencilla regla general te ayudará a la hora de determinar qué enolato vas a tener o necesitar hacer en tu reacción.
Enolización catalizada por ácido
Al principio de este post, he mencionado que la enolización también es posible en condiciones ácidas. Dado que los aldehídos y las cetonas no son especialmente básicos, es necesario utilizar un ácido muy fuerte para catalizar este proceso. Normalmente, utilizamos ácidos sulfúricos o tosílicos como catalizadores.
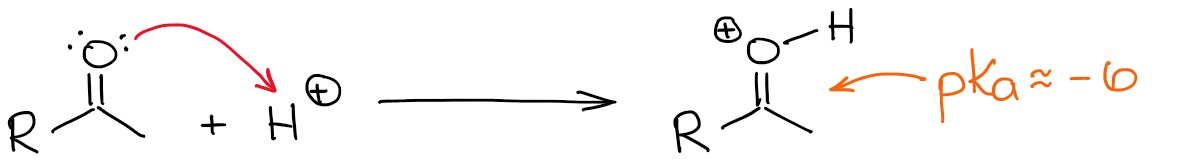
El hidrógeno más ácido en un carbonilo protonado es, por supuesto, el del oxígeno. Sin embargo, hacer un enlace C=O más polarizado añadiéndole un protón, hace que la posición α sea también más ácida. Así que ahora es algo más fácil desprotonar la posición α y hacer un enol.
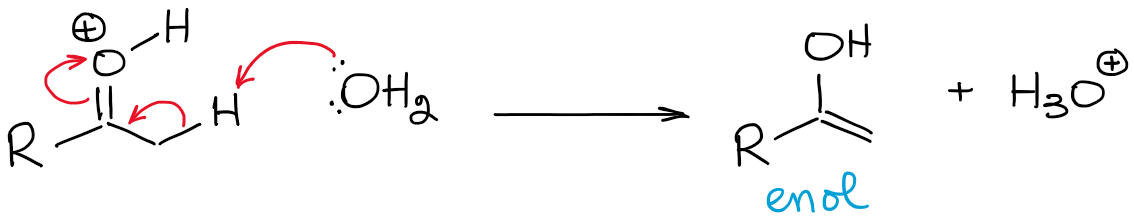
Este equilibrio es enormemente desfavorable y favorece al carbonilo en general. Por lo tanto, nunca tendrás una alta concentración de un enol en condiciones ácidas a menos que haya algún tipo de efecto de estabilización que haga que el enol sea favorable (raro).
Aunque se pueden producir todos los posibles productos de enol, esta reacción siempre favorecerá la formación de un enol termodinámico.
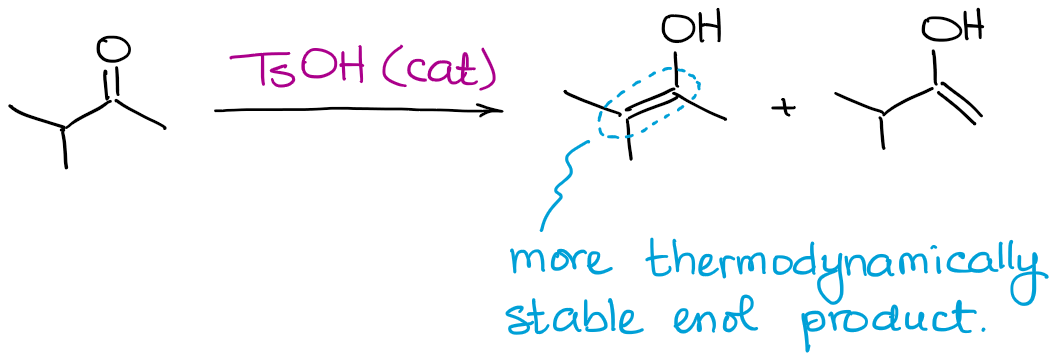
Al igual que en el caso de los enolatos, un enol termodinámico es el que tiene más sustituyentes en el doble enlace.
¿Qué factores influyen en la enolización catalizada por ácidos?
Cualquier cosa que pueda hacer que un enol sea más estable ayudará al equilibrio. Los factores más comunes son el enlace de hidrógeno y la conjugación extendida.
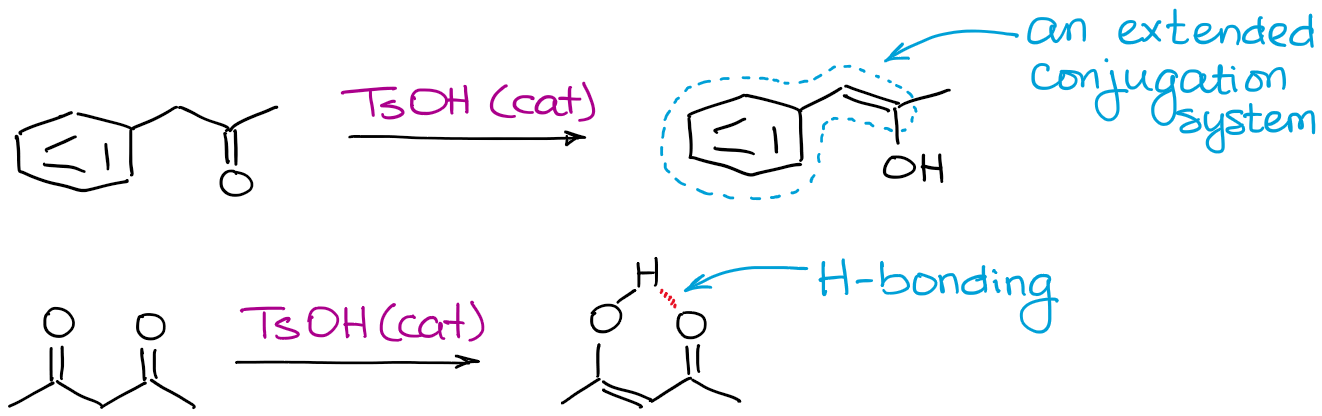
¿Por qué molestarse con la enolización catalizada por ácido?catalizada por ácido si hay tantos problemas con ella?
Su compuesto podría ser sensible a las bases. Además, podría ser más fácil combinar varios pasos cuando se producen en las mismas condiciones. A menudo combinamos la enolización catalizada por ácido con otros pasos de una reacción que también se producen en condiciones ácidas.
Hay que tener en cuenta, sin embargo, que los grupos que retiran electrones en las proximidades de un carbonilo lo harán aún menos básico de lo que ya es. Así que, si tienes, por ejemplo, un halógeno en la posición α, será realmente difícil forzar la formación de un enol.

Compruebe siempre si hay algún EWG en la posición α-¡antes de asumir cualquier formación de enol! Cualquier EWG que no ofrezca estabilización de resonancia al doble enlace desfavorecerá significativamente el proceso de enolización.
¿Qué esperar en el examen?
Los profesores rara vez hacen preguntas dirigidas específicamente a la formación de enoles o enolatos directamente. Las preguntas de enolización siempre van a estar disfrazadas de otra cosa. Las preguntas de enolización suelen estar redactadas como:
- Encuentra el hidrógeno más ácido en la siguiente molécula… o
- Dibuja el producto… (la reacción tendrá un enol o un enolato como intermedio)
Por supuesto, podrían hacer una pregunta directa. Sin embargo, en mi experiencia, la tautomerización del ceto-enol y las enolizaciones suelen ser el concepto subyacente que impulsa una determinada pregunta.