Proteína del mes
Noviembre de 2006
MÁS SOBRE LA PROTEÍNA DE ESTE MES |
|
OTRAS PROTEÍNAS DE INTERES |
|
Molécula del mes: Fibrina |
|
|
La coagulación de la sangre, o coagulación, es una respuesta rápida al daño tisular, en la que la exposición de células que contienen factor tisular al torrente sanguíneo a través del daño de las paredes de los vasos inicia un rápido sistema de cascada. Esta cascada enzimática utiliza una serie de enzimas que trabajan en rápida sucesión para amplificar una pequeña respuesta en una grande en el lugar del daño (véase la figura 1). Una vez activado, el factor tisular (FT) se une y activa el factor VII (FVII), iniciando la cascada. El TF/FVII se activa a través de la autodegradación a TF/FVIIa, que junto con el cofactorFVIIIa convierte el FIX en FIXa; el FXa puede entonces convertir el FX en FXa, que junto con el cofactor FVa convierte el FII (protrombina) en FIIa (trombina); finalmente, el FIIaconvierte el fibrinógeno en fibrina, lo que conduce a la deposición de fibrina y a la activación de las plaquetas para formar coágulos sanguíneos. La activación del FXIII en FXIIIa puede estabilizar estos coágulos sanguíneos mediante su reticulación.
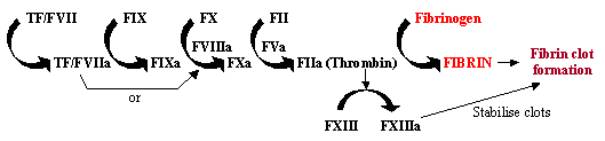
Figura 1. Cascada de la coagulación de la sangre
Fibrinógeno, terminando la cascada de la coagulación
El fibrinógeno fue aislado por primera vez del plasma de los caballos por Hammarsten en 1876, aunque se propuso la existencia de un precursor inactivo de la fibrina ya en 1859 por Deni deCommercy. El fibrinógeno puede sufrir una marcada transformación de monómeros solubles (fibrógeno) a un gel polimérico insoluble (fibrina polimerizada).
El fibrinógeno es una plasmaglicoproteína sintetizada en el hígado que es esencial para la hemostasia (detener la pérdida de sangre de los tejidos dañados), la cicatrización de heridas, la fibrinólisis, la inflamación, la angiogénesis, las interacciones celulares y de la matriz, y la neoplasia. Estos procesos implican la conversión del fibrinógeno en fibrina y, a menudo, la interacción de la fibrina (ogeno) con diversas proteínas y células. Las personas suelen llevar unos 2,5g de fibrinógeno/L de sangre, sin embargo, las concentraciones de fibrina pueden aumentar hasta un 200-400% en momentos de estrés fisiológico (principalmente debido a las acciones de la interleucina-6 derivada de los macrófagos).
El fibrinógeno es una glicoproteína grande y compleja compuesta por tres pares de polipéptidos: dos Aa, dos Bb y dos g. Estos polipéptidos están unidos entre sí por 29 enlaces disulfuro, algunos de los cuales se representan en la Figura 2. Los polipéptidos están orientados de manera que los seis extremos N-terminales se unen para formar el dominio central E. Dos regiones de hélices alfa en espiral se extienden a ambos lados del dominio E, cada una de ellas formada por un polipéptido Aa, uno Bb y uno g. Cada región de espiral termina en un dominio D globular formado por los extremos C-terminales de Bb y g, así como por parte de Aa. El extremo C-terminal de Aa sobresale de cada dominio D como una hebra larga; estas protuberancias de Aa pueden interactuar entre sí y con el dominio E durante la reticulación del coágulo de fibrina. Tanto el dominio E como el D contienen importantes sitios de unión para la conversión del fibrinógeno en fibrina, para el ensamblaje y la reticulación de la fibrina y para la agregación de las plaquetas. Los iones de calcio unidos son importantes para ayudar a mantener la estructura del fibrinógeno.
Los extremos N-terminales de los polipéptidos Aa y Bb son escindidos por la trombina para convertir el fibrinógeno soluble en fibrina formadora de gel. Una vez escindidos del fibrinógeno, los extremos N-terminales se conocen como fibrinopéptido A (de Aapolipéptido) y fibrinopéptido B (de Bbpolipéptido).
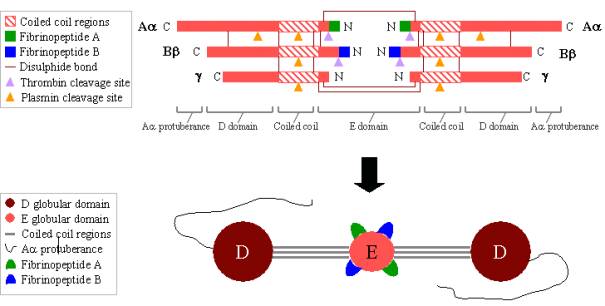
Figura 2. Fibrinógeno:
TOP – organización polipeptídica del fibrinógeno.
BOTTOM – organización de dominios del fibrinógeno.
Formación de coágulos
Para formar un coágulo sanguíneo, el fibrinógeno debe ser escindido primero por la trombina para eliminar los fibrinopéptidos. La eliminación de los fibrinopéptidos A y B de los extremos N-terminales de Aa y Bb expone los «pomos» del dominio E, que pueden interactuar con los «agujeros» siempre presentes en los dominios D. Las moléculas de fibrina pueden unirse mediante la interacción del dominio E de una molécula de fibrina con los dominios D de otras cuatro moléculas de fibrina, polimerizándose así para formar oligómeros escalonados que se convierten en protofibrillas. A medida que los oligómeros de fibrina se van agregando, estas protofibrillas se van alargando hasta formar largas fibras que pueden enrollarse unas con otras para formar haces gruesos de varias hebras, y que pueden ramificarse en una red tridimensional de fibras enredadas, el coágulo de fibrina. El coágulo de fibrina es estabilizado por el Factor XIIIa, una transglutaminasa, en la que la forma zimógena del Factor XIII se convierte en Factor XIIIa activo mediante la acción de la trombina (véase la figura 1). El Factor XIII enlaza los residuos de glutamina de una molécula de fibrina con los residuos de lisina de otra molécula de fibrina mediante la formación de fuertes enlaces isopéptidos. Esta reticulación se produce entre los extremos C-terminales (protuberancias Aa) de los polipéptidos Aa, así como (más lentamente) en otros lugares, como entre los extremos C-terminales de las cadenas g. Estos enlaces cruzados ayudan a fortalecer el coágulo de fibrina, haciéndolo más resistente a los daños físicos y químicos.
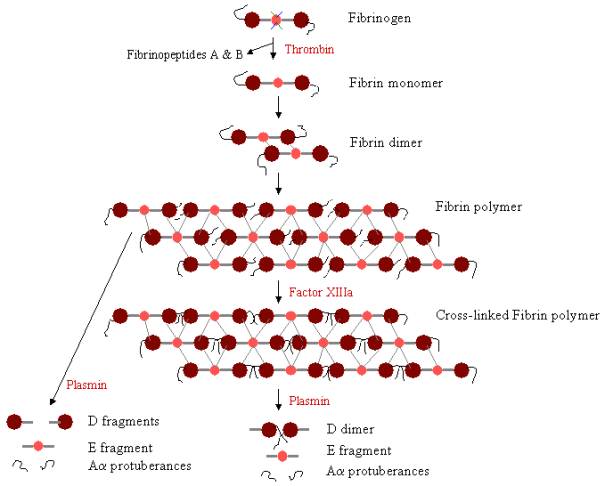
Figura 3. Polimerización y lisis de la fibrina: Vía de polimerización y ruptura de la fibrina. Los pomos del dominio E se unen a los agujeros de hasta cuatro dominios D (líneas grises), formando un largo entramado fibroso. A continuación, el coágulo se estabiliza mediante la reticulación. El coágulo puede degradarse, dando lugar a diferentes productos de degradación si se ha reticulado.