US Pharm. 2013;38(2):HS2-HS8.
ABSTRACT: La insuficiencia cardíaca aguda descompensada (ICAD), una exacerbación de la función cardíaca, pulmonar y/o renal crónica, representa la mayor parte de los 39 mil millones de dólares gastados en la insuficiencia cardíaca crónica. La farmacoterapia de la ICAD no ha cambiado recientemente, pero los estudios han indicado que la mayoría de los tratamientos son eficaces, aunque no equivalentes desde el punto de vista económico. La farmacoterapia hospitalaria basada en la evidencia se guía por el conocimiento de los subconjuntos hemodinámicos de Forrester y su fisiopatología. El éxito clínico depende no sólo de un tratamiento hospitalario adecuado, sino también de la utilización de un equipo de alta.Los farmacéuticos pueden salvar la brecha entre las visitas al hospital y la atención ambulatoria recomendando y proporcionando la continuidad de la atención.
En 2010, el coste del tratamiento de la insuficiencia cardíaca (IC) en los Estados Unidos se estimó en 39.200 millones de dólares.1,2Casi un millón de pacientes son hospitalizados cada año por exacerbaciones, y la IC es actualmente el motivo más común de ingreso hospitalario en adultos mayores de 65 años.2 La insuficiencia cardíaca aguda descompensada (ICAD) puede ser el resultado de una IC crónica mal controlada y/o de una disfunción cardíaca, pulmonar o renal. El coste de la atención hospitalaria para estos pacientes es extremadamente alto, y representa alrededor del 60% del gasto total en IC.3
Además del impacto financiero de la IC, la longevidad y la calidad de vida se ven gravemente afectadas en los pacientes con exacerbaciones agudas. El ingreso hospitalario se asocia con un mayor riesgo de mortalidad en los pacientes con IC; la mortalidad se produce en el 15,5% de los pacientes, y un tercio de los pacientes nunca son dados de alta del hospital.2 La ICAD es una enfermedad incapacitante que carga no sólo a los pacientes, sino también al sistema de salud.
La farmacoterapia de la ICAD es un campo de batalla para los hospitales que buscan controlar los costes en una época de reducción de pagos y aumento de gastos. En octubre de 2012, los Centros de Medicare y Medicaid (CMS) empezaron a recortar los reembolsos a los hospitales con altas tasas de reingresos de pacientes en tres estados de enfermedad de alto coste: infarto de miocardio (IM), neumonía e IC. Si los pacientes con estas enfermedades ingresan en un plazo de 30 días, los CMS reducirán el reembolso base total en un 1% anual, hasta una reducción máxima del 3% en 2014.4 Pronto, la pérdida financiera motivará a los casi 2.000 hospitales que sufren las mayores penalizaciones a instituir nuevas políticas y cuidados de seguimiento para los pacientes dados de alta con un diagnóstico de IC.
Afortunadamente, un análisis realizado por los CMS en 2011 mostró que la tasa de ingresos por IC había disminuido en realidad durante un período de 10 años.1 En 2008, se produjeron 229.000 ingresos menos de los esperados dadas las tendencias observadas en las últimas décadas.1,5Los investigadores atribuyeron este descenso a «la reducción de la incidencia de la enfermedad arterial coronaria, la mejora del control de la presión arterial, el mayor uso de terapias basadas en la evidencia y, posiblemente, los cambios en los umbrales de admisión.» Sin embargo, la tasa de mortalidad por todas las causas a un año siguió siendo elevada, de aproximadamente el 30%, para los pacientes hospitalizados por IC.1,5 Los hombres de raza negra y ciertas regiones del país obtuvieron peores resultados en las tasas de hospitalización; los investigadores plantearon la hipótesis de que las diferencias en la accesibilidad o la calidad de la atención podrían contribuir a esta disparidad.1 Los mejores resultados (reducción de los costes y de las tasas de reingreso) se observan con un enfoque multidisciplinar que incluye a médicos, farmacéuticos, enfermeros, nutricionistas y fisioterapeutas.6 Este artículo es una breve revisión de la farmacoterapia de la ICAD con una mirada adicional a las consideraciones farmacoeconómicas y a las controversias sobre el alta hospitalaria.
Patofisiología
La ICAD se define como un empeoramiento repentino de los síntomas de la IC y suele estar causada por un edema pulmonar cardiogénico con rápida acumulación de líquido en los pulmones, aunque puede ocurrir sin edema pulmonar.7 La hipertensión, la isquemia y/o la disfunción ventricular provocan una disminución del gasto cardíaco, lo que lleva a la activación de la vía neurohormonal. El sistema simpático aumenta la norepinefrina para mejorar la perfusión periférica a través de la vasoconstricción y activa el sistema renina-angiotensina-aldosterona para aumentar la perfusión renal a través de la retención de agua.8 Un aumento agudo de la presión de llenado del ventrículo izquierdo hace que se produzcan fugas de proteína-poorlíquido en los alvéolos e intersticio pulmonares, pero no se compromete la integridad de la membrana pulmonar. Los mecanismos de compensación aumentan la frecuencia cardíaca y la resistencia vascular sistémica en un intento de mejorar el gasto cardíaco, y se produce un círculo vicioso.7,8
Las causas comunes de la ICAD incluyen la disfunción ventricular izquierda o diastólica con o sin enfermedad arterial coronaria (EAC) o anomalías valvulares. Aunque la mayoría de los pacientes hospitalizados con ICAD tienen un empeoramiento de la IC preexistente, hasta el 20% de los pacientes no tienen un diagnóstico previo de IC.9
La ICAD también puede ocurrir en pacientes sin ninguna enfermedad cardíaca preexistente, incluyendo condiciones como hipertensión grave, sobrecarga de líquidos, enfermedad renal grave o estenosis de la arteria renal. Los factores que precipitan un evento implican un cambio en el flujo sanguíneo a través del corazón; la ICAD puede ser inducida por una crisis hipertensiva, un IM o una isquemia, una obstrucción auricular, una regurgitación mitral aguda, una sobrecarga de líquidos o una falta de adherencia a la medicación para la IC. Algunos medicamentos, como los betabloqueantes, los antagonistas del calcio no dihidropiridínicos y los antiinflamatorios no esteroideos (AINE), también pueden precipitar la ICAD.7,10

Clasificación
La ICAD puede clasificarse en estadios hemodinámicos en función del índice cardíaco y la presión capilar pulmonar. Los estadios se clasifican como subconjuntos hemodinámicos de Forrester (TABLA 1).11 El índice cardíaco (IC) indica el grado de perfusión; los pacientes se caracterizan como «cálidos» o «fríos» dependiendo de la presencia de hipoperfusión. Un IC de <2,2 L/min/m2 justifica la clasificación de «frío», que indica hipoperfusión. Los signos y síntomas consistentes con la hipoperfusión incluyen fatiga, hipotensión, coolextremidades, disminución de la función renal y alteración del estado mental.La presión capilar pulmonar en cuña (PCWP) indica el estado de los fluidos; los pacientes se clasifican como «secos» o «húmedos» dependiendo de la presencia de edema, que se define como una PCWP >18 mmHg. Los signos y síntomas de sobrecarga de volumen incluyen tos, disnea, disnea paroxística nocturna, presión venosa yugular elevada, edema periférico, ascitis, hepatomegalia y esplenomegalia.
La presentación más común, que constituye dos tercios de los ingresos por ICAD, es el subgrupo II (cálido y húmedo).8 En comparación con el subgrupo I (cálido y seco), el subgrupo IV (frío y húmedo) aumenta la tasa de mortalidad en dos veces y media.12Tres parámetros de laboratorio clave indican un mayor riesgo de mortalidad de los pacientes hospitalizados según el ensayo Acute Decompensated Heart Failure NationalRegistry (ADHERE): un nitrógeno ureico en sangre de ≥43 g/dL, una presión arterial sistólica <115 mmHg, y/o una creatinina sérica >2,75 mg/dL.13
Farmacoterapia
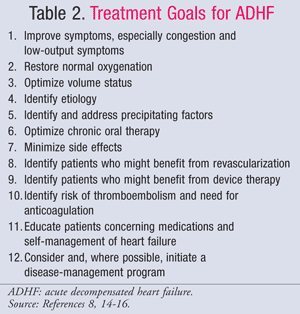
El tratamiento farmacológico de la ICAD está guiado por el estado hemodinámico del paciente, que se evalúa mediante los valores de IC y PCWP (TABLA 1).11 Los objetivos y los medicamentos para el tratamiento de la ICAD se resumen en las TABLAS 2 y 3.8,14-16Aunque el estándar de atención no ha cambiado significativamente en los últimos años, un nuevo enfoque en el impacto farmacoeconómico de la IC ha demostrado que no todos los tratamientos son iguales. La farmacoterapia debe elegirse en función del subconjunto diagnosticado, ya sea para tratar la sobrecarga de líquidos o la hipoperfusión. Los pacientes del subgrupo IV se clasifican como pacientes con sobrecarga de líquidos y disfunción de la perfusión y, por lo tanto, requieren tratamiento para ambos síntomas.
Subgrupo II o IV-Húmedo: Los diuréticos de asa intravenosos (IV) son el pilar del tratamiento de la ICAD para los pacientes que presentan sobrecarga de líquidos (PCWP >18 mmHg), a pesar de los datos contradictorios en cuanto a la mortalidad y la morbilidad. Un metaanálisis de 14 ensayos pequeños mostró una disminución de la mortalidad y las hospitalizaciones de los pacientes tratados con diuréticos17; sin embargo, un análisis reciente de los datos observacionales del ensayo ADHERE mostró que los pacientes hospitalizados tratados con diuréticos intravenosos tenían una mayor duración de la estancia general y una mayor duración de la estancia en la UCI18. No obstante, la actualización de 2009 de las directrices del American College of Cardiology/American HeartAssociation (ACC/AHA) para el tratamiento de la IC recomienda la administración temprana de diuréticos intravenosos14 . La furosemida es la más utilizada; sin embargo, la bumetanida y la torsemida son igualmente eficaces. Si los pacientes tienen una respuesta inadecuada a la dosis máxima recomendada en bolo de un loopdiuretic, puede iniciarse una infusión continua de furosemida a 5 mg/h y ajustarse a 20 mg/h según sea necesario.14
La superioridad de la administración de furosemida en infusión continua aún no se ha establecido; el ensayo Diuretic Optimization StrategiesEvaluation (DOSE), que estudió a 308 pacientes hospitalizados asignados al azar para recibir furosemida en bolo o por vía intravenosa, no mostró una diferencia significativa entre los criterios de valoración de la seguridad y la eficacia, pero estudios más pequeños han indicado un pequeño aumento de la producción de orina con la infusión continua.19 Los efectos no controlados de la diuresis rápida, como los desequilibrios electrolíticos y la disfunción renal, pueden conducir a una hospitalización prolongada más allá de la resolución de los síntomas de la ICAD, por lo que los electrolitos y la creatinina sérica deben controlarse con frecuencia.
Otra estrategia para aumentar la diuresis es añadir un segundo diurético con un mecanismo de acción diferente, como la metolazona o la espironolactona. La metolazona, un diurético similar a la tiazida, se utiliza con mayor frecuencia para el control del volumen agudo; sin embargo, la espironolactona y otros antagonistas de la hormona se prefieren en el tratamiento de la IC crónica.20-22
En pacientes con hipertensión continuada y/o síntomas persistentes a pesar de una diuresis agresiva, puede añadirse un vasodilatador para reducir la congestión pulmonar. El nitroprusiato de sodio, la nesiritida y la nitroglicerina intravenosa son vasodilatadores venosos que alivian rápidamente los síntomas congestivos al reducir la PCWP. Si un paciente presenta un bajo gasto cardíaco y una alta resistencia vascular sistémica, se recomiendan los vasodilatadores venosos o los inótropos, aunque los vasodilatadores son el tratamiento preferido. Debido al riesgo de toxicidad por cianuro de las infusiones prolongadas de altas dosis de nitroprusiato, los vasodilatadores preferidos son la nesiritida y la nitroglicerina. De los dos, la nesiritida produjo una mayor mejora del estado clínico global que la nitroglicerina en el ensayo Vasodilation in theManagement of Acute Congestive Heart Failure (VMAC), a pesar de la propensión del fármaco a causar hipotensión.13 Por lo tanto, la nesiritida es el agente preferido en un paciente con sobrecarga de líquidos y bajo gasto cardíaco.
La utilidad de la nesiritida se ha cuestionado debido a su elevado coste de adquisición.23 Se carece de datos de resultados clínicos, pero un modelo farmacoeconómico muestra que el elevado coste inicial de la nesiritida se ve compensado por la menor tasa de reingreso hospitalario en 21 días en comparación con los pacientes que recibieron dobutamina.24 Del mismo modo, un análisis retrospectivo de los datos de ADHERE demostró que los pacientes tratados con nitroglicerina o nesiritida recibían el alta hospitalaria antes que los pacientes tratados con dobutamina o milrinona y también tenían un menor riesgo de mortalidad.13 Dado que un mayor número de pacientes en estado crítico fueron tratados dentro de losotropos, es difícil atribuir la incidencia de una mayor mortalidad al fármaco.
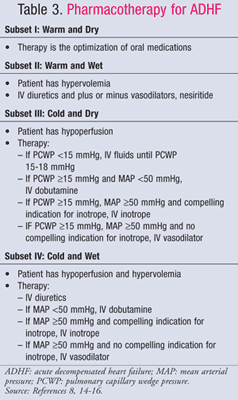
Subconjunto III o IV-Frío: La dobutamina y la milrinona son los inótropos de elección para aumentar la perfusión y preservar la perfusión de los órganos finales en pacientes con un gasto cardíaco disminuido.Las indicaciones obligadas para los inótropos incluyen la presión arterial sistólica<90 mmHg, la hipotensión sintomática a pesar de las presiones de llenado adecuadas (PCWP 15-18 mmHg), el empeoramiento de la función renal o la respuesta inadecuada a los vasodilatadoresIV. Es necesario realizar una selección prudente de los pacientes, ya que los datos sugieren que los resultados son malos cuando se administran inótropos a pacientes con un gasto cardíaco conservado. El ensayo OPTIME-CHF mostró un aumento no significativo de la mortalidad y las arritmias cuando se administraron infusiones de milrinona a los pacientes como parte de los cuidados estándar.25 La milrinona debe elegirse para tratar a los pacientes que reciben betabloqueantes concomitantes, ya que ejerce un efecto sobre el gasto cardíaco y la resistencia vascular sistémica a través de la inhibición de la fosfodiesterasa, mientras que la dobutamina es un agonista abeta1. La dobutamina, sin embargo, es la mejor opción para los pacientes hipotensos, ya que la milrinona puede causar caídas significativas de la presión arterial.15
Planificación del alta
El último paso en el tratamiento de la ICAD es la planificación del alta y el seguimiento. Tanto las directrices del ACC/AHA como las de la Sociedad Americana de Insuficiencia Cardíaca (HFSA) defienden la importancia de una planificación adecuada del alta.14,15 Los pilares de los cuidados al alta basados en la evidencia incluyen el tratamiento de los factores exacerbantes, como la interrupción de los antagonistas del calcio no dihidropiridínicos o de los AINE, la consecución de un estado de volumen óptimo, la optimización del tratamiento farmacológico y la transición al tratamiento oral fuera del paciente (TABLA 4).15 Las directrices del ACC/AHA recomiendan dar instrucciones escritas o material educativo a los pacientes y/o cuidadores en el momento del alta que aborden los siguientes aspectos: nivel de actividad, dieta, medicación al alta, cita de seguimiento, control del peso y qué hacer si los síntomas empeoran.14Las directrices también indican el beneficio de iniciar una terapia oral para reducir la mortalidad de la IC durante el ingreso hospitalario, como los inhibidores de la enzima convertidora de la angiotensina (IECA) y los betabloqueantes.Los estudios demuestran que la atención basada en las directrices disminuye la mortalidad,26 pero no muestra una reducción en las tasas de reingreso de los pacientes con IC.27,28

El apoyo al alta, o la gestión de casos en el hospital, se está utilizando ahora para la planificación del alta. El apoyo al alta es un enfoque de atención multidisciplinar y basado en el equipo que se ocupa del apoyo a la medicación, la educación del paciente, la planificación del seguimiento y la coordinación de la información. Un metaanálisis de 18 ensayos controlados y aleatorizados (ECA) que analizaban la planificación del alta con apoyo posterior al alta y que incluía a 3.304 pacientes encontró una reducción significativa de los reingresos por todas las causas (riesgo relativo 0,75; IC del 95%: 0,68-0,88).29 La validez externa del metaanálisis es difícil de determinar, pero puede ofrecer algunas estrategias rentables. Una estrategia procede de un ECA de 223 pacientes con IC que comparó el apoyo tradicional al alta con materiales educativos con una sesión de enseñanza individual de una hora de duración con un educador de enfermería antes del alta.30 El grupo de intervención de enfermería tuvo un menor riesgo de rehospitalización o muerte 180 días después del alta y se estimó un ahorro de 2.823 dólares por paciente. Por el contrario, los estudios observacionales a gran escala no han encontrado ninguna relación entre los pacientes que reciben material educativo y la disminución de las tasas de reingreso.26,31 Las directrices actuales del ACC/AHA no indican explícitamente cómo dar de alta a los pacientes después de la ICAD, aparte de la entrega de material educativo.14 Es posible que las recomendaciones de las guías no proporcionen procedimientos de alta que ayuden a los hospitales a cumplir con las expectativas de los CMS.
Aunque los materiales educativos al alta no mostraron beneficios en cuanto a la mortalidad, cada agente oral adicional utilizado para el tratamiento de la HFD, como un betabloqueante o un antagonista de la aldosterona, puede disminuir las hospitalizaciones y/o la mortalidad entre un 25% y un 35%. Las directrices del ACC/AHA sugieren que muchos pacientes con IC son dados de alta antes de que se alcance un estado volumétrico óptimo o son enviados a casa sin el beneficio de las terapias que salvan vidas, lo que perpetúa el rápido reingreso de dichos pacientes.14 El farmacéutico del hospital debe ser un defensor de los pacientes en el equipo de apoyo al alta, ayudando a la conciliación de la medicación, interrumpiendo los medicamentos contraindicados y recomendando una farmacoterapia para la IC basada en la evidencia. La medicación debe iniciarse lo antes posible, idealmente en el entorno hospitalario; el inicio de estos fármacos puede exacerbar los síntomas de la IC que precipitan la ICAD, lo que resalta aún más la importancia del seguimiento oportuno de esta población de pacientes.
Conclusión
La ICAD es una carga para los pacientes, los proveedores de atención médica y los contribuyentes. La farmacoterapia para la ICAD no ha cambiado recientemente, pero la utilización de equipos de apoyo al alta y el seguimiento rápido tras el alta proporcionan oportunidades para la intervención del farmacéutico, tanto dentro como fuera del hospital. Los farmacéuticos comunitarios pueden desempeñar un papel importante en la continuidad de la atención, ayudando a la transición de los pacientes desde el hospital a la atención primaria. Los farmacéuticos están preparados para ofrecer recomendaciones adecuadas basadas en las directrices, ayudar a la conciliación de la medicación y proporcionar educación al alta. Con los recientes cambios en los reembolsos de los CMS, los farmacéuticos deben asumir un papel más importante en el tratamiento de esta enfermedad crónica.
1. Winslow R, Wang SS. La insuficiencia cardíaca lleva a menos personas al hospital. Wall Street Journal. 19 de octubre de 2011. http://online.wsj.com/article/SB10001424052970203658804576639360226103584.html. Consultado el 1 de septiembre de 2012.
2. Lloyd-Jones D, Adams RJ, Brown TM, et al. Heart diseaseand stroke statistics-2010 update. Un informe de la American HeartAssociation. Circulation. 2010;121:e46-e215.
3. Michota FA Jr, Amin A. Bridging the gap between evidence and practice in acute decompensated heart failure management. J Hosp Med. 2008;3(suppl):S7-S15.
4. Rau J. Medicare penalizará a 2.217 hospitales por exceso de readmisiones. Kaiser Health News.13 de agosto de 2012.www.kaiserhealthnews.org/Stories/2012/August/13/medicare-hospitals-readmissions-penalties.aspx.Accessed 1 de septiembre de 2012.
5. Chen J, Normand ST, Wang Y, Krumholz HM. National andregional trends in heart failure hospitalization and mortality rates forMedicare beneficiaries, 1998-2008. JAMA. 2011;306:1669-1678.
6. Amin A. ¿Quién está gestionando la insuficiencia cardíaca aguda descompensada? La necesidad de un enfoque multidisciplinario. J Hosp Med. 2008;6(suppl):S1-S6.
7. Pinto DS, Lewis S. Fisiopatología de la insuficiencia cardíaca aguda descompensada. En: Basow DS, ed. UpToDate. Waltham, MA: UpToDate; 2012.
8. Crouch MA, Didomenico RJ, Rodgers JE. Applyingconsensus guidelines in the management of acute decompensated heartfailure. Programa ACPE #204-000-06-407-H01. Bethesda, MD: ASHP Advantage;2007.
9. Joseph SM, Cedars AM, Ewald GA, et al. Insuficiencia cardíaca aguda descompensada: manejo médico contemporáneo. Tex Heart Inst J. 2009;36:510-520.
10. Pinto DS, Lewis S. Evaluación de la insuficiencia cardíaca aguda descompensada. En: Basow DS, ed. UpToDate. Waltham, MA: UpToDate; 2012.
11. Forrester JS, Diamond G, Chatterjee K, et al. Medicaltherapy of acute myocardial infarction by application of hemodynamicsubsets. N Engl J Med. 1976;295:1356-1362.
12. Nohria A, Mielniczuk LM, Stevenson LW. Evaluación y seguimiento de pacientes con síndromes de insuficiencia cardíaca aguda. Am J Cardiol. 2005;96:32G-40G.
13. Abraham WT, Adams KF, Fonarow GC, et al. In-hospitalmortality in patients with acute decompensated heart failure requiringintravenous vasoactive medications: an analysis from the AcuteDecompensated Heart Failure National Registry (ADHERE). J Am Coll Cardiol. 2005;46:57-64.
14. Hunt SA, Abraham WT, Chin MH, et al. 2009 focusedupdate incorporated into the ACC/AHA 2005 guidelines for the diagnosisand management of heart failure in adults: a report of the AmericanCollege of Cardiology Foundation/American Heart Association Task Forceon Practice Guidelines. Circulation. 2009;119;e391-e479.
15. Sociedad Americana de Insuficiencia Cardíaca. Evaluation andmanagement of patients with acute decompensated heart failure: HFSA 2010comprehensive heart failure practice guideline. J Card Fail. 2010;16:e134-e156.
16. Colucci W. Tratamiento de la insuficiencia cardíaca aguda descompensada: Componentes de la terapia. En: Basow DS, ed. UpToDate. Waltham, MA: UpToDate; 2012.
17. Faris R, Flather MD, Purcell H, et al. Diuréticos para la insuficiencia cardíaca. Cochrane Database Syst Rev. 2012;(1):CD003838.
18. Gheorghiade M, Filippatos G. Reevaluación del tratamiento de los síndromes de insuficiencia cardíaca aguda: el registro ADHERE. Eur Heart J. 2005;7:813-819.
19. Felker GM, Lee KL, Bull DA, et al. Estrategias diuréticas en pacientes con insuficiencia cardíaca aguda descompensada. N Engl J Med. 2011;364:797-805.
20. Effectiveness of spironolactone added to anangiotensin-converting enzyme inhibitor and a loop diuretic for severechronic congestive heart failure (the Randomized Aldactone EvaluationStudy ). Am J Cardiol. 1996;78:902-907.
21. Pitt B, Remme W, Zannad F, et al. Eplerenone, aselective aldosterone blocker, in patients with left ventriculardysfunction after myocardial infarction. N Engl J Med. 2003;348:1309-1321.
22. Zannad F, McMurray JJ, Krum H, et al; EMPHASIS-HFStudy Group. Eplerenona en pacientes con insuficiencia cardíaca sistólica y síntomas leves. N Engl J Med. 2011;364:11-21.
23. Gerhard T, Zineh I, Winterstein AG, Hartzema AG.Pharmacoeconomic modeling of nesiritide versus dobutamine fordecompensated heart failure. Pharmacotherapy. 2006;26:34-43.
24. Lissovoy G, Stier DM, Ciesla G, et al. Economicimplications of nesiritide versus dobutamine in the treatment ofpatients with acute decompensated congestive heart failure. Am J Cardiol. 2003;92:631-633.
25. Cuffe MS, Califf RM, Adams KF Jr, et al. Short-tervenous milrinone for acute exacerbation of heart failure: arandomized controlled trial. JAMA. 2002;287:1541-1547.
26. Kfoury AG, French TK, Horne BD, et al. Incrementalsurvival benefit with adherence to standardized heart failure coremeasures: a performance evaluation study of 2958 patients. J Card Fail. 2008;14:95-102.
27. Patterson ME, Hernández AF, Hammill BG, et al. Medidas de rendimiento del proceso de atención y resultados a largo plazo en pacienteshospitalizados con insuficiencia cardíaca. Med Care. 2010;48:210.
28. Fonarow GC, Abraham WT, Albert NM, et al. Associationbetween performance measures and clinical outcomes for patientshospitalized with heart failure. JAMA. 2007;297:61-70.
29. Phillips CO, Wright SM, Kern DE, et al. Comprehensivedischarge planning with postdischarge support for older patients withcongestive heart failure: a meta-analysis. JAMA. 2004;291:1358-1367.
30. Koelling TM, Johnson ML, Cody RJ, Aaronson KD.Discharge education improves clinical outcomes in patients with chroniceart failure. Circulation. 2005;111:179-185.
31. Jha AK, Orav EJ, Epstein AM. Información pública sobre la planificación del alta y las tasas de reingresos. N Engl J Med. 2009;361:2637-2645.