Karthish Manthiram sueña con un futuro electrificado. Este ingeniero químico del MIT forma parte de un grupo cada vez mayor de investigadores que estudian cómo la electroquímica impulsada por las energías renovables podría sustituir a los combustibles fósiles como base de la industria química.
«La visión general es pensar en un futuro en el que la fabricación de productos químicos comience sólo con dióxido de carbono, agua y nitrógeno», afirma Manthiram. Si empezamos con estas tres materias primas y disponemos de electricidad renovable, podemos pensar en utilizar el dióxido de carbono como fuente de átomos de carbono, usar el agua para los oxígenos y los hidrógenos, y el dinitrógeno como fuente de nitrógeno, y empezar a unir moléculas orgánicas relativamente complejas», afirma.
En ese mundo futuro con el que soñamos, podríamos fabricar amoníaco sólo con aire, agua y electricidad renovable
El amoníaco ocupa un lugar destacado en la lista de moléculas que los investigadores electroquímicos quieren fabricar de esta manera. Ingrediente clave de los fertilizantes sintéticos, cada año se producen unos 175 millones de toneladas de amoníaco. Pero las enormes cantidades en las que se fabrica, y la naturaleza intensiva en energía de su producción, significan que las plantas de amoníaco consumen aproximadamente el 2% de la producción mundial de energía, y producen una proporción similar de las emisiones mundiales de dióxido de carbono.
Con el rápido aumento de la disponibilidad de electricidad renovable, los investigadores pueden ver una vía alternativa para el amoníaco. En ese mundo futuro con el que soñamos, podríamos fabricar amoníaco sólo con aire, agua y electricidad renovable», afirma Manthiram. Este año, el laboratorio de Manthiram se ha unido al puñado de laboratorios de todo el mundo que han demostrado definitivamente que, cuando está mediado por un electrocatalizador de litio, el amoníaco puede fabricarse de esta manera.
En un campo de investigación joven en el que las primeras afirmaciones sobre la producción electroquímica de amoníaco a menudo no han resistido el escrutinio, el puñado de resultados sólidos que implican la producción de amoníaco mediada por litio podría formar la base sólida a partir de la cual se empieza a construir un futuro de amoníaco limpio.
Dolor de cabeza al dividir
El gran reto de la síntesis de amoníaco, ya sea electroquímica o de otro tipo, es el requisito de tomar el dinitrógeno del aire, y romperlo en dos. El triple enlace que mantiene unidos los dos átomos de nitrógeno es uno de los más fuertes conocidos.
Durante el último siglo, las plantas de amoníaco han superado la reticencia del dinitrógeno a reaccionar mediante un proceso de dos pasos. En el primer paso, la reacción de reformado de vapor y metano, el agua y el metano se calientan sobre un catalizador que fomenta el intercambio de parejas atómicas, produciendo una corriente de dióxido de carbono e hidrógeno. A continuación, el hidrógeno se hace reaccionar con nitrógeno sobre un catalizador de hierro en el proceso Haber-Bosch, llamado así por los químicos alemanes Fritz Haber, que inventó la reacción, y Carl Bosch, que la perfeccionó para la industria.
Una gran parte de nuestra desigualdad en el acceso a los alimentos en el mundo se debe a que la producción de amoníaco está centralizada
Lo que Haber descubrió fue una forma de evitar el problema de que, a las altas temperaturas necesarias para dividir el dinitrógeno, el equilibrio para la formación de amoníaco se encuentra muy a la izquierda, dice Ib Chorkendorff, investigador de catálisis en la Universidad Técnica de Dinamarca, y director del Centro Villum para la ciencia de los combustibles y productos químicos sostenibles. El gran invento de Haber fue darse cuenta de que no se obtiene amoníaco a menos que se presurice», afirma Chorkendorff. Si tomas cuatro moles de gas y los conviertes en dos, la presión ayuda mucho». Hoy en día, las plantas de Haber Bosch suelen funcionar a presiones superiores a las 200 atmósferas.
El dióxido de carbono estequiométrico que produce la reacción, así como las emisiones de carbono que conlleva la generación de las altas temperaturas y presiones necesarias, es una razón de peso para buscar un enfoque alternativo. Pero incluso si el dióxido de carbono no fuera un gas que atrapa los infrarrojos y provoca el calentamiento global, seguiríamos teniendo un problema con el proceso», afirma Manthiram. El coste de construir reactores de alta presión inclina el equilibrio económico hacia la construcción de plantas de amoníaco muy grandes y centralizadas. Una gran parte de la desigualdad en el acceso a los alimentos en el mundo se debe a que la producción de amoníaco está centralizada», afirma Manthiram. En el África subsahariana, la infraestructura de distribución es tan pobre que el fertilizante acaba costando entre dos y tres veces más que la media internacional. Esto limita su uso, lo que lleva a un bajo rendimiento de las cosechas, hambre, menor productividad de la mano de obra, menores ingresos, lo que limita aún más la capacidad de costear el fertilizante. Se trata de un problema enorme que hay que resolver»
El amoníaco producido a partir de aire, agua y electricidad renovable, a temperaturas y presiones ambientales, podría fabricarse allí donde se necesite.
Sintiendo el tirón de las renovables
Los investigadores llevan décadas intentando encontrar alternativas más ecológicas a la reacción Haber-Bosch. La diferencia esta vez es el rápido cambio del mercado energético, dice Doug MacFarlane, químico de la Universidad de Monash que dirige el Centro de Excelencia para la Ciencia de los Electromateriales del Consejo Australiano de Investigación. En los últimos 10 años, más o menos, se han puesto a disposición cantidades crecientes de energía renovable cada vez más barata», afirma MacFarlane. Desde 2010, el precio de la energía solar ha bajado un 80%, y el de la energía eólica un 50%, con la perspectiva de que siga bajando. Esto ha puesto el foco en las tecnologías electroquímicas en general, utilizando los electrones como el último reductor», dice.

Fuente: Cortesía del Consejo de Instalaciones Científicas y Tecnológicas
El Demostrador de Amoníaco Verde de Siemens Energy en el Reino Unido está probando la división del agua y la química Haber-Bosch
El laboratorio de MacFarlane -como muchos laboratorios de síntesis electroquímica- se centró inicialmente en la química de división del agua impulsada por las energías renovables, para producir un flujo de hidrógeno limpio que pudiera utilizarse como materia prima o combustible. La segunda oleada de investigación se centró en la reducción del dióxido de carbono, para convertir las emisiones de carbono en productos útiles, afirma. A partir de ahí, hace unos seis años empezamos a darnos cuenta de que nuestra investigación tenía una tercera perspectiva: la reducción del nitrógeno», explica MacFarlane. Son las mismas ideas, el mismo equipo de laboratorio, pero un sustrato y un producto diferente». En lugar de hidrógeno, la célula produciría una corriente de amoníaco.
La producción de amoníaco podría ir mucho más allá del uso de fertilizantes. La caída de los precios de la electricidad, impulsada por las energías renovables, ya ha provocado un replanteamiento de la reacción tradicional de reformado al vapor (véase el recuadro Reforma eléctrica, más abajo). Países como Australia, que cuentan con recursos solares y eólicos muy superiores a sus propias necesidades, tienen en el punto de mira el amoníaco sintetizado electroquímicamente no sólo para la producción de fertilizantes más limpios, sino como un combustible verde que podría permitir la exportación de energía renovable.
En mayo de 2020, MacFarlane y sus colegas publicaron una hoja de ruta en la que se exponía el camino potencial hacia una economía verde del amoníaco. El concepto de primera generación, la idea de combinar la producción convencional de amoníaco con la captura de carbono, ya está siendo sustituido por un enfoque de segunda generación, en el que el hidrógeno para Haber-Bosch proviene de la división electroquímica del agua alimentada por energías renovables, en lugar de la reforma del vapor impulsada por el metano.
Después de décadas de investigación, la división electroquímica del agua ha llegado al punto de que están disponibles divisores de agua a escala industrial, de la talla de ITM-Power en el Reino Unido y Siemens en Alemania. Siemens ya ha probado el concepto de combinar la separación de agua y Haber-Bosch en el demostrador de amoníaco verde de Siemens en Oxfordshire. En la región de Pilbara (Australia Occidental), que recibe una de las mayores cantidades de energía solar anual del planeta, Yara Fertilisers también se está preparando para probar el cambio. Esta planta produce actualmente el 5% del amoníaco del mundo.
El principal obstáculo para la adopción generalizada de la producción de amoníaco de segunda generación ya no es el coste de la electricidad renovable, afirma MacFarlane. La barrera es el coste de capital de las células de electrólisis», afirma. Los electrodos de mejor rendimiento para la división del agua utilizan metales preciosos.
Reformación eléctrica
El primer paso en la síntesis convencional del amoníaco es generar el hidrógeno que se combinará con el dinitrógeno para hacer amoníaco. En la actualidad, ese hidrógeno procede del metano, a través de la reacción de reformado con vapor, impulsada por un conjunto de quemadores de gas que rodean los tubos recubiertos de catalizador en los que tiene lugar la reacción.
La cantidad de catalizador puede reducirse en un orden de magnitud
El reformado con vapor es tan endotérmico, que genera un importante gradiente de temperatura dentro del tubo, lo que puede provocar la acumulación de carbono en la superficie del catalizador y el bloqueo o incluso la rotura del tubo.
En 2019, Chorkendorff demostró que la reacción podía impulsarse de forma mucho más eficaz mediante el calentamiento óhmico. El paso de una corriente eléctrica a través del tubo de acero del reformador de vapor genera calor in situ, debido a la resistividad eléctrica. ‘Conseguimos un contacto muy estrecho entre la fuente de calor y el catalizador, lo que elimina todos los problemas de transporte de calor y no tenemos ningún gradiente de temperatura’, dice Chorkendorff.
Además de evitar la deposición de carbono, el calentamiento óhmico ofrece muchas ventajas, añade Chorkendorff. La puesta en marcha de una planta de reformado de vapor suele durar aproximadamente una semana, pero el sistema de calentamiento óhmico tarda unos dos minutos. La cantidad de catalizador puede reducirse en un orden de magnitud y el tamaño de la planta en dos órdenes de magnitud», afirma. Antes, el coste de la electricidad hacía que el calentamiento óhmico fuera prohibitivo, pero con las energías renovables eso ya no es así, afirma Chorkendorff. La empresa con la que Chorkendorff se asoció para llevar a cabo la investigación ya está trabajando en una planta piloto y tiene planes para el calentamiento óhmico mucho más allá del reformado de vapor, afirma.
Reducción de costes
Encontrar alternativas de menor coste a los electrodos de platino e iridio ha sido un objetivo a largo plazo del laboratorio de Chorkendorf. En 2005, el equipo demostró que el sulfuro de molibdeno es un potente electrocatalizador para la reacción de evolución del hidrógeno. La parte catalíticamente activa del MoS2 ha resultado estar a lo largo de los bordes del catalizador, en lugar de su superficie plana, lo que ha dado lugar a una gran cantidad de investigaciones para desarrollar materiales de MoS2 nanoestructurados o en capas que maximicen la proporción de bordes.
Sabemos que un catalizador OER tiene que ser un óxido y tiene que ser estable a un pH extremo
«Hemos estudiado mucho la evolución del hidrógeno, pero consideramos que está resuelta: hay algunos catalizadores muy buenos», dice Chorkendorff. ‘El verdadero problema es la energía que se pierde debido a la evolución del oxígeno’, argumenta. Las pilas de separación de agua producen hidrógeno en el cátodo y oxígeno en el ánodo (véase el recuadro Mientras tanto, en el ánodo). La baja eficiencia de la reacción de evolución del oxígeno (REO) en el divisor de agua hace que todo el proceso requiera más energía y sea más costoso. ‘Hoy en día funcionan con una eficiencia máxima del 70%, pero normalmente no es tan alta’
A pesar de los años de trabajo, el avance del catalizador OER aún está por llegar. No hay nada que diga que no podemos encontrar un material, pero sabemos que se está estrechando: sabemos que tiene que ser un óxido, que tiene que ser estable en una solución ácida fuerte o alcalina fuerte», dice Chorkendorff. Los electrolizadores funcionan en uno u otro extremo de la escala de pH para maximizar la eficiencia, pero los catalizadores OER más activos no son lo suficientemente estables en estas condiciones para su uso práctico a largo plazo.
Un concepto, introducido por Daniel Nocera, entonces en el Instituto Tecnológico de Massachusetts (EE.UU.), es el de los catalizadores OER autorregenerables, que se forman in situ y se regeneran continuamente a partir de los iones metálicos del electrolito. Los electrocatalizadores de Nocera funcionaban en condiciones neutras. En 2019, MacFarlane y sus colegas demostraron un catalizador OER de óxido metálico mixto autorregenerativo generado in situ para condiciones fuertemente ácidas.
Mientras tanto, en el ánodo
Para la mayoría de los procesos electroquímicos -hacer hidrógeno o amoníaco, o reducir el dióxido de carbono- todas las miradas están puestas en el cátodo. La reacción complementaria que tiene lugar en el ánodo es un proceso oxidativo que suele generar oxígeno, un subproducto inocuo del evento principal.
«Mucha gente considera el oxígeno como un simple producto de desecho», dice Chorkendorff. Pero hay usos potencialmente valiosos para el gas. Una corriente de oxígeno puro es la clave del concepto de las centrales eléctricas de oxicombustión, que evitan los problemas de captura de carbono quemando el combustible en oxígeno en lugar de aire. Si se quema la biomasa en una central eléctrica con ese oxígeno, se obtiene un grado mucho mayor de dióxido de carbono», afirma Chorkendorff.
Manthiram también ve valor en la reacción anódica. ‘Hemos estado trabajando en métodos por los que se puede utilizar ese oxígeno para la síntesis química, en lugar de intentar combinar dos átomos de oxígeno para hacer dioxígeno, lo que es cinéticamente difícil de hacer’. A partir de trabajos anteriores, el equipo sabía que el óxido de manganeso es un catalizador que oxida el agua, generando una especie de oxo manganeso en el proceso. ¿Y si pudiéramos interceptarlo utilizando una olefina, para hacer un epóxido? pregunta Manthiram. Era una mera conjetura, pero de alguna manera funcionó». Además de producir epóxidos, el equipo ha demostrado que puede insertar oxígeno en un enlace carbono-carbono para producir lactonas. Podría hacer que el electrolizador de agua fuera más viable económicamente», afirma Manthiram. No hay manera de hacer todo el hidrógeno del mundo de esta manera – tenemos una necesidad demasiado grande de hidrógeno – pero podríamos hacer un poco de hidrógeno que es realmente barato, mientras que la co-creación de lactonas que van en plásticos biodegradables de alto volumen, o epóxidos de alto volumen para hacer etilenglicol.
Fuentes poco fiables
Con la división del agua aún por perfeccionar, y con su continua dependencia de la reacción Haber-Bosch, la esperanza es que la producción de amoníaco verde de segunda generación sea un peldaño hacia el objetivo final de producir amoníaco directamente por medios electroquímicos. En lugar de producir gas dihidrógeno, los átomos de hidrógeno y nitrógeno podrían combinarse in situ en el cátodo para producir amoníaco.
El principal reto es encontrar la manera de favorecer la producción de amoníaco en lugar de la formación de dihidrógeno, explica Manthiram. El depósito de electrones en el cátodo podría reaccionar con dos protones en la solución para producir hidrógeno; o, en cambio, reaccionar con el nitrógeno para romper el triple enlace, y también reclutar seis protones, para producir dos moléculas de amoníaco», dice Manthiram. Prácticamente cualquier catalizador tenderá a producir más hidrógeno que amoníaco».
En los últimos cinco años, más o menos, han aparecido una serie de artículos que parecían mostrar catalizadores que podían producir algo de amoníaco en el flujo de gas predominantemente hidrógeno producido en el cátodo. Mientras tanto, el laboratorio de MacFarlane estaba probando la idea de que una buena manera de suprimir la producción de hidrógeno sería eliminar una fuente importante de protones: el electrolito. Cambiando a un electrolito líquido iónico aprótico, y luego sólo añadiendo la cantidad controlada de agua, ácido o base, el equipo demostró que podía favorecer la producción de amoníaco.
Cualquier catalizador tiende a producir más hidrógeno que amoníaco
«El trabajo aprótico es bastante agnóstico en cuanto al catalizador, por lo que nuestro enfoque siempre fue aplicarlo al mejor catalizador que pudiéramos encontrar», afirma MacFarlane. Cada vez que se publicaba un artículo sobre un nuevo catalizador, tratábamos rápidamente de repetir el trabajo de la literatura y luego lo aplicábamos en nuestro trabajo aprótico. Con cierta frustración, en algunos casos tras hablar con los autores implicados, nunca conseguimos que un catalizador de la literatura funcionara bien. Acabamos convirtiéndonos en expertos en lo que no funciona.’
Aunque transformar el nitrógeno en amoníaco es muy difícil, es muy fácil producir trazas de amoníaco a partir de otras fuentes de nitrógeno. La larga lista de posibles fuentes de nitrógeno adventicio incluye el electrodo, o trazas de NO o NO2 en el suministro de gas nitrógeno. Si se eliminan o se tienen en cuenta estas fuentes, la cantidad de nitrógeno que se convierte en amoníaco en la mayoría de los sistemas catalizadores es tan baja que no tiene ningún interés práctico, afirma MacFarlane.
«Ha sido un gran partidario de averiguar de dónde procede realmente el amoníaco y si el catalizador está haciendo realmente el trabajo», afirma Lauren Greenlee, de la Universidad de Arkansas (EE.UU.), que fue una de las primeras en trabajar en la producción electrocatalítica de amoníaco, y una de las primeras en destacar que el amoníaco adventicio era un problema importante. «Convertir directamente el dinitrógeno en dos moléculas de amoníaco en la superficie del catalizador es un problema muy difícil, y no sé si estamos tan cerca de resolverlo».
Por ahora, Greenlee se ha alejado de los experimentos de producción de amoníaco para llevar a cabo una investigación más fundamental del problema. ‘Nos interesamos por la química del electrolito y trabajamos para entender la química de la superficie del catalizador y cómo cambia con estos electrolitos’, dice Greenlee. ‘No prometo nada sobre la fabricación de amoníaco, pero espero que aprendamos mucho sobre el catalizador y contribuyamos a ese campo.’
Mirando hacia el litio
Al igual que Greenlee y MacFarlane, Chorkendorff ha establecido los rigurosos experimentos de control, incluyendo el uso de dinitrógeno radiomarcado, necesarios para demostrar que el amoníaco producido proviene efectivamente del dinitrógeno y no de una fuente de nitrógeno alternativa. Hemos publicado un método, porque estoy harto de ver todos esos artículos que afirman que están produciendo amoníaco, porque no están produciendo nada», dice Chorkendorff. ‘Sólo conozco un sistema que está haciendo amoníaco con seguridad, y es la ruta mediada por litio.
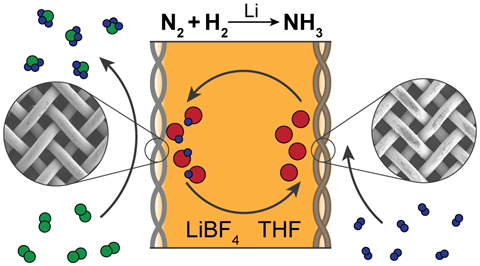
Fuente: © Nikifar Lazouski et al/Springer Nature Limited 2020
Los catalizadores basados en el litio parecen ser el mejor sistema, como en este desarrollado por el grupo de Karthish Manthiram en el MIT
El litio es el único metal que puede reaccionar espontáneamente con el dinitrógeno para formar un nitruro metálico – rompiendo el triple enlace del dinitrógeno en el proceso. La capacidad del litio para generar amoníaco fue demostrada por investigadores japoneses a mediados de la década de 1990, el único protocolo que Chorkendorff fue capaz de reproducir.
El enfoque mediado por el litio para obtener amoníaco es actualmente el único que sin duda funciona, coincide MacFarlane. El inconveniente del litio es que implica una fuerte penalización de la eficiencia energética, ya que requiere un sobrepotencial de más de 3V. Se trata de una gran cantidad de energía que se pierde en forma de calor, por lo que no se ha desarrollado anteriormente», afirma MacFarlane. El enfoque mediado por litio es nuestro principal enfoque en este momento», afirma MacFarlane. Una forma obvia de resolver el problema de la energía es buscar otros metales, y sus nitruros metálicos, que lleven a cabo este proceso con un coste energético menor, un potencial energético menos negativo», afirma. ‘En primer lugar, estamos averiguando qué es lo que realmente se asienta en esa superficie para llevar a cabo ese proceso. Estamos utilizando el sincrotrón de Stanford, tratando de construir un modelo para el proceso.
Hace un par de años, las tasas eran tan bajas que ni siquiera sabíamos si estábamos fabricando amoníaco
Manthiram, por su parte, ha estado buscando formas de abordar el problema de hacer reaccionar eficazmente los gases en una célula electroquímica de base líquida. ‘Demostramos cómo se podía utilizar un electrodo de difusión de gas como medio para introducir el gas nitrógeno de forma mucho más eficaz en el reactor, superar las limitaciones de transporte y, por tanto, producir amoníaco a un ritmo mucho más rápido y con una mayor selectividad para producir amoníaco frente a hidrógeno’, afirma. El equipo logró un rendimiento récord de amoníaco.
Hasta ahora, el reactor de difusión de gas sólo funciona durante unos minutos, y a un sobrepotencial extremo. ‘En cierto modo lo están forzando – pero a pesar de los inconvenientes, me gusta mucho ese trabajo’, dice Chorkendorff. Muestra el camino a seguir y la ciencia que se necesita».
El equipo -y el campo- tiene mucho trabajo por delante para convertir el proceso en una solución práctica para fertilizar cultivos o para almacenar y transportar energía renovable, dice Manthiram. Pero cuando pensamos en la situación en la que nos encontrábamos en este campo hace un par de años, los índices eran tan bajos que ni siquiera sabíamos si estábamos fabricando amoníaco. Por fin hemos llegado a un punto en el que, según nuestro artículo, los índices son tan altos que no es necesario hacer un experimento de control con nitrógeno etiquetado para demostrar que el amoníaco es real. Es imposible que haya amoníaco adventicio en esas concentraciones». Aunque se apresura a añadir que el equipo sigue haciendo los experimentos de control.
Por ahora, el equipo está aguantando el problema de sobrepotencialidad inherente al litio. Es el peaje que hay que pagar para seguir este camino, y hemos aceptado pagar ese precio, porque no hay ningún otro sistema que pueda funcionar ni siquiera cerca de las tasas que hemos logrado con el litio», dice Manthiram. Me sorprendería que en la próxima década no aparecieran otros métodos que no pagaran ese precio», añade. Pero aquí es donde se encuentra el campo ahora mismo.’
James Mitchell Crow es un escritor científico con sede en Melbourne, Australia