La motilidad es la capacidad de un organismo de moverse por sí mismo mediante flagelos en forma de hélice, únicos en las bacterias, o mediante fibrillas especiales que producen una forma de motilidad deslizante. Las bacterias móviles se mueven mediante flagelos, apéndices locomotores similares a hilos que se extienden hacia fuera desde la membrana plasmática y la pared celular, ya sea un solo flagelo o múltiples flagelos. La motilidad ha sido reconocida desde hace tiempo como una importante herramienta taxonómica y una característica biológica de los microorganismos. La presencia de flagelos se da principalmente en los bacilos, pero hay unos pocos cocos flagelados, por lo que la motilidad es un medio muy importante de identificación en la familia Enterobacteriaceae. Desde los primeros días en el campo de la microbiología, la capacidad de movimiento de las bacterias se ha utilizado como medio de diferenciación y clasificación de los organismos.
Objetivo
- Determinar la motilidad de las bacterias.
- Diferenciar entre bacterias móviles y no móviles.
Principio
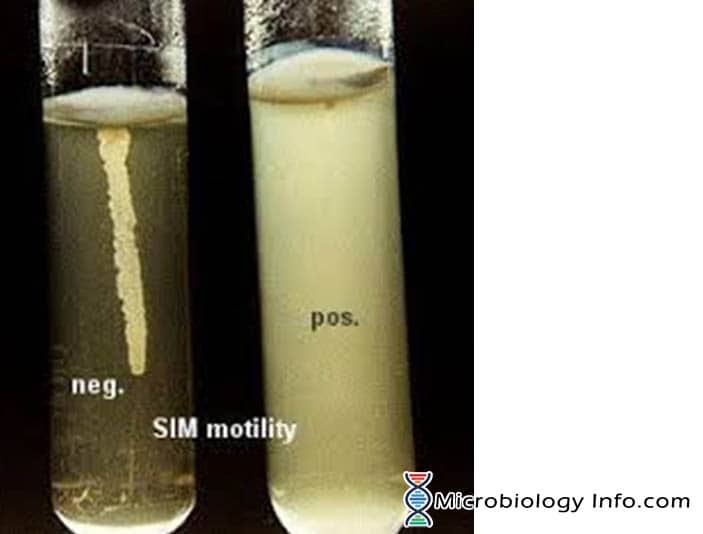
La motilidad de las bacterias se demuestra principalmente en un medio de agar semisólido. En los medios de agar semisólidos, las bacterias móviles se «arremolinan» y dan un crecimiento difuso que se reconoce fácilmente a simple vista.El medio que se utiliza principalmente para este fin es el medio SIM (Sulphide Indole Motility medium), que es un medio diferencial combinado que pone a prueba tres parámetros diferentes, la reducción del azufre, la producción de indoles y la motilidad. Este medio tiene una consistencia muy blanda que permite a las bacterias móviles migrar fácilmente a través de ellas causando enturbiamiento. El inóculo se clava en el centro de un agar semisólido profundo. La motilidad bacteriana es evidente por una zona difusa de crecimiento que se extiende desde la línea de inoculación. Algunos organismos crecen en todo el medio, mientras que otros muestran pequeñas zonas o nódulos que crecen fuera de la línea de inoculación. Las bacterias no móviles sólo crecerán en el tubo de agar blando y sólo en la zona donde se inoculan.
Medios:
Medio SIM
Digerido pancreático de caseína 20,0g, Digerido péptico de tejido animal 6,1g, Agar 3,5g, Fe(NH4)2(SO4)2-6H2O 0.2g, Na2S2O3-5H2O 0,2g, pH 7,3 ± 0,2 a 25°C
Método
- Toque con una aguja recta una colonia de un cultivo joven (de 18 a 24 horas) que esté creciendo en un medio de agar.
- Apuñale una vez a una profundidad de sólo 1/3 a ½ pulgada en el centro del tubo. Asegúrese de mantener la aguja en la misma línea en la que entró al retirarla del medio.
- Incube a 35°-37°C y examine diariamente durante un máximo de 7 días.
- Observe si hay una zona difusa de crecimiento que se abre desde la línea de inoculación.
Resultados esperados
- Positivos: Crecimientos difusos y brumosos que se extienden por todo el medio haciéndolo ligeramente opaco.
- Negativo: Crecimientos que se limitan a la línea de la puñalada, con márgenes bien definidos y dejando el medio circundante claramente transparente.
- Se utiliza para la diferenciación de microorganismos sobre la base de la motilidad en un entorno de laboratorio.
- Se realiza para asignar una clasificación taxonómica a los organismos.
- Las pruebas de motilidad son importantes en la caracterización de patógenos.
- Las pruebas se emplean a menudo en los protocolos de identificación de la familia Enterobacteriaceae
- La prueba de motilidad también se utiliza para la diferenciación de especies de cocos grampositivos, Enterococos. Enterococcus faecium y E. faecalis no son móviles, mientras que E. gallinarum y E. casseliflavus/E. flavescens generalmente son móviles.
- Algunos organismos no mostrarán un crecimiento suficiente en este medio para hacer una determinación precisa, y se requieren pruebas adicionales de seguimiento.
- Se recomienda realizar pruebas bioquímicas, inmunológicas, moleculares o de espectrometría de masas en colonias procedentes de cultivos puros para una identificación completa.
- Pueden producirse reacciones falsas negativas si los flagelos bacterianos se dañan debido al calentamiento, la agitación u otro traumatismo. Dicho choque ambiental hará que el organismo no sea móvil.
- Los organismos que son débilmente móviles pueden dar lugar a reacciones falsas negativas.
- Cuando se inoculan medios semisólidos, es importante que la aguja de inoculación se retire a lo largo de la misma línea exacta utilizada para inocular el medio. Un movimiento de abanico puede dar lugar a un crecimiento a lo largo de la línea de punción que puede dar lugar a una interpretación falsa-positiva.
Usos
Limitaciones
- Tille, P. M., & Forbes, B. A. (2014). Bailey & Scott’s diagnostic microbiology (Thirteenth edition.). St. Louis, Missouri: Elsevier.
- Cappuccino J.G. y Sherman N. 2008. Microbiology: A Laboratory Manual, 8th ed. Pearson Benjamin Cummings, San Francisco, CA, USA.
- vlab.amrita.edu/?sub=3&brch=73&sim=697&cnt=1
- www.asmscience.org/content/education/protocol/protocol.3658
- https://catalog.hardydiagnostics.com/cp_prod/Content/hugo/MotilityTestMedia.htm