Tipos de AminasEditar
Las aminas pueden ser primarias, secundarias o terciarias, dependiendo del número de grupos que contengan carbono que estén unidos a ellas. Si sólo hay un grupo que contiene carbono (como en la molécula CH3NH2), esa amina se considera primaria. Dos grupos de carbono hacen que una amina sea secundaria, y tres grupos la hacen terciaria. Utilizando el par de electrones solitarios del nitrógeno, a veces se favorece energéticamente el uso del nitrógeno como nucleófilo y así se une un cuarto grupo que contiene carbono a la amina. En este caso, podría llamarse un ion amonio cuaternario.
Amina primaria:
 |
Amina secundaria:
 |
Un compuesto orgánico con múltiples grupos aminos se llama diamina, triamina, tetraamina y así sucesivamente, según el número de grupos aminos (también llamados grupos amino) unidos a la molécula. La fórmula química de la metilendiamina (también llamada diaminometano), por ejemplo, sería la siguiente H2N-CH2-NH2
Aminas aromáticasEditar
Las aminas aromáticas tienen el átomo de nitrógeno directamente conectado a una estructura de anillo aromático. Debido a sus propiedades de retirada de electrones, el anillo aromático disminuye en gran medida la basicidad de la amina – y este efecto puede ser reforzado o contrarrestado dependiendo de qué sustituyentes están en el anillo y en el nitrógeno. La presencia del par de electrones solitarios del nitrógeno tiene el efecto contrario en el propio anillo aromático; debido a que el átomo de nitrógeno puede «prestar» densidad de electrones al anillo, el propio anillo se vuelve mucho más reactivo a otros tipos de química.
Convenciones de denominaciónEditar
Para las aminas primarias, en las que la amina no es el grupo característico principal, se utiliza el prefijo «amino-«. Por ejemplo: Ácido 4-aminobenzoico donde el ácido carboxílico es la característica principal. En caso contrario, se utiliza el sufijo «-amina» con el nombre del híbrido principal o del sustituyente del grupo R. Ejemplo: etanamina o etilamina. Alternativamente, el sufijo «-azano» puede añadirse al nombre del sustituyente del grupo R: Ejemplo: propilazano.
Para las aminas secundarias, terciarias y cuarternarias, la convención de denominación es un poco diferente, pero los sufijos son los mismos. En el caso de las aminas simétricas, se utiliza el prefijo «di» o «tri» dependiendo de si hay 2 o 3 sustituyentes. Por ejemplo, la dipropilamina es una amina secundaria y la trifenilamina es una amina terciaria. En el caso de las aminas asimétricas, la cadena madre recibe el sufijo «-amina». A este nombre se le añade el prefijo «N-» (que indica el enlace de nitrógeno) y el nombre del grupo sustituyente, para cada sustituyente, utilizando el orden alfabético para las aminas terciarias. Por ejemplo, N-etil-N-metil-propilamina, no N-metil-N-etil-propilamina.
Para resumir:
- como prefijo: «amino-«
- como sufijo: «-amina»
- el prefijo «N-» muestra la sustitución en el átomo de nitrógeno (en el caso de las aminas secundarias, terciarias y cuaternarias)
- Aminas primarias: etanamina o etilamina.
- Aminas secundarias: dimetilamina
- Aminas terciarias: trimetilamina
- La disponibilidad del par de electrones solitario del nitrógeno
- Las propiedades electrónicas de los grupos sustituyentes unidos (por ejemplo, los grupos alquilo aumentan la basicidad, los grupos arilo la disminuyen, etc.)
- El grado de solubilidad de la amina protonada, que depende sobre todo del disolvente utilizado en la reacción
- Efecto inductor de los grupos alquilo
- Efecto mesomérico de los sistemas aromáticos
Nombres sistemáticos de algunas aminas comunes:
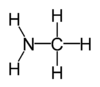
metilamina
Propiedades físicasEditar
Como es fácil adivinar, la inclusión de un heteroátomo como el nitrógeno en moléculas que de otro modo serían exclusivamente de carbono e hidrógeno tiene bastante efecto en las propiedades de las aminas en comparación con los alcanos.
Propiedades generales
El enlace de hidrógeno influye significativamente en las propiedades de las aminas primarias y secundarias, así como en los derivados protonados de todas las aminas. Así, el punto de ebullición de las aminas es más alto que el de las fosfinas correspondientes (compuestos que contienen fósforo), pero generalmente es más bajo que el de los alcoholes correspondientes. Los alcoholes, o alcanos, se parecen a las aminas, pero presentan un grupo -OH en lugar de NR2. Dado que el oxígeno es más electronegativo que el nitrógeno, el RO-H suele ser más ácido que el compuesto relacionado R2N-H.
Las aminas de metilo, dimetilo, trimetilo y etilo son gases en condiciones estándar. La mayoría de las aminas alquílicas comunes son líquidas, y las aminas de alto peso molecular son, naturalmente, sólidas a temperaturas estándar. Además, las aminas gaseosas poseen un olor característico a amoníaco, mientras que las aminas líquidas tienen un olor distintivo a «pescado».
La mayoría de las aminas alifáticas muestran cierta solubilidad en agua, lo que refleja su capacidad para formar enlaces de hidrógeno. La solubilidad disminuye de forma relativamente proporcional al aumento del número de átomos de carbono en la molécula, especialmente cuando el número de átomos de carbono es superior a seis. Las aminas alifáticas también presentan una solubilidad significativa en los disolventes orgánicos, especialmente en los disolventes orgánicos polares. Sin embargo, las aminas primarias reaccionan fácilmente con los compuestos cetónicos (como la acetona), y la mayoría de las aminas son incompatibles con el cloroformo y también con el tetracloruro de carbono como disolventes.
Las aminas aromáticas tienen sus electrones de par solitario conjugados («compartidos») en el anillo de benceno, por lo que su tendencia a participar en el enlace de hidrógeno está algo disminuida. Los puntos de ebullición de estas moléculas suelen ser algo más altos que los de otras aminas más pequeñas debido a su tamaño típicamente mayor.También suelen tener una solubilidad relativamente reducida en agua, aunque conservan su solubilidad en otros disolventes orgánicos.
Las aminas aromáticamente conjugadas suelen ser bastante tóxicas y tienen el potencial de ser fácilmente absorbidas a través de la piel, por lo que siempre deben ser tratadas como «peligrosas».
CiralidadEditar
Las aminas terciarias del tipo NHRR’ y NRR’R» no son quirales: aunque el átomo de nitrógeno lleva cuatro sustituyentes distintos contando el par solitario, el par solitario de electrones puede «voltear» a través del átomo de nitrógeno e invertir las otras moléculas. La barrera energética para tal inversión de Walden del estereocentro con un par solitario de electrones es relativamente baja, por ejemplo, ~7 kcal/mol para una trialquilamina, por lo que es difícil obtener productos quirales fiables utilizando aminas terciarias. Debido a esta baja barrera, las aminas como la NHRR’ no pueden resolverse ópticamente y la NRR’R» sólo puede resolverse cuando los grupos R, R’ y R» están limitados en estructuras cíclicas. Las estructuras de aminas cuaternarias, por ejemplo H3C-N+-RR’R», son quirales y se resuelven fácilmente de forma óptica.
Propiedades como basesEditar
Al igual que el amoníaco, las aminas actúan como bases y son razonablemente fuertes (véase la tabla proporcionada para algunos ejemplos de valores Ka de ácidos conjugados). La basicidad de las aminas varía según la molécula, y depende en gran medida de:
El átomo de nitrógeno de una amina típica presenta un par de electrones solitarios que pueden unirse a un ion hidrógeno (H+) para formar un ion amonio — R3NH+. La solubilidad en agua de las aminas simples se debe en gran medida a la capacidad de enlace de hidrógeno que puede producirse entre los protones de las moléculas de agua y estos pares de electrones solitarios.
| Iones del compuesto | Kb |
|---|---|
| NH3 de amoníaco | 1.8-10-5 M |
| metilamina CH3NH2 | 4.4-10-4 M |
| propilamina CH3CH2CH2NH2 | 4,7-10-4 M |
| 2-propilamina (CH3)2CHNH2 | 5,3-10-4 M |
| dietilamina (CH3)2NH2 |
El efecto I de los grupos alquilo eleva la energía del par solitario de electrones, elevando así la basicidad.
| Iones del compuesto | Kb |
|---|---|
| NH3 de amoníaco | 1.8-10-5 M |
| anilina C6H5NH2 | 3.8-10-10 M | 4-metilfenilamina 4-CH3C6H4NH2 | 1,2-10-9 M |
El efecto M del anillo aromático deslocaliza el electrón del par solitario en el anillo, lo que resulta en una basicidad disminuida.
El grado de protonación de las aminas protonadas:
| Iones del compuesto | Número máximo de H-enlace |
|---|---|
| NH4+ | 4 Muy soluble en H2O |
| RNH3+ | 3 | R2NH2+ | 2 | R3NH+ | 1 Menos Soluble en H2O |
