
El laboratorio de química utiliza estereotipadamente diversas formas de cristalería de laboratorio. Sin embargo, la cristalería no es fundamental para la química, y gran parte de la química experimental (así como la aplicada/industrial) se realiza sin ella.

Una reacción química es una transformación de algunas sustancias en una o más sustancias diferentes. La base de dicha transformación química es la reordenación de electrones en los enlaces químicos entre átomos. Puede representarse simbólicamente mediante una ecuación química, en la que suelen intervenir los átomos como sujetos. El número de átomos a la izquierda y a la derecha en la ecuación de una transformación química es igual. (Cuando el número de átomos a ambos lados es desigual, la transformación se denomina reacción nuclear o desintegración radiactiva). El tipo de reacciones químicas que puede sufrir una sustancia y los cambios de energía que pueden acompañarla están limitados por ciertas reglas básicas, conocidas como leyes químicas.
Las consideraciones de energía y entropía son invariablemente importantes en casi todos los estudios químicos. Las sustancias químicas se clasifican en términos de su estructura, fase, así como de sus composiciones químicas. Pueden analizarse utilizando las herramientas del análisis químico, por ejemplo, la espectroscopia y la cromatografía. Los científicos que se dedican a la investigación química se denominan químicos. La mayoría de los químicos se especializan en una o varias subdisciplinas. Varios conceptos son esenciales para el estudio de la química; algunos de ellos son:
Materia
En química, se define la materia como todo aquello que tiene masa en reposo y volumen (ocupa espacio) y está formado por partículas. Las partículas que componen la materia también tienen masa en reposo; no todas las partículas tienen masa en reposo, como el fotón. La materia puede ser una sustancia química pura o una mezcla de sustancias.
Atomo

El átomo es la unidad básica de la química. Está formado por un núcleo denso llamado núcleo atómico rodeado por un espacio ocupado por una nube de electrones. El núcleo está formado por protones con carga positiva y neutrones sin carga (denominados conjuntamente nucleones), mientras que la nube de electrones está formada por electrones con carga negativa que orbitan alrededor del núcleo. En un átomo neutro, los electrones cargados negativamente compensan la carga positiva de los protones. El núcleo es denso; la masa de un nucleón es aproximadamente 1.836 veces la de un electrón, aunque el radio de un átomo es unas 10.000 veces el de su núcleo.
El átomo es también la entidad más pequeña que puede preverse que conserve las propiedades químicas del elemento, como la electronegatividad, el potencial de ionización, el estado o estados de oxidación preferidos, el número de coordinación y los tipos de enlace preferidos para formar (por ejemplo, metálico, iónico, covalente).
Elemento
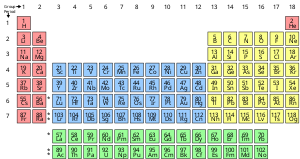
Un elemento químico es una sustancia pura que está compuesta por un único tipo de átomo, caracterizado por su número particular de protones en los núcleos de sus átomos, conocido como número atómico y representado por el símbolo Z. El número másico es la suma del número de protones y neutrones en un núcleo. Aunque todos los núcleos de todos los átomos pertenecientes a un elemento tendrán el mismo número atómico, no necesariamente tendrán el mismo número másico; los átomos de un elemento que tienen números másicos diferentes se conocen como isótopos. Por ejemplo, todos los átomos con 6 protones en su núcleo son átomos del elemento químico carbono, pero los átomos de carbono pueden tener números másicos de 12 o 13.
La presentación estándar de los elementos químicos es la tabla periódica, que ordena los elementos por número atómico. La tabla periódica está organizada en grupos, o columnas, y períodos, o filas. La tabla periódica es útil para identificar las tendencias periódicas.
Compuesto

Un compuesto es una sustancia química pura formada por más de un elemento. Las propiedades de un compuesto se parecen poco a las de sus elementos. La nomenclatura estándar de los compuestos la establece la Unión Internacional de Química Pura y Aplicada (IUPAC). Los compuestos orgánicos se denominan según el sistema de nomenclatura orgánica. Los nombres de los compuestos inorgánicos se crean según el sistema de nomenclatura inorgánica. Cuando un compuesto tiene más de un componente, se dividen en dos clases, los componentes electropositivos y los electronegativos. Además, el Chemical Abstracts Service ha ideado un método para indexar las sustancias químicas. En este esquema cada sustancia química es identificable por un número conocido como su número de registro CAS.
Molécula

Así, las moléculas existen como unidades eléctricamente neutras, a diferencia de los iones. Cuando se rompe esta regla, dando a la «molécula» una carga, el resultado se denomina a veces ion molecular o ion poliatómico. Sin embargo, la naturaleza discreta y separada del concepto molecular suele requerir que los iones moleculares estén presentes sólo en forma bien separada, como un haz dirigido en el vacío en un espectrómetro de masas. Los conjuntos poliatómicos cargados que residen en los sólidos (por ejemplo, los iones comunes de sulfato o nitrato) no suelen considerarse «moléculas» en química. Algunas moléculas contienen uno o más electrones no apareados, creando radicales. La mayoría de los radicales son comparativamente reactivos, pero algunos, como el óxido nítrico (NO) pueden ser estables.

Los elementos «inertes» o gases nobles (helio, neón, argón, kriptón, xenón y radón) se componen de átomos solitarios como su unidad discreta más pequeña, pero los otros elementos químicos aislados consisten en moléculas o redes de átomos unidos entre sí de alguna manera. Las moléculas identificables componen sustancias familiares como el agua, el aire y muchos compuestos orgánicos como el alcohol, el azúcar, la gasolina y los distintos productos farmacéuticos.
Sin embargo, no todas las sustancias o compuestos químicos están formados por moléculas discretas y, de hecho, la mayoría de las sustancias sólidas que componen la corteza, el manto y el núcleo sólidos de la Tierra son compuestos químicos sin moléculas. Estos otros tipos de sustancias, como los compuestos iónicos y los sólidos de red, están organizados de tal manera que carecen de la existencia de moléculas identificables per se. En su lugar, estas sustancias se analizan en términos de unidades de fórmula o células unitarias como la estructura repetitiva más pequeña dentro de la sustancia. Ejemplos de este tipo de sustancias son las sales minerales (como la sal de mesa), los sólidos como el carbono y el diamante, los metales y los conocidos minerales de sílice y silicato como el cuarzo y el granito.
Una de las principales características de una molécula es su geometría, a menudo llamada estructura. Mientras que la estructura de las moléculas diatómicas, triatómicas o tetraatómicas puede ser trivial, (lineal, piramidal angular, etc.) la estructura de las moléculas poliatómicas, que están constituidas por más de seis átomos (de varios elementos) puede ser crucial para su naturaleza química.
Sustancia y mezcla






Ejemplos de sustancias químicas puras. De izquierda a derecha: los elementos estaño (Sn) y azufre (S), el diamante (un alótropo del carbono), la sacarosa (azúcar puro), y el cloruro de sodio (sal) y el bicarbonato de sodio (bicarbonato de sodio), ambos compuestos iónicos.
Una sustancia química es un tipo de materia con una composición y unas propiedades definidas. Un conjunto de sustancias se denomina mezcla. Ejemplos de mezclas son el aire y las aleaciones.
Mol y cantidad de sustancia
El mol es una unidad de medida que denota una cantidad de sustancia (también llamada cantidad química). Un mol se define por contener exactamente 6,02214076×1023 partículas (átomos, moléculas, iones o electrones), donde el número de partículas por mol se conoce como la constante de Avogadro. La concentración molar es la cantidad de una determinada sustancia por volumen de solución, y se suele indicar en mol/dm3.
Fases

Además de las propiedades químicas específicas que distinguen las diferentes clasificaciones químicas, las sustancias químicas pueden existir en varias fases. En su mayor parte, las clasificaciones químicas son independientes de estas clasificaciones de fases a granel; sin embargo, algunas fases más exóticas son incompatibles con ciertas propiedades químicas. Una fase es un conjunto de estados de un sistema químico que tienen propiedades estructurales a granel similares, en un rango de condiciones, como la presión o la temperatura.
Las propiedades físicas, como la densidad y el índice de refracción tienden a caer dentro de los valores característicos de la fase. La fase de la materia se define por la transición de fase, que es cuando la energía que se introduce o se extrae del sistema se destina a reordenar la estructura del sistema, en lugar de cambiar las condiciones de la masa.
A veces la distinción entre fases puede ser continua en lugar de tener un límite discreto’ en este caso se considera que la materia está en un estado supercrítico. Cuando tres estados se reúnen en base a las condiciones, se conoce como punto triple y como éste es invariable, es una forma conveniente de definir un conjunto de condiciones.
Los ejemplos más familiares de fases son los sólidos, los líquidos y los gases. Muchas sustancias presentan múltiples fases sólidas. Por ejemplo, hay tres fases de hierro sólido (alfa, gamma y delta) que varían en función de la temperatura y la presión. Una de las principales diferencias entre las fases sólidas es la estructura cristalina, o la disposición de los átomos. Otra fase comúnmente encontrada en el estudio de la química es la fase acuosa, que es el estado de las sustancias disueltas en una solución acuosa (es decir, en agua).
Las fases menos familiares incluyen los plasmas, los condensados de Bose-Einstein y los condensados fermiónicos y las fases paramagnéticas y ferromagnéticas de los materiales magnéticos. Aunque la mayoría de las fases familiares tratan de sistemas tridimensionales, también es posible definir análogos en sistemas bidimensionales, lo que ha recibido atención por su relevancia para los sistemas en biología.
Enlace

Un enlace químico puede ser un enlace covalente, un enlace iónico, un enlace de hidrógeno o simplemente por la fuerza de Van der Waals. A cada uno de estos tipos de enlace se le atribuye un potencial. Estos potenciales crean las interacciones que mantienen unidos a los átomos en las moléculas o los cristales. En muchos compuestos simples, la teoría del enlace de valencia, el modelo de repulsión de pares de electrones de la envoltura de valencia (VSEPR) y el concepto de número de oxidación pueden utilizarse para explicar la estructura y la composición molecular.
Un enlace iónico se forma cuando un metal pierde uno o más de sus electrones, convirtiéndose en un catión cargado positivamente, y los electrones son entonces ganados por el átomo no metálico, convirtiéndose en un anión cargado negativamente. Los dos iones de carga opuesta se atraen, y el enlace iónico es la fuerza electrostática de atracción entre ellos. Por ejemplo, el sodio (Na), un metal, pierde un electrón para convertirse en un catión Na+ mientras que el cloro (Cl), un no metal, gana este electrón para convertirse en Cl-. Los iones se mantienen unidos debido a la atracción electrostática, y se forma el compuesto cloruro de sodio (NaCl), o sal de mesa común.

En un enlace covalente, dos átomos comparten uno o más pares de electrones de valencia: el grupo eléctricamente neutro resultante de átomos enlazados se denomina molécula. Los átomos compartirán los electrones de valencia de forma que se cree una configuración electrónica de gas noble (ocho electrones en su capa más externa) para cada átomo. Los átomos que tienden a combinarse de tal manera que cada uno tiene ocho electrones en su capa de valencia se dice que siguen la regla del octeto. Sin embargo, algunos elementos como el hidrógeno y el litio sólo necesitan dos electrones en su capa más externa para alcanzar esta configuración estable; se dice que estos átomos siguen la regla del dúo, y de este modo están alcanzando la configuración electrónica del gas noble helio, que tiene dos electrones en su capa externa.
De forma similar, las teorías de la física clásica pueden utilizarse para predecir muchas estructuras iónicas. Con compuestos más complicados, como los complejos metálicos, la teoría del enlace de valencia es menos aplicable y se suelen utilizar enfoques alternativos, como la teoría de los orbitales moleculares. Ver diagrama sobre orbitales electrónicos.
Energía
En el contexto de la química, la energía es un atributo de una sustancia como consecuencia de su estructura atómica, molecular o agregada. Dado que una transformación química va acompañada de un cambio en uno o varios de estos tipos de estructuras, va invariablemente acompañada de un aumento o disminución de la energía de las sustancias implicadas. Parte de la energía se transfiere entre el entorno y los reactantes de la reacción en forma de calor o luz; así, los productos de una reacción pueden tener más o menos energía que los reactantes.
Se dice que una reacción es exergónica si el estado final es más bajo en la escala de energía que el estado inicial; en el caso de las reacciones endergónicas la situación es la inversa. Se dice que una reacción es exotérmica si la reacción libera calor al entorno; en el caso de las reacciones endotérmicas, la reacción absorbe calor del entorno.
Las reacciones químicas no son posibles invariablemente a menos que los reactivos superen una barrera energética conocida como energía de activación. La velocidad de una reacción química (a una temperatura dada T) está relacionada con la energía de activación E, por el factor de población de Boltzmann e – E / k T {\displaystyle e^{-E/kT}}.

– que es la probabilidad de que una molécula tenga una energía mayor o igual a E a la temperatura dada T. Esta dependencia exponencial de una velocidad de reacción con respecto a la temperatura se conoce como ecuación de Arrhenius.La energía de activación necesaria para que se produzca una reacción química puede ser en forma de calor, luz, electricidad o fuerza mecánica en forma de ultrasonidos.
Un concepto relacionado con la energía libre, que también incorpora consideraciones de entropía, es un medio muy útil para predecir la viabilidad de una reacción y determinar el estado de equilibrio de una reacción química, en termodinámica química. Una reacción es factible sólo si el cambio total en la energía libre de Gibbs es negativo, Δ G ≤ 0 {\displaystyle \Delta G\leq 0\ },

; si es igual a cero se dice que la reacción química está en equilibrio.
Sólo existen estados de energía posibles y limitados para los electrones, los átomos y las moléculas. Estos están determinados por las reglas de la mecánica cuántica, que requieren la cuantificación de la energía de un sistema ligado. Se dice que los átomos/moléculas en un estado de energía más alto están excitados. Las moléculas/átomos de la sustancia en un estado de energía excitado suelen ser mucho más reactivas; es decir, más propensas a las reacciones químicas.
La fase de una sustancia está determinada invariablemente por su energía y la energía de su entorno. Cuando las fuerzas intermoleculares de una sustancia son tales que la energía del entorno no es suficiente para superarlas, se encuentra en una fase más ordenada como la líquida o la sólida como es el caso del agua (H2O); un líquido a temperatura ambiente porque sus moléculas están unidas por enlaces de hidrógeno. Mientras que el sulfuro de hidrógeno (H2S) es un gas a temperatura ambiente y presión estándar, ya que sus moléculas están unidas por interacciones dipolo-dipolo más débiles.
La transferencia de energía de una sustancia química a otra depende del tamaño de los cuantos de energía emitidos por una sustancia. Sin embargo, la energía térmica suele transferirse más fácilmente de casi cualquier sustancia a otra porque los fonones responsables de los niveles de energía vibracional y rotacional de una sustancia tienen mucha menos energía que los fotones invocados para la transferencia de energía electrónica. Así, como los niveles de energía vibracional y rotacional están más espaciados que los niveles de energía electrónica, el calor se transfiere más fácilmente entre sustancias en relación con la luz u otras formas de energía electrónica. Por ejemplo, la radiación electromagnética ultravioleta no se transfiere con tanta eficacia de una sustancia a otra como la energía térmica o eléctrica.
La existencia de niveles de energía característicos para diferentes sustancias químicas es útil para su identificación mediante el análisis de líneas espectrales. En la espectroscopia química se suelen utilizar diferentes tipos de espectros, por ejemplo, IR, microondas, RMN, ESR, etc. La espectroscopia también se utiliza para identificar la composición de objetos remotos -como estrellas y galaxias lejanas- mediante el análisis de sus espectros de radiación.

El término energía química se utiliza a menudo para indicar el potencial de una sustancia química para sufrir una transformación mediante una reacción química o para transformar otras sustancias químicas.
Reacción

Las reacciones químicas pueden dar lugar a la formación o disociación de moléculas, es decir, a que las moléculas se rompan para formar dos o más moléculas o a la reordenación de los átomos dentro de las moléculas o entre ellas. Las reacciones químicas suelen implicar la creación o ruptura de enlaces químicos. La oxidación, la reducción, la disociación, la neutralización ácido-base y el reordenamiento molecular son algunos de los tipos de reacciones químicas más comunes.
Una reacción química puede representarse simbólicamente mediante una ecuación química. Mientras que en una reacción química no nuclear el número y el tipo de átomos en ambos lados de la ecuación son iguales, para una reacción nuclear esto es cierto sólo para las partículas nucleares, es decir, protones y neutrones.
La secuencia de pasos en los que la reorganización de los enlaces químicos puede tener lugar en el curso de una reacción química se llama su mecanismo. Se puede prever que una reacción química tiene lugar en una serie de pasos, cada uno de los cuales puede tener una velocidad diferente. Por lo tanto, en el transcurso de una reacción se pueden prever muchos intermedios de reacción con una estabilidad variable. Se proponen mecanismos de reacción para explicar la cinética y la mezcla relativa de productos de una reacción. Muchos fisicoquímicos se especializan en explorar y proponer los mecanismos de diversas reacciones químicas. Varias reglas empíricas, como las reglas de Woodward-Hoffmann, suelen ser útiles a la hora de proponer un mecanismo para una reacción química.
Según el libro de oro de la IUPAC, una reacción química es «un proceso que da lugar a la interconversión de especies químicas.» En consecuencia, una reacción química puede ser una reacción elemental o una reacción escalonada. Se hace una advertencia adicional, en el sentido de que esta definición incluye los casos en los que la interconversión de conformadores es observable experimentalmente. Tales reacciones químicas detectables normalmente implican conjuntos de entidades moleculares como se indica en esta definición, pero a menudo es conceptualmente conveniente utilizar el término también para los cambios que implican entidades moleculares individuales (es decir, «eventos químicos microscópicos»).
Iones y sales

Un ion es una especie cargada, un átomo o una molécula, que ha perdido o ganado uno o más electrones. Cuando un átomo pierde un electrón y, por tanto, tiene más protones que electrones, el átomo es un ion o catión con carga positiva. Cuando un átomo gana un electrón y, por tanto, tiene más electrones que protones, el átomo es un ion o anión con carga negativa. Los cationes y aniones pueden formar una red cristalina de sales neutras, como los iones Na+ y Cl- que forman el cloruro de sodio, o NaCl. Ejemplos de iones poliatómicos que no se dividen durante las reacciones ácido-base son el hidróxido (OH-) y el fosfato (PO43-).
El plasma está compuesto por materia gaseosa que ha sido completamente ionizada, generalmente a través de altas temperaturas.
Acidez y basicidad

Una sustancia puede clasificarse a menudo como un ácido o una base. Hay varias teorías diferentes que explican el comportamiento ácido-base. La más sencilla es la teoría de Arrhenius, que establece que un ácido es una sustancia que produce iones de hidronio cuando se disuelve en agua, y una base es aquella que produce iones de hidróxido cuando se disuelve en agua. Según la teoría ácido-base de Brønsted-Lowry, los ácidos son sustancias que donan un ion hidrógeno positivo a otra sustancia en una reacción química; por extensión, una base es la sustancia que recibe ese ion hidrógeno.
Una tercera teoría común es la teoría ácido-base de Lewis, que se basa en la formación de nuevos enlaces químicos. La teoría de Lewis explica que un ácido es una sustancia que es capaz de aceptar un par de electrones de otra sustancia durante el proceso de formación de enlaces, mientras que una base es una sustancia que puede proporcionar un par de electrones para formar un nuevo enlace. Según esta teoría, lo fundamental que se intercambia son las cargas. Existen otras formas de clasificar una sustancia como ácido o base, como se desprende de la historia de este concepto.
La fuerza de los ácidos se suele medir por dos métodos. Una medida, basada en la definición de Arrhenius de la acidez, es el pH, que es una medida de la concentración de iones de hidronio en una solución, expresada en una escala logarítmica negativa. Así, las soluciones que tienen un pH bajo tienen una alta concentración de iones de hidronio y se puede decir que son más ácidas. La otra medida, basada en la definición de Brønsted-Lowry, es la constante de disociación del ácido (Ka), que mide la capacidad relativa de una sustancia para actuar como ácido según la definición de Brønsted-Lowry de un ácido. Es decir, las sustancias con una Ka más alta son más propensas a donar iones de hidrógeno en las reacciones químicas que las que tienen valores Ka más bajos.
Redox
Las reacciones Redox (reducción-oxidación) incluyen todas las reacciones químicas en las que los átomos tienen su estado de oxidación cambiado ya sea ganando electrones (reducción) o perdiendo electrones (oxidación). Las sustancias que tienen la capacidad de oxidar otras sustancias se denominan oxidativas y se conocen como agentes oxidantes, oxidantes u oxidantes. Un oxidante quita electrones a otra sustancia. Del mismo modo, las sustancias que tienen la capacidad de reducir otras sustancias se dice que son reductoras y se conocen como agentes reductores, reductores o reductores.
Un reductor transfiere electrones a otra sustancia y, por tanto, se oxida él mismo. Y como «dona» electrones también se le llama donante de electrones. La oxidación y la reducción se refieren propiamente a un cambio en el número de oxidación; la transferencia real de electrones puede no producirse nunca. Así, la oxidación se define mejor como un aumento del número de oxidación, y la reducción como una disminución del número de oxidación.
Equilibrio
Aunque el concepto de equilibrio se utiliza ampliamente en todas las ciencias, en el contexto de la química, surge siempre que son posibles varios estados diferentes de la composición química, como por ejemplo, en una mezcla de varios compuestos químicos que pueden reaccionar entre sí, o cuando una sustancia puede estar presente en más de un tipo de fase.
Un sistema de sustancias químicas en equilibrio, aunque tenga una composición invariable, no suele ser estático; las moléculas de las sustancias siguen reaccionando entre sí dando lugar a un equilibrio dinámico. Así, el concepto describe el estado en el que los parámetros, como la composición química, permanecen inalterados a lo largo del tiempo.
Leyes químicas
Las reacciones químicas se rigen por ciertas leyes, que se han convertido en conceptos fundamentales en química. Algunos de ellos son:
- Ley de Avogadro
- Ley de Beer-Lambert
- Ley de Boyle (1662, que relaciona presión y volumen)
- Ley de Charles (1787, que relaciona volumen y temperatura)
- Ley de Fick de la difusión
- Ley de Gay-Lussac (1809, que relaciona presión y temperatura)
- Principio de Le Chatelier
- Ley de Henry
- Ley de Hess
- La ley de conservación de la energía conduce a los importantes conceptos de equilibrio, termodinámica y cinética.
- La ley de conservación de la masa sigue conservándose en sistemas aislados, incluso en la física moderna. Sin embargo, la relatividad especial muestra que, debido a la equivalencia masa-energía, siempre que se elimine «energía» no material (calor, luz, energía cinética) de un sistema no aislado, se perderá algo de masa con ella. Las pérdidas de energía elevadas dan lugar a la pérdida de cantidades pesadas de masa, un tema importante en la química nuclear.
- Ley de la composición definida, aunque en muchos sistemas (en particular las biomacromoléculas y los minerales) las proporciones tienden a requerir números grandes, y se representan frecuentemente como una fracción.
- Ley de las proporciones múltiples
- Ley de Raoult