Vous êtes-vous déjà demandé » quelle est la différence entre le pH et l’alcalinité ? « . Nous sommes nombreux dans le milieu aquatique à confondre l’alcalinité totale et le pH. C’est compréhensible, étant donné à quel point la frontière est floue entre des mots comme « alcalin » et « alcalinité ». En effet, l’alcalinité et le pH en chimie de l’eau sont étroitement liés, mais ce ne sont pas les mêmes. Cet article les distinguera.
Écoutez ce sujet sur notre Podcast:
Qu’est-ce que le pH?
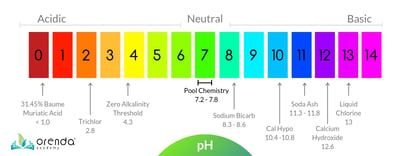 L’échelle de pH
L’échelle de pHp>pH est l’abréviation d’Hydrogène potenz, plus communément appelé » puissance de l’hydrogène « . Il s’agit du logarithme négatif de la concentration en ions Hydrogène dans une solution. Plus le pH est faible, plus il y a exponentiellement d’hydrogène.
pH = -log(H+)
On mesure le degré d’acidité ou de basicité (aussi appelé alcalinité) des substances à l’aide de l’échelle du pH. L’échelle de pH va de 0 à 14, et est relative à l’eau pure, qui a un pH parfaitement neutre de 7. Lorsque la concentration d’ions hydrogène augmente, le pH diminue (et vice versa). L’échelle est logarithmique, ce qui signifie que chaque nombre entier sur l’échelle de pH 1-14 est 10 fois plus ou moins élevé que les nombres qui l’entourent. Par exemple, un produit dont le pH est de 6,0 est 10 fois plus acide que l’eau distillée dont le pH est de 7,0. Quelque chose avec un pH de 5,0 est 10x plus acide que 6,0, et 100x plus acide que 7,0 (10×10=100).
Pour mettre l’échelle de pH en perspective, faisons quelques calculs rapides. Le trichlor, un type populaire de chlore stabilisé utilisé principalement dans les piscines extérieures, a un pH d’environ 3. Pour ce calcul, arrondissons-le à exactement 3,0. Quel est le degré d’acidité du Trichlor à 3.0pH par rapport à une eau à 7.0pH ? Essayons de le savoir.
(7,0pH – 3,0pH) = 4,0
L’échelle logarithmique signifie 104, soit 10x10x10x10 = 10 000
Le trichlore est environ 10 000 fois plus acide que l’eau pure.
Ne vous inquiétez pas pour les mathématiques, c’est juste pour expliquer l’échelle de pH elle-même. Du point de vue de la chimie de l’eau, les manuels nous disent que le pH idéal pour une piscine ou un spa se situe entre 7,4 et 7,6. Mais de manière réaliste, le pH augmente au fil du temps dans la plupart des piscines, de sorte que la plage normale d’une piscine se situe plutôt entre 7,4 et 8,2.
Les rôles du pH dans la chimie de l’eau
La force du chlore (%HOCl)
La gestion du pH est un élément essentiel pour maintenir une chimie de l’eau saine et équilibrée. Elle est si importante parce que le pH est un facteur déterminant de l’indice de saturation de Langelier (LSI), et aussi parce que le pH détermine l’efficacité du chlore dans les piscines non stabilisées. Ainsi, dans les piscines dépourvues d’acide cyanurique (CYA), plus le pH est faible, plus le chlore sera fort, car le pH contrôle les équilibres de dissociation entre le chlore fort et le chlore faible :
HOCl ⇌ H+ + OCl-
L’acide hypochloreux se dissocie en hydrogène et en ion hypochlorite
A nouveau, le pH contrôle la force du chlore (%HOCl) car plus le pH est faible, plus la concentration en hydrogène est élevée. Cela signifie un % plus élevé de HOCl fort par rapport à l’OCl- faible. Cela n’est pas aussi pertinent dans les piscines avec CYA, car les isocyanurates changent fondamentalement la chimie de la piscine.
 Solubilité du carbonate de calcium
Solubilité du carbonate de calcium
Alors que le LSI détermine quand l’eau est sursaturée en carbonate de calcium (CaCO3), le pH est un facteur majeur sur le LSI. Et comme les violations du LSI se produisent localement, et non universellement dans toute une piscine, le pH a beaucoup d’importance. Par exemple, le tableau ci-dessous montre les équilibres des types d’alcalinité. Lorsque le pH atteint 8,2 ou 8,3, il devient très difficile pour le calcium de rester en solution, car l’alcalinité carbonatée (CO3- -) se lie très bien au calcium (Ca++). Ainsi, lorsque votre pH devient trop élevé, le calcium a tendance à précipiter hors de la solution, même si le LSI global de votre piscine est équilibré. Nous voyons ce phénomène troubler les piscines, comme lorsque quelqu’un ajoute de la soude trop rapidement.
Le CO2 détermine le pH
La quantité de dioxyde de carbone (CO2) dans votre eau détermine en grande partie le pH. Plus il y a de CO2, plus le pH est faible, et vice versa. Cela explique pourquoi les jeux d’eau, les bords de fuite et les jets de spa augmentent le pH plus rapidement qu’en eau calme ; l’aération accélère la perte de CO2 dans l’atmosphère.
Conséquences du pH
Un pH faible abaisse le LSI et peut provoquer des dommages aux surfaces et aux équipements, la corrosion des composants métalliques dans et autour de la piscine, des irritations de la peau et des yeux, ainsi qu’un inconfort général du patron. D’autre part, un pH élevé augmente l’indice LSI et entraîne la formation de tartre carbonaté, une eau trouble et un chlore plus faible (dans les piscines non stabilisées). Les manuels disent qu’il faut rester dans la fourchette 7,4-7,6 pour éviter ces problèmes, mais une stratégie basée sur le LSI permettra d’éviter ces problèmes mieux que de rester simplement dans cette fourchette.
Qu’est-ce que l’alcalinité totale ?
L’alcalinité totale est une mesure de la concentration de toutes les substances alcalines dissoutes dans l’eau qui peuvent à la fois attirer et libérer des ions Hydrogène. Cette interférence avec l’hydrogène est la raison pour laquelle l’alcalinité sert de tampon contre les changements de pH. L’alcalinité totale est principalement constituée de bicarbonate, de carbonate et d’hydroxyde, ainsi que de quelques autres substances comme l’alcalinité cyanurique. Lorsqu’un acide est ajouté, ces alcalins ont la capacité de neutraliser une partie de l’acide. En termes plus simples, l’alcalinité totale est une mesure de la capacité de l’eau à résister aux changements de pH. En particulier, l’alcalinité ralentit la réduction du pH. Une alcalinité trop élevée est en fait une source d’augmentation du pH. Plus l’alcalinité est importante, plus il faut d’acide pour réduire le pH.
Relié : Qu’est-ce que l’alcalinité ?
 L’alcalinité totale est mesurée par sa concentration en parties par million (ppm), et la fourchette idéale se situe entre 80 et 120 ppm, selon le type de chlore que vous utilisez. Par exemple, le Trichlor a un faible pH de 2,8, donc étant donné l’acidité du Trichlor, une piscine au Trichlor a besoin d’une alcalinité plus élevée. Une autre raison pour laquelle il faut plus d’alcalinité dans une piscine trichlor est que le CYA du trichlor compense l’alcalinité lors des corrections LSI.
L’alcalinité totale est mesurée par sa concentration en parties par million (ppm), et la fourchette idéale se situe entre 80 et 120 ppm, selon le type de chlore que vous utilisez. Par exemple, le Trichlor a un faible pH de 2,8, donc étant donné l’acidité du Trichlor, une piscine au Trichlor a besoin d’une alcalinité plus élevée. Une autre raison pour laquelle il faut plus d’alcalinité dans une piscine trichlor est que le CYA du trichlor compense l’alcalinité lors des corrections LSI.
Les chlore non stabilisés, comme le chlore liquide (eau de Javel) ou le cal hypo, ont chacun un pH élevé. Vous pouvez donc avoir une alcalinité plus faible, comme 80-100 ppm, ou même inférieure à 80 ppm si votre LSI le permet. Les piscines au sel et au chlore sont souvent confrontées à des dépôts de calcaire qui se détachent de la cellule de sel et sont projetés dans la piscine. Les piscines au sel, en saison, peuvent généralement bénéficier de niveaux d’alcalinité plus faibles, comme 60-70 ppm, à condition que le LSI reste équilibré. La clé est de mesurer l’acide et de le diluer avant de le verser pour éviter les surcorrections. Trop d’acide avec une alcalinité plus faible causera de plus gros problèmes, alors faites attention.
Avez-vous remarqué que l’alcalinité totale n’est pas mesurée sur l’échelle du pH ?
C’est une distinction importante à faire, car c’est généralement ainsi que l’on confond pH et alcalinité. L’alcalinité totale est mesurée par la quantité, ou la concentration (ppm) dans l’eau, et non par le degré d’alcalinité (pH) de l’eau. Les produits » d’augmentation de l’alcalinité » sont très répandus dans l’industrie de la piscine. Si vous êtes à la recherche d’un produit augmentant l’alcalinité, les deux plus courants sont le bicarbonate de sodium (NaHCO3) et le carbonate de sodium (Na2CO3), plus connu sous le nom de carbonate de soude. Les produits » abaissant l’alcalinité » seront un acide comme l’acide muriatique ou le bisulfate de sodium.
Le rôle de l’alcalinité totale dans la chimie de l’eau
Si vous êtes un opérateur de piscine, vous savez probablement déjà que le pH peut fluctuer de haut en bas. Et lorsqu’il le fait, la piscine se bat constamment contre vous. Avoir le bon niveau d’alcalinité totale est une bonne chose, car cela aide à maintenir le pH stabilisé. Une façon simple de penser à l’alcalinité est qu’elle isole le pH de changer trop facilement, surtout en descendant.
Techniquement, l’alcalinité tamponne le pH en libérant ou en absorbant un ion hydrogène (H+) selon les besoins. Ainsi, lorsqu’on ajoute de l’acide, les ions carbonate peuvent absorber de l’Hydrogène pour créer des ions bicarbonate. Il s’agit d’un équilibre, tout comme le pH, et cela peut donc aussi aller dans l’autre sens. L’équilibre ressemble à ceci :
HCO3- + H+ ↔ H2CO3
Puisque le CO2 contrôle le pH de l’eau, vous pouvez soit ajouter directement du CO2 pour abaisser le pH, soit utiliser un acide pour convertir l’alcalinité du bicarbonate en acide carbonique (H2CO3), qui n’est autre que du CO2 dissous : (H2O + CO2 → H2CO3).

Vous pourriez ajouter plusieurs livres de bicarbonate de sodium à 8,3pH et obtenir le même impact sur le pH si vous ajoutiez une quantité beaucoup plus faible de carbonate de soude à 11,6 pH. Mais l’alcalinité totale serait plus élevée pour le bicarbonate de sodium, car il y en a tout simplement plus dans l’eau.
Comment augmenter l’alcalinité totale et le pH
Si vous voulez augmenter l’alcalinité totale dans une piscine, vous devez connaître le gallonage de la piscine, et votre pH. Il est utile d’avoir un calculateur de dosage précis. Augmenter l’alcalinité est aussi simple que d’ajouter du bicarbonate de sodium à l’eau.
Relié : Comment augmenter l’alcalinité et le pH
Comment diminuer l’alcalinité totale et le pH
Vous pouvez diminuer l’alcalinité en utilisant de l’acide. Certains experts recommandent un » versement en colonne d’acide » pour abaisser l’alcalinité, mais nous ne le faisons pas. D’après notre expérience – et les expériences scientifiques le confirment – le versement en colonne est plus nocif que la dilution. Nous recommandons de diluer l’acide dans un seau d’eau et de le verser uniformément dans la piscine. En outre, le déversement en colonne peut abaisser fortement le pH dans un endroit concentré (au fond de votre piscine !), ce qui peut déséquilibrer le LSI et, à son tour, attaquer la surface. L’injection de dioxyde de carbone permet d’abaisser le pH sans affecter l’alcalinité totale. Mais c’est un sujet pour une autre fois.
Relié : Comment abaisser le pH et l’alcalinité
Conclusion
Maintenez votre piscine dans l’équilibre du LSI, avant tout. Ensuite, essayez de maintenir votre alcalinité dans une plage qui est la plus avantageuse pour votre type de chlore primaire. Utilisez un augmentateur d’alcalinité comme le bicarbonate de sodium pour augmenter l’alcalinité totale, ou un acide pour la diminuer. Lorsque vous utilisez des chlore à pH élevé comme les générateurs de chlore salé, le chlore liquide ou le cal hypo, vous aurez besoin de moins d’alcalinité, comme 60-80 ppm. Pour les chlore à faible pH comme le Trichlor, 100-120 ppm est une meilleure fourchette pour vous. Consultez votre kit de test ou le calculateur de dosage sur l’App Orenda pour des chiffres précis.
En passant, ne mélangez jamais différents types de chlore. Ils peuvent exploser. Littéralement.
Les gens confondent pH et alcalinité et nous pouvons comprendre pourquoi. Il suffit de se rappeler que le pH est un équilibre qui nous indique à quel point une solution est acide ou basique. L’alcalinité totale mesure la quantité ou la concentration (en parties par million) d’alcali dissous qui peut tamponner le changement de pH en libérant ou en attirant l’hydrogène. Nous espérons que cela vous aidera!