L’apathie est définie comme une diminution de la motivation qui n’est pas attribuable à une diminution du niveau de conscience, à une déficience cognitive ou à une détresse émotionnelle.1 La dépression implique une détresse émotionnelle considérable, mise en évidence par des larmes, de la tristesse, de l’anxiété, de l’agitation, de l’insomnie, de l’anorexie, des sentiments d’inutilité et de désespoir, et des pensées récurrentes de mort2. La nomenclature diagnostique et les mesures traditionnelles de la dépression, y compris le DSM-IV2 et l’échelle d’évaluation de la dépression de Hamilton (Ham-D)3, traitent l’apathie comme un aspect de la dépression, mais il peut s’agir d’un concept clinique discernable qui nécessite une approche différente du traitement chez certains patients.4-7
Marin et al.7 ont évalué des patients atteints de la maladie d’Alzheimer (MA), d’un accident vasculaire cérébral (AVC) et d’une dépression majeure en utilisant l’échelle d’évaluation de l’apathie8 et l’échelle Ham-D. Ils ont constaté que la relation entre l’apathie et la dépression majeure était très étroite. Ils ont constaté que la relation entre l’apathie et la dépression variait selon les groupes de diagnostic. L’apathie et la dépression étaient significativement corrélées au sein des groupes, bien que les niveaux absolus d’apathie et de dépression variaient considérablement. Les patients atteints de la maladie d’Alzheimer présentaient fréquemment des scores d’apathie élevés et de dépression faibles, tandis que les patients victimes d’un accident vasculaire cérébral de l’hémisphère gauche ou d’une dépression majeure présentaient fréquemment une dépression élevée et des scores d’apathie faibles. Les patients atteints d’un accident vasculaire cérébral de l’hémisphère droit constituaient le seul groupe présentant des niveaux égaux des deux symptômes, et c’était le seul groupe dans lequel l’apathie et la dépression n’étaient pas corrélées. Les auteurs ont suggéré que l’apathie et la dépression sont des syndromes neuropsychiatriques cliniquement distincts.
Les troubles neurodégénératifs facilitent l’étude de l’apathie et de la dépression car ils produisent une pathologie cérébrale démontrable et sont fréquemment associés à des symptômes neuropsychiatriques.5,9-13 L’inventaire neuropsychiatrique (NPI)14 a été conçu pour évaluer les symptômes neuropsychiatriques dans les maladies démentes et comprend des sous-échelles distinctes pour l’apathie et la dépression. Dans deux études antérieures, nous avons constaté que les patients atteints de démence fronto-temporale (DFT) et de paralysie supranucléaire progressive (PSP) pouvaient être distingués des patients atteints de MA par leur apathie plus sévère et leur dépression relativement moindre.9,11 Nous avons émis l’hypothèse que l’apathie ou le manque d’émotion pouvait être différent de la dépression et spéculé que les deux symptômes pouvaient être produits par des substrats neuroanatomiques ou neurochimiques différents et se manifesteraient de manière différentielle dans une variété de troubles neurologiques.
MÉTHODES
Sujets
Un total de 154 patients ont été vus dans quatre centres universitaires. La participation à l’étude nécessitait le consentement éclairé du patient et de l’aidant.
Trente patients atteints de MA et 28 patients atteints de DFT se sont présentés dans une clinique de démence de l’Université de Californie à Los Angeles, de l’Université de Californie à Los Angeles-Harbor Medical Center ou du West Los Angeles Veterans Affairs Medical Center. Les 30 patients atteints de MA et 22 des patients atteints de DFT ont été décrits précédemment.9 La MA probable a été diagnostiquée sur la base des critères établis par le National Institute of Neurological and Communicative Disorders and Stroke et l’Alzheimer’s Disease and Related Disorders Association (NINCDS-ADRDA).15 La démence frontotemporale a été diagnostiquée sur la base des critères élaborés par les groupes de Lund et Manchester16.
Quarante patients atteints de la maladie de Parkinson (MP) ont été adressés à une clinique des troubles du mouvement de l’Université de Californie à Los Angeles pour une chirurgie par pallidotomie en raison du syndrome on-off, de tremblements irréductibles ou d’une bradykinésie aux doses maximales de médicaments anti-PD. Les patients ont été sélectionnés par deux neurologues et un neurochirurgien. Les critères d’inclusion comprenaient des antécédents indiquant une MP idiopathique, y compris deux des quatre signes cardinaux (tremblement de repos, rigidité, akinésie/bradykinésie et trouble de la marche/ instabilité posturale) et des antécédents clairs de réactivité à la lévodopa.
Vingt-deux patients atteints de PSP ont été vus dans une clinique externe du National Institute of Neurological Disorders and Stroke (NINDS) et ont été décrits précédemment.11 Tous les patients atteints de PSP répondaient aux critères de Blin pour une PSP probable.17,18
Trente-quatre patients atteints de la maladie de Huntington (MH) se sont présentés dans une clinique spécialisée de l’Université de Californie, San Diego, et tous présentaient le trouble du mouvement choréiforme typique, ainsi qu’au moins un parent au premier degré également atteint de MH.
Les patients ont été soumis à un dépistage de maladie mentale chronique, de traumatisme crânien, de maladie cérébrovasculaire, de troubles extrapyramidaux autres que ceux décrits, de carence en vitamines, d’hypothyroïdie, de syphilis et d’autres conditions médicales. Les patients atteints de MH, de PSP et de MP ne présentaient pas tous des troubles de la mémoire suffisants pour répondre aux critères de démence du DSM-IV ; cependant, ils étaient tous atteints de maladies cérébrales dégénératives telles que définies par leurs diagnostics cliniques. Notre objectif principal n’était pas le niveau de démence, mais la relation entre l’apathie et la dépression. Des analyses secondaires ont examiné la relation entre ces symptômes et les troubles cognitifs.
Évaluation
Les données comportementales ont été recueillies lors des entretiens avec les soignants à l’aide du NPI. Cet instrument évalue 10 comportements présents dans les maladies démentielles, notamment les délires, les hallucinations, l’agitation, la dépression, l’anxiété, l’euphorie, l’apathie, la désinhibition, l’irritabilité et les comportements moteurs aberrants (y compris les arpentages, les fouilles et les compulsions). Une note de fréquence (1-4) multipliée par une note de sévérité (1-3) produit un score de sous-échelle pour chaque comportement, et la somme des scores de sous-échelle produit le score total du NPI. Une autre approche d’analyse a également été utilisée dans laquelle nous avons attribué 0 à l’absence moyenne et 1 ou plus à la présence moyenne du symptôme. Il a été démontré que le NPI est valide lorsqu’il est comparé à une variété d’autres approches diagnostiques et qu’il a une fiabilité inter-juges et test-retest élevée.14 Une bande vidéo de formation et des questions scénarisées ont été utilisées pour assurer la fiabilité intersites.
La sous-échelle d’apathie comprend des items tels que montrer une perte d’intérêt, manquer de motivation, être moins spontané, moins affectueux, moins enthousiaste, manquer d’émotions et ne pas se soucier de faire de nouvelles choses. La sous-échelle de dépression comprend des items tels que être triste, déprimé, larmoyant, avoir le moral bas, avoir l’impression d’échouer, être sans espoir pour l’avenir, se sentir comme un fardeau et souhaiter la mort. La sous-échelle de dépression ne comporte aucun item lié à l’apathie et il a été démontré qu’elle présente une forte corrélation avec l’échelle de dépression de Hamilton.14 La sous-échelle d’apathie ne comporte aucun item lié à la tristesse.
La fonction cognitive a été évaluée à l’aide du Mini-Mental State Examination (MMSE).19 Un score parfait au MMSE est de 30, et des scores décroissants indiquent une déficience cognitive plus sévère. Le NPI et le MMSE ont généralement été administrés le même jour.
Analyse des données
Les deux questions centrales de l’étude étaient 1) comment ces deux symptômes étaient liés l’un à l’autre et 2) si leur relation était cohérente ou non à travers les différents syndromes de démence. Des corrélations de Spearman ont été déterminées pour les 10 scores des sous-échelles du NPI et le score total du MMSE. Une matrice distincte a été générée pour chacun des cinq groupes de démence et pour le groupe total combiné. Une analyse de variance (ANOVA) à sens unique de Kruskal-Wallis sur les scores moyens des sous-échelles a été utilisée pour déterminer les différences entre les groupes en ce qui concerne la gravité de la dépression et de l’apathie. Les analyses sont exploratoires, et un niveau de signification de 0,5 a été accepté comme significatif.
RESULTATS
Les caractéristiques cliniques des 154 patients sont présentées dans le tableau 1. Il y avait un nombre presque égal d’hommes et de femmes dans les groupes FTD et HD, mais il y avait plus de femmes dans le groupe AD et plus d’hommes dans les groupes PD et PSP. Le groupe MA était en moyenne plus âgé d’environ 10 ans que les groupes DFT, MP et PSP et de 30 ans que le groupe HD. Les scores MMSE étaient similaires dans la MA et la DFT, et ces deux groupes avaient des scores MMSE inférieurs de 10 points à ceux des groupes PD, HD et PSP.
La sévérité de l’apathie et de la dépression différait significativement entre les groupes (tableau 1). Une ANOVA à sens unique de Kruskal-Wallis a été utilisée pour comparer les scores moyens de la sous-échelle NPI entre les groupes. Des différences significatives ont été constatées dans les quatre groupes, les patients PD et HD présentant l’apathie la moins sévère et la dépression la plus sévère (figure 1).
La fréquence de l’apathie et de la dépression et la relation entre les deux symptômes variaient selon les groupes de diagnostic. Un grand nombre de patients atteints de MA et encore plus de patients atteints de DFT et de PSP présentaient une apathie sans dépression, tandis que de nombreux patients atteints de MP et de HD présentaient une dépression sans apathie. Tous les groupes de diagnostic comptaient plus de patients présentant l’un ou l’autre symptôme que les deux. La disparité entre l’apathie et la dépression était particulièrement spectaculaire chez les patients atteints de la MP et de la PSP. Peu de patients atteints de la maladie de Parkinson souffraient d’apathie seule (n=2 ; 5%) par rapport au nombre de patients souffrant de dépression seule (11 ; 28%) ou de dépression plus apathie (11 ; 28%), et peu de patients atteints de la maladie de Parkinson souffraient de dépression, mais présentaient une fréquence élevée d’apathie. Sur 22 patients atteints de PSP, 17 (77 %) présentaient une apathie seule11, 1 une dépression et 3 une dépression plus une apathie (tableau 1).
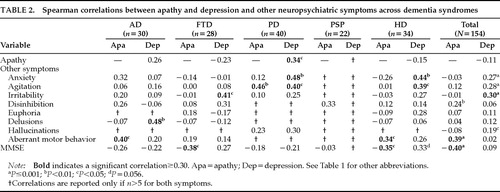
L’apathie n’était pas corrélée à la dépression dans l’échantillon combiné de patients atteints de démence (r=-0,11, P=0,18). Il y avait une corrélation négative non significative dans les groupes FTD (r=-0,23, P=0,23) et HD (r=-0,15, P=0,40), et une corrélation positive non significative dans le groupe AD (r=0,26, P=0,16). Le groupe PD était le seul groupe de démence à présenter une corrélation significative entre les deux symptômes (r=0,34, P=0,03 ; tableau 2). Ainsi, le schéma de corrélation entre l’apathie et la dépression différait selon les groupes de diagnostic, et la présence de l’un ne prédisait pas la présence de l’autre.
Le NPI mesure huit symptômes neuropsychiatriques en plus de l’apathie et de la dépression. Certains de ces symptômes étaient corrélés à l’apathie et d’autres, différents, à la dépression. Dans l’échantillon total, l’apathie était corrélée à la désinhibition et au comportement moteur aberrant, et la dépression à l’anxiété, l’agitation, l’irritabilité et les hallucinations (tableau 2).
L’apathie était corrélée à une fonction cognitive plus faible mesurée par le MMSE dans l’échantillon total (r= -0,40, P<0.0001), dans le groupe FTD (r= -0,38, P<0,05), et dans le groupe HD (r= -0,35, P<0,05). Les groupes AD et PD avaient une tendance à la baisse de la fonction cognitive avec une augmentation de l’apathie, et le groupe PSP n’avait aucune corrélation entre l’apathie et la fonction cognitive. L’apathie n’était pas corrélée avec l’avancée en âge.
La dépression n’avait pas de corrélation significative avec les scores MMSE dans l’échantillon combiné. Dans la MA et la MP, il y avait des tendances non significatives vers une relation entre la dépression et une fonction cognitive plus faible. Les patients atteints de DFT et de MH ont montré des tendances non significatives vers des relations entre la sévérité de la dépression et une meilleure fonction cognitive, et il y avait trop peu de patients atteints de PSP avec dépression pour soutenir une analyse significative.
DISCUSSION
L’apathie est très répandue dans les maladies neurodégénératives,5,9-13 et cette étude soutient et étend les résultats des quelques études précédentes abordant la question de l’apathie et de la dépression comme des phénomènes cliniques indépendants.5,7,11,20 Contrairement au Ham-D utilisé dans de nombreuses études antérieures, la sous-échelle de dépression du NPI ne comporte pas d’items liés à l’apathie, et la sous-échelle d’apathie ne comporte pas de questions liées à la dépression. Nous n’avons trouvé aucune corrélation entre l’apathie et la dépression chez 154 patients atteints de cinq troubles neurodégénératifs. En outre, les deux symptômes étaient associés à d’autres symptômes neuropsychiatriques de manière dissemblable. L’apathie était associée à la désinhibition et à un comportement moteur aberrant ; la dépression était associée à l’anxiété, à l’agitation, à l’irritabilité et aux hallucinations. L’apathie et la désinhibition peuvent sembler être des comportements mutuellement exclusifs, mais tous deux sont médiés par les systèmes du lobe frontal et sont fréquemment observés ensemble, en particulier chez les patients atteints de DFT. En outre, les comportements problématiques qui entraînent des difficultés de gestion ou une réduction de la capacité fonctionnelle peuvent être principalement liés à un dysfonctionnement du lobe frontal, et des études antérieures ont montré que l’apathie est associée à ces symptômes.21,22
Dans cette étude et dans des études antérieures, l’apathie était significativement corrélée à une augmentation de la déficience cognitive (mesurée par le MMSE) dans la MA et la MP,5,13,20,23 mais pas dans la PSP11 ou la HD.22 La relation entre la dépression et la fonction cognitive dans la démence est controversée. Certaines études ont trouvé une association entre la dépression et une déficience cognitive plus sévère,24 mais d’autres non.25 Nous n’avons trouvé aucune relation cohérente entre la dépression et la cognition dans l’échantillon total ou dans les maladies individuelles. Cependant, le MMSE ne teste pas de manière adéquate la fonction du lobe frontal, qui est fréquemment altérée dans de nombreux troubles de la démence, et ne fournit pas une mesure valide de cette partie du déclin cognitif.
La relation entre l’apathie et la dépression semble être spécifique à la maladie. La MA, la DFT et la PSP présentaient une apathie plus fréquente et plus grave, tandis que la MP et la HD présentaient une dépression plus fréquente et plus grave. Les patients atteints de PSP présentaient l’apathie la plus fréquente et la plus sévère et la dépression la plus faible. Une étude antérieure ayant utilisé différentes mesures de l’apathie et de la gravité de la maladie a révélé que les patients atteints de MH étaient plus sévèrement apathiques que les patients atteints de MA.22
La localisation anatomique du dysfonctionnement régional associé à l’apathie et à la dépression semble se chevaucher considérablement. La dépression serait plus fréquente lorsque les lésions focales sont antérieures et du côté gauche.26 Cette constatation est similaire, mais pas identique, aux résultats d’études métaboliques menées chez des patients plus jeunes, qui montrent que la dépression majeure est associée à un hypométabolisme frontal, et en particulier frontal gauche.27 La maladie de Parkinson accompagnée de dépression est associée à une réduction du métabolisme du glucose dans le cortex frontal inférieur28 et préfrontal médian.29 Les zones paralimbiques telles que le cortex préfrontal orbital-inférieur et le cortex temporal ont également été impliquées dans la dépression chez les patients atteints de HD.30 L’apathie résulte d’une atteinte des zones paralimbiques préfrontales médianes, cingulaires antérieures et temporales antérieures, en particulier de l’amygdale et des structures sous-corticales associées.31-33 L’apathie chez les patients atteints de la MA a été corrélée à une hypoperfusion fronto-temporale dans une étude23 et à une hypoperfusion temporo-pariétale droite dans une autre.21 L’apathie peut également survenir lors d’accidents vasculaires cérébraux impliquant le membre postérieur de la capsule interne.20 L’apathie n’a fait l’objet de recherches que récemment, et il peut exister plusieurs formes d’apathie médiées par un réseau de structures connexes. Les corrélats anatomiques de l’apathie nécessitent une étude plus approfondie, mais les observations ici suggèrent que les régions frontales impliquées dans la DFT et les structures diencéphaliques affectées dans la PSP sont particulièrement pertinentes.
Une partie du chevauchement signalé entre la dépression et l’apathie peut être due à l’utilisation d’instruments de dépression qui contiennent des items d’apathie. Une autre explication possible est que des circuits similaires pourraient être impliqués dans les deux symptômes mais pourraient différer dans le degré d’implication des neurotransmetteurs parmi les différents troubles. Les agents sérotoninergiques soulagent fréquemment la dépression mais peuvent augmenter l’apathie, tandis que les agents dopaminergiques peuvent soulager l’apathie34,35 mais sont inefficaces comme antidépresseurs ; dans les maladies déficientes en acétylcholine comme la MA, un agent cholinomimétique peut être utile pour réduire l’apathie, mais il n’affecte pas l’humeur36. Une explication potentielle des réponses thérapeutiques différentielles de la dépression et de l’apathie est que la dépression résulte d’un déséquilibre de la fonction des neurotransmetteurs paralimbiques qui entraîne une émotion négative excessive, tandis que l’apathie se produit lorsque le cortex est fonctionnellement déconnecté de l’entrée paralimbique pertinente.
Il faut reconnaître les limites et les forces de cette étude. Premièrement, l’évaluation comportementale était un objectif principal dans la collecte de ces données, mais les hypothèses spécifiques présentées ici n’ont pas été énoncées de manière prospective et les analyses sont post hoc. Deuxièmement, la dépression et l’apathie sont des expériences humaines subjectives, et les stratégies d’information des soignants utilisées par le NPI peuvent ne pas être tout à fait exactes – bien qu’il existe des preuves suggérant que les soignants sont capables de fournir des évaluations valides de la dépression et de l’apathie.8,37 Troisièmement, les patients atteints de la MP, de la HD et de la PSP présentaient des déficiences cognitives nettement moins importantes, ce qui pourrait expliquer certaines des différences que nous avons décrites comme étant spécifiques à la maladie. Quatrièmement, les médicaments psychotropes peuvent provoquer l’apathie et la dépression, et nous ne pouvons pas garantir que certains de nos patients ne les prenaient pas ; cependant, ces évaluations ont généralement été effectuées lors de la visite initiale avant le traitement médicamenteux. Enfin, nous ne disposons pas de données d’autopsie pour confirmer l’exactitude de notre diagnostic.
L’étude est renforcée par la présence d’un grand groupe de patients atteints de troubles neurodégénératifs et d’une grande variation dans l’expression clinique et pathologique de leurs maladies, ce qui nous permet de tirer des conclusions sur la relation entre l’apathie et la dépression en présence de voies neurales différentiellement altérées. En outre, l’utilisation d’un instrument fiable et valide qui sépare les deux constructions permet une comparaison significative.
Nous concluons que l’apathie est fréquente dans les maladies neurodégénératives et est séparable de la dépression. Elle peut être traitée par des médicaments dopaminergiques ou cholinergiques, et sa présence doit être recherchée au cours d’une évaluation neuropsychiatrique de routine. L’apathie ne doit pas être attribuée à la dépression, et le diagnostic de dépression doit être basé sur les symptômes de tristesse et les sentiments d’impuissance, de désespoir et d’inutilité.
ACKNOWLEDGMENTS
Ce projet a été soutenu par une bourse de neuroscience du département des Anciens combattants, une subvention du National Institute on Aging Alzheimer’s Disease Center (AG10123), et le Sidell-Kagan Research Fund.
TABLE 1.
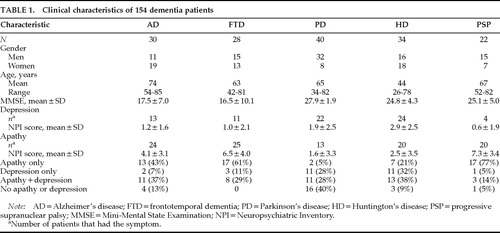
TABLE 2.
1. Marin RS : Diagnostic différentiel et classification de l’apathie. Am J Psychiatry 1990 ; 147:22-30Crossref, Medline, Google Scholar
2. American Psychiatric Association : Manuel diagnostique et statistique des troubles mentaux, 4e édition. Washington, DC, American Psychiatric Association, 1994Google Scholar
3. Hamilton M : A rating scale for depression. J Neurol Neurosurg Psychiatry 1960 ; 23:56-62Crossref, Medline, Google Scholar
4. Marin RS, Firinciogullari S, Biedrzycki RC : Les sources de convergence entre les mesures d’apathie et de dépression. J Affect Disord 1993 ; 28:117-124Crossref, Medline, Google Scholar
5. Starkstein SE, Mayberg HS, Preziosi TJ, et al : Reliability, validity, and clinical correlates of apathy in Parkinson’s disease. J Neuropsychiatry Clin Neurosci 1992 ; 4:134-139Link, Google Scholar
6. Marin RS : Apathy : a neuropsychiatric syndrome. J Neuropsychiatry Clin Neurosci 1991 ; 3:243-254Link, Google Scholar
7. Marin RS, Firinciogullari S, Biedrzycki RC : Différences de groupe dans la relation entre l’apathie et la dépression. J Nerv Ment Dis 1994 ; 182:235-239Crossref, Medline, Google Scholar
8. Marin RS, Biedrzycki RC, Firinciogullari S : Reliability and validity of the apathy evaluation scale. Psychiatry Res 1991 ; 38:143-162Crossref, Medline, Google Scholar
9. Levy ML, Miller BL, Cummings JL, et al : Alzheimer disease and frontotemporal dementias : behavioral distinctions. Arch Neurol 1996 ; 53:687-690Crossref, Medline, Google Scholar
10. Mega MS, Cummings JL, Fiorello T, et al : Le spectre des changements comportementaux dans la maladie d’Alzheimer. Neurology 1996 ; 46:130-135Crossref, Medline, Google Scholar
11. Litvan I, Mega MS, Cummings JL, et al : Aspects neuropsychiatriques de la paralysie supranucléaire progressive. Neurology 1996 ; 47:1184-1189Crossref, Medline, Google Scholar
12. Bozzola FG, Gorelick PB, Freels S : Les changements de personnalité dans la maladie d’Alzheimer. Arch Neurol 1992 ; 49:297-300Crossref, Medline, Google Scholar
13. Devanand DP, Brockington CD, Moody BJ, et al : Behavioral syndromes in Alzheimer’s disease. International Psychogeriatrics 1992 ; 4(suppl)2:161-184Google Scholar
14. Cummings JL, Mega M, Gray K, et al : The Neuropsychiatric Inventory : comprehensive assessment of psychopathology in dementia. Neurology 1994 ; 44:2308-2314Crossref, Medline, Google Scholar
15. McKhann G, Drachman D, Folstein M, et al : Diagnostic clinique de la maladie d’Alzheimer : rapport du groupe de travail NINCDS-ADRDA sous les auspices du Department of Health and Human Services Task Force on Alzheimer’s Disease. Neurology 1984 ; 34:939-944Crossref, Medline, Google Scholar
16. Brun A, Englund B, Gustafson L, et al : Déclaration de consensus : Critères cliniques et neuropathologiques de la démence frontotemporale : les groupes de Lund et Manchester. J Neurol Neurosurg Psychiatry 1994 ; 57:416-418Crossref, Medline, Google Scholar
17. Litvan I, Agid Y, Jankovic J, et al : Accuracy of clinical criteria for the diagnosis of progressive supranuclear palsy (Steele-Richardson-Olszewski syndrome) : report of the NINDS-SPSP International Workshop. Neurology 1996 ; 47:1-9Crossref, Medline, Google Scholar
18. Blin J, Baron JC, Dubois B, et al : Étude par tomographie par émission de positons dans la paralysie supranucléaire progressive. Modèle hypométabolique cérébral et corrélations clinicométaboliques. Arch Neurol 1990 ; 47:747-752Crossref, Medline, Google Scholar
19. Folstein MF, Folstein SE, McHugh PR : « Mini-Mental State » : une méthode pratique pour évaluer l’état cognitif des patients pour le clinicien. J Psychiatr Res 1975 ; 12:189-198Crossref, Medline, Google Scholar
20. Starkstein SE, Fedoroff JP, Price TR, et al : Apathy following cerebrovascular lesions. Stroke 1993 ; 24:1625-1630Crossref, Medline, Google Scholar
21. Ott BR, Noto RB, Fogel BS : Apathie et perte d’intuition dans la maladie d’Alzheimer : une étude d’imagerie SPECT. J Neuropsychiatry Clin Neurosci 1996 ; 8:41-46Link, Google Scholar
22. Paulsen JS, Stout JC, DeLaPena J, et al : Syndromes comportementaux frontaux dans la démence corticale et sous-corticale. Assessment 1996 ; 3:327-337Crossref, Google Scholar
23. Craig AH, Cummings JL, Fairbanks L, et al : Cerebral blood flow correlates of apathy in Alzheimer disease. Arch Neurol 1996 ; 53:1116-1120Crossref, Medline, Google Scholar
24. Cooper JK, Mungas D, Weiler PG : Relation entre l’état cognitif et les comportements anormaux dans la maladie d’Alzheimer. J Am Geriatr Soc 1990 ; 38:867-870Crossref, Medline, Google Scholar
25. Sultzer DL, Levin HS, Mahler ME, et al : Évaluation des troubles cognitifs, psychiatriques et comportementaux chez les patients atteints de démence : l’échelle d’évaluation neurocomportementale. J Am Geriatr Soc 1992 ; 40:549-555Crossref, Medline, Google Scholar
26. Starkstein SE, Robinson RG : Depression in cerebrovascular disease, in Depression in Neurologic Disease, edited by Starkstein SE, Robinson RG. Baltimore, Johns Hopkins University Press, 1993, pp 28-49Google Scholar
27. Baxter LR, Schwartz JM, Phelps ME, et al : Reduction of prefrontal cortex glucose metabolism common to three types of depression. Arch Gen Psychiatry 1989 ; 46:243-250Crossref, Medline, Google Scholar
28. Mayberg HS, Starkstein SE, Sadzot B, et al : Hypométabolisme sélectif dans le lobe frontal inférieur chez les patients déprimés atteints de la maladie de Parkinson. Ann Neurol 1990 ; 28:57-64Crossref, Medline, Google Scholar
29. Ring HA, Bench CJ, Trimble MR, et al : Depression in Parkinson’s disease : a positron emission study. Br J Psychiatry 1994 ; 165:333-339Crossref, Medline, Google Scholar
30. Mayberg HS : Neuroimaging studies of depression in neurologic disease, in Depression in Neurologic Disease, édité par Starkstein SE, Robinson RG. Baltimore, Johns Hopkins University Press, 1993, pp 186-216Google Scholar
31. Cummings JL : Circuits frontaux-sous-corticaux et comportement humain. Arch Neurol 1993 ; 50:873-880Crossref, Medline, Google Scholar
32. Duffy JD : The neural substrates of motivation. Psychiatric Annals 1997 ; 27:24-29Crossref, Google Scholar
33. Marin RS : Apathie : concept, syndrome, mécanismes neuronaux et traitement. Seminars in Clinical Neuropsychiatry 1996 ; 1:304-314Medline, Google Scholar
34. Marin RS, Fogel BS, Hawkins J, et al : Apathy : a treatable syndrome. J Neuropsychiatry Clin Neurosci 1995 ; 7:23-30Link, Google Scholar
35. Watanabe MD, Martin EM, DeLeon OA, et al : Successful methylphenidate treatment of apathy after subcortical infarcts. J Neuropsychiatry Clin Neurosci 1995 ; 7:502-504Link, Google Scholar
36. Kaufer DI, Cummings JL, Christine D : Effet de la tacrine sur les symptômes comportementaux dans la maladie d’Alzheimer : une étude ouverte. J Geriatr Psychiatry Neurol 1996 ; 9:1-6Crossref, Medline, Google Scholar
37. Logsdon RG, Teri L : Depression in Alzheimer’s disease patients : caregivers as surrogate reporters. J Am Geriatr Soc 1995 ; 43:150-155Crossref, Medline, Google Scholar
.