Ablación térmica endovenosa para varices: puntos fuertes y débiles
Descargar este número Volver al resumen
Holanda
ABSTRACT
La ablación endovenosa es un método frecuentemente utilizado para el tratamiento de las varices. La ablación endovenosa con láser es la técnica más utilizada, seguida de la ablación por radiofrecuencia. Los tratamientos térmicos endovenosos calientan la vena, lo que provoca la oclusión trombótica y, finalmente, la fibrosis de la pared venosa. La ablación endovenosa con vapor es una técnica nueva que aún no se ha estudiado ampliamente. En este artículo se analizan los procedimientos, los puntos fuertes y los puntos débiles de los tratamientos de ablación térmica endovenosa disponibles en la actualidad.
INTRODUCCIÓN
El tratamiento endovenoso es actualmente uno de los métodos más utilizados para tratar las varices. Las varices son manifestaciones de la enfermedad venosa crónica (EVC), que puede dar lugar a complicaciones graves. La ECV es una afección médica común. Se calcula que la prevalencia de las varices oscila entre el 2% y el 40%.1-4 La prevalencia de las úlceras venosas en las piernas, la fase final de la ECV, es mucho menor. Es muy difícil, si no imposible, predecir qué pacientes con varices desarrollarán una úlcera de pierna. No obstante, se ha calculado que aproximadamente la mitad de las úlceras venosas de la pierna son el resultado de una insuficiencia venosa superficial.5 El coste del tratamiento de las úlceras de la pierna es muy elevado; por lo tanto, es probable que el tratamiento de las varices, que puede reducir la incidencia de las úlceras de la pierna en un 50%, sea rentable.
El tratamiento de las varices puede dividirse a grandes rasgos en cuatro categorías: terapia de compresión, tratamiento quirúrgico, escleroterapia y ablación térmica endovenosa. La ligadura quirúrgica de la unión, con o sin extirpación, ha sido el estándar de atención en el tratamiento de las venas safenas grandes y pequeñas insuficientes durante más de 100 años.
En la última década, los procedimientos de ablación térmica endovenosa (EVTA) se han convertido en la terapia más utilizada para las venas varicosas safenas, especialmente en los países donde se ha introducido el reembolso del procedimiento. Estas técnicas mínimamente invasivas responden a la demanda de modalidades de tratamiento cosméticamente superiores, menos invasivas y más exitosas. Introducidas hace sólo 10 años, estas técnicas han cambiado radicalmente el tratamiento de las varices.6 Las técnicas de EVTA actualmente disponibles son: la ablación endovenosa por láser (EVLA), la ablación por radiofrecuencia (RFA) y la ablación endovenosa por vapor. La ventaja de la EVTA es que es mínimamente invasiva y puede realizarse fácilmente con anestesia local tumescente, sin necesidad de anestesia espinal o general. Además, según un metaanálisis de las diferentes técnicas de tratamiento de las varices, las tasas de recidiva son menores tras la EVTA que tras la cirugía clásica.7
Los primeros procedimientos de EVTA se realizaron mediante RFA con el sistema VNUS® Closure Plus.8 La EVLA se desarrolló poco después y pronto se convirtió en el método de EVTA más utilizado en todo el mundo. En los últimos años, se han introducido dos nuevos sistemas de ARF: VNUS Closure Fast (ARF segmentaria) y la termoterapia inducida por radiofrecuencia (RFITT). La última técnica de ablación térmica utiliza vapor a una temperatura de 120°C. En los siguientes párrafos, se describirán las diferentes técnicas de EVTA y se explorarán sus puntos fuertes y débiles.
ABLACIÓN LÁSER ENDOVENOSA
La EVLA puede realizarse bajo anestesia local tumescente en un entorno ambulatorio. El acceso venoso se obtiene mediante la punción con una aguja o cánula de 16F o 18F bajo guía ecográfica. Lo más habitual es que la vena safena mayor (GSV) insuficiente se introduzca a nivel de la rodilla y la vena safena menor (SSV) a mitad de la pantorrilla. Una vez establecida la entrada en la vena, se pasa una aguja guía a través de la vena hasta el nivel de la unión con el sistema venoso profundo. Si la vena es demasiado tortuosa, tiene un diámetro pequeño (debido a un espasmo) y tiene grandes ramas laterales, o contiene segmentos trombóticos o escleróticos (después de una trombosis venosa superficial o de un tratamiento previo), el avance de la aguja puede ser difícil y se indica precaución debido al mayor riesgo de perforación y embolia. Tras comprobar la posición de la aguja guía con ultrasonidos, se retira la aguja y se realiza una pequeña incisión cutánea de 3 mm. Se coloca una vaina introductora sobre la aguja guía y se sitúa unos centímetros por debajo de la unión. Posteriormente, se introduce la fibra láser (cuyo diámetro oscila entre 200 y 600 μm) tras retirar el alambre guía. En algunos juegos de láser, no hay alambre guía y la vaina se introduce directamente a través de una cánula. En otros juegos de láser, la fibra láser ya está dentro de la vaina. Un paso crucial en el procedimiento de EVLA es la colocación de la punta de la fibra láser a 1 ó 2 cm distal de la unión bajo guía ecográfica, en vista longitudinal (Figura 1). Se administran entre 250 y 500 ml (dependiendo de la longitud de la vena tratada) de anestesia tumescente en el espacio perivenoso, de nuevo bajo control ecográfico, utilizando una jeringa o una bomba de infusión mecánica (figura 2). La anestesia tumescente se justifica porque reduce el dolor, enfría el tejido perivenoso y disminuye el diámetro venoso. Tras la activación, el protocolo puede utilizar un pullback láser continuo (normalmente a unos 3-5 mm/s, dependiendo de la potencia y la longitud de onda; con el láser de 1320 nm, se suele utilizar una velocidad de pullback de 1 mm/s)9 o un pullback pulsado, con el objetivo de administrar unos 30 a 60 J/cm. Se indican vendas compresivas o medias elásticas médicas (20-30 mm Hg en el tobillo) durante una semana después del tratamiento.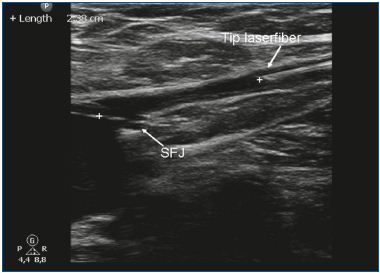
Figura 1. La punta de la fibra láser se coloca 1-2 cm por debajo de la unión safenofemoral (SFJ).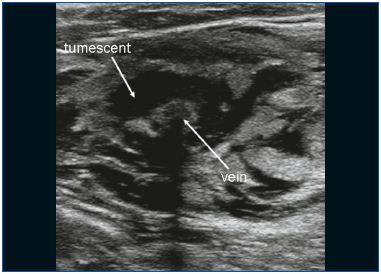
Figura 2. Se administra anestesia tumescente alrededor de la vena.
EVLA puede utilizarse para tratar VGD y VSM insuficientes. Debido a la rigidez y el tamaño de los desechables, las venas safenas lineales con un diámetro de 5 mm o más son ideales para la EVLA (Figura 3). La EVLA también puede utilizarse para la ablación de la vena safena accesoria anterior o la vena safena accesoria posterior (a menudo junto con una vena de Giacomini), y de las venas perforantes.10-11 La EVLA es el tratamiento endotérmico menos costoso. En los Países Bajos, los desechables láser más baratos cuestan aproximadamente 120 euros. Otra ventaja de la EVLA es que se puede variar la cantidad de energía suministrada. Ajustando la velocidad de retroceso, la potencia o ambas, se puede modificar la cantidad total de energía suministrada por centímetro. En el caso de las venas pequeñas, sólo se utilizan 20 J/cm, mientras que en el tratamiento de las venas grandes se puede utilizar una energía mayor (es decir, 60 J/cm). De todas las técnicas de ablación térmica, la EVLA es la más estudiada en la literatura médica. Las primeras grandes series de casos informaron de altas tasas de éxito12-13 y muchas series han seguido con resultados comparables. En 2009, publicamos un metaanálisis sobre los distintos tratamientos de las varices safenas y demostramos que la EVLA tenía la tasa de éxito más alta, del 93%, tras 5 años de seguimiento. La EVLA fue significativamente mejor que la extirpación, la ARF y la escleroterapia con espuma guiada por ultrasonidos.7 Un reciente y amplio ensayo clínico aleatorizado realizado por Rasmussen et al14 mostró que la EVLA, la ARF y la extirpación (bajo anestesia tumescente) eran igualmente eficaces. La ARF se asoció con una recuperación más rápida y menos dolor postoperatorio que la EVLA y la extirpación.14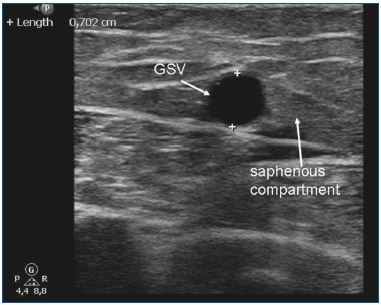
Figura 3. La vena safena mayor (GSV) en el compartimento safeno.
Dificultades
Pueden producirse algunas dificultades técnicas durante un procedimiento de EVLA, incluso en manos experimentadas. Cuando se tratan varices recurrentes, se indica precaución porque la introducción de la fibra láser puede ser difícil. En las venas muy tortuosas, la introducción de la aguja guía puede ser difícil y es posible la perforación de la vena. Otra desventaja de algunos conjuntos de EVLA es que la introducción no es un procedimiento de un solo paso, sino que requiere varios pasos consecutivos (introducción de la aguja guía, la vaina y luego la fibra láser). Cada paso adicional aumenta el riesgo de cometer errores. Se han descrito algunas complicaciones que dependen de los desechables; por ejemplo, la permanencia de un alambre guía en el interior del cuerpo tras finalizar el procedimiento de EVLA.15 Estas complicaciones suelen ser graves y podrían evitarse si el procedimiento pudiera realizarse con un solo desechable en lugar de tres. Los efectos secundarios de la EVLA suelen ser leves. El estudio sistemático de todas las publicaciones sobre la EVLA mostró que los efectos secundarios más comunes eran las equimosis y el dolor, con o sin induración (100%). Otros efectos secundarios menos frecuentes fueron: quemaduras en la piel (
ABLACIÓN POR RADIOFRECUENCIA
Existen varios sistemas de ablación por radiofrecuencia. Los primeros procedimientos de ARF se realizaron con el sistema VNUS® Closure Plus.8 En los últimos años se han introducido dos nuevos sistemas de ARF: VNUS® Closure Fast (ARF segmentaria) y la termoterapia inducida por radiofrecuencia (RFITT). La ARF segmentaria es actualmente el método más popular.
Procedimiento El acceso al GSV se obtiene con una aguja de calibre 16 bajo guía ecográfica, normalmente a nivel de la rodilla o por debajo de ella o en el punto más distal del reflujo. La SSV se suele pinchar a media pantorrilla. El catéter Closure (VNUS Medical Technologies, Inc, Sunnyvale, California) se coloca a 2 cm distal de la unión bajo visualización ecográfica longitudinal. Con el sistema Closure Plus, se puede utilizar un manguito o un vendaje para extraer la sangre de la vena. Los pequeños electrodos situados en el extremo del catéter «paraguas» tienen contacto directo con la pared venosa y emiten energía de alta radiofrecuencia (regulada por potencia, impedancia y tiempo) que es generada por un generador de radiofrecuencia (VNUS Medical Technologies, Inc). La radiofrecuencia calienta el tejido local hasta 85°C a 90°C en el lugar de contacto directo, con el calor conducido a planos tisulares más profundos, provocando la contracción del colágeno, la denudación del endotelio y la obliteración de la luz venosa.17 La velocidad de retroceso del catéter es de 3 cm/min (el tiempo total de retroceso es de 20 minutos de media para la VAG entre la unión safenofemoral y el nivel de la rodilla, pero puede ser más rápido a temperaturas más altas).18
La ARF segmentaria (Closure Fast) tiene un segmento distal terapéutico de 7 cm que se calienta a 120°C.19 Esta técnica es mucho más rápida que la técnica Closure Plus y puede realizarse bajo anestesia local tumescente en un entorno ambulatorio. Al igual que en la EVLA, se aplica anestesia tumescente perivenosa para optimizar el contacto superficial y disminuir el dolor y el riesgo de disestesia.20 Según la metodología descrita en el primer informe sobre la ARF segmentaria, se recomienda la compresión externa proporcionada por la sonda de ultrasonidos y la compresión manual durante el tratamiento para mejorar el contacto del catéter con la pared de la vena.21 Los primeros 7 cm de la vena se tratan con dos ciclos de calor (20 s cada uno). A continuación, el catéter se reubica en el segmento adyacente guiado por los marcadores del eje en pasos de 6,5 cm para permitir un solapamiento de 5 mm de los segmentos venosos calentados. El tiempo total de tratamiento es mucho más corto con la ARF segmentaria que con el sistema Closure Plus y suele durar sólo de 2 a 3 minutos. Están indicados los vendajes compresivos o las medias de compresión médica elástica durante 1 semana después del tratamiento.
Desde el año 2000, varias series de casos publicadas han demostrado que la ARF puede utilizarse con éxito para tratar las varices safenas.8, 22-25 La primera serie de casos a largo plazo, de un solo centro, informó de que la ARF era eficaz en aproximadamente el 90% de 140 extremidades después de 2 años.20 Otro estudio informó de tasas de éxito del 83% al 88% tras un seguimiento de 5 años.26 Nuestro meta-análisis mostró que la ARF (utilizando Closure Plus) tenía una tasa de éxito del 88%, que era inferior a la tasa de éxito de la EVLA.6
La ARF segmentaria no se incluyó en el análisis, ya que en ese momento no había estudios disponibles. Sin embargo, ahora hay algunas publicaciones sobre la ARF segmentaria con resultados prometedores. La primera serie de casos de 252 GSV tratados informó de una tasa de oclusión del 99,6%,21 y otros dos ensayos demostraron tasas de éxito >90%.27,28 La principal ventaja de la ARF segmentaria es probablemente que produce menos dolor postoperatorio que la EVLA. Se cree que esto está relacionado con la temperatura máxima más baja que se alcanza durante la ARF, y la ausencia de perforaciones en la pared de la vena.27 Otra ventaja de la ARF segmentaria es que es un procedimiento estandarizado y la introducción del catéter se realiza en un solo paso. Esto puede reducir el riesgo de complicaciones relacionadas con el desecho.
Deficiencias
Por un lado, la estandarización de un procedimiento es una ventaja. Por otro lado, puede no ser posible tratar ciertos casos «especiales». Con la ARF segmentaria es imposible tratar venas con una longitud inferior a 7 cm, aunque esto puede cambiar con la reciente introducción de un nuevo catéter con un segmento de calentamiento de 3 cm. En ciertos casos (es decir, pacientes con ramas laterales, o pequeñas partes tortuosas de las venas varicosas), también puede ser deseable cambiar la entrega de energía, pero con la ARF segmentaria no es posible tratar las venas a otra temperatura que la preestablecida. Como resultado de la temperatura relativamente baja que se alcanza durante la ARF segmentaria, el mecanismo de trabajo es la desnaturalización del colágeno y la contracción de la pared de la vena.17 Esto difiere de la EVLA en la que también se informa de la carbonización y la destrucción más rigurosa de la pared de la vena.29 La eficacia a largo plazo de la ARF segmentaria aún no se ha estudiado y sólo se aclarará después de realizar un estudio aleatorio que compare la EVLA y la ARF segmentaria con un seguimiento a largo plazo.
Figura 4. El vapor es expulsado desde dos zonas en la punta del catéter.
Ablación con vapor
La ablación endovenosa con vapor (EVSA) es un nuevo método de ablación venosa térmica que funciona calentando la estructura venosa con vapor a una temperatura máxima de 120°C (Figura 4). El procedimiento es muy similar a la EVLA y puede realizarse con el paciente bajo anestesia local tumescente en régimen ambulatorio. La vena se punciona con una aguja o cánula de calibre 16 bajo la guía de una ecografía. La VAG se suele pinchar en la zona distal del reflujo, a la altura de la rodilla o justo por encima de ella, porque el acceso es fácil en este lugar y el riesgo de lesión nerviosa es bajo. La SSV se suele puncionar a mitad de camino o en una posición en el tercio distal de la pantorrilla, dependiendo del diámetro de la vena y de la extensión del reflujo. Tras la punción de la vena, el catéter de vapor (de 1,2 mm de diámetro) se introduce en la vena a través de la aguja hueca y, a continuación, la punta ecoguiada del catéter se coloca con cuidado a 3 cm de la unión, bajo guía ecográfica. Este es también el paso más importante del procedimiento. Se administran entre 250 y 500 ml (dependiendo de la longitud de la vena tratada) de anestesia tumescente en el espacio perivenoso bajo control ecográfico. La anestesia tumescente es necesaria para reducir el dolor, enfriar el tejido perivenoso y disminuir el diámetro venoso. Tras la activación, el catéter libera pequeñas «bocanadas» de vapor y se retira de forma escalonada. En la primera activación, 3 cm por debajo de la unión safenofemoral o safenopoplítea, se deben administrar cuatro bocanadas de vapor, mientras se ejerce una suave presión manual sobre la unión. A lo largo de la vena, se pueden administrar dos o tres bocanadas de vapor a intervalos de 1 cm, dependiendo del diámetro de la vena. Durante los primeros 4 cm del tratamiento, se debe seguir aplicando una compresión manual de la unión, ya que el vapor puede alcanzar varios centímetros más allá de la punta del catéter. Después del procedimiento, se aconseja a los pacientes que lleven medias de compresión médica elástica hasta el muslo (rango de presión de 25-35 mm Hg) durante 1 semana y que se movilicen inmediatamente después del tratamiento.
Figura 5. El catéter de vapor flexible tiene un diámetro pequeño.
Dos características que podrían ser ventajosas (en comparación con la EVLA) son que la EVSA se realiza con un volumen muy pequeño de agua estéril (aproximadamente 2 mL por vena tratada) y que la temperatura es relativamente constante, con un máximo de 120°C. El catéter de vapor se introduce directamente a través de la aguja de punción, sin necesidad de un alambre guía o una vaina, lo que resulta en un procedimiento fácil y seguro. Sólo se ha publicado una serie de casos sobre la ablación con vapor, que mostró que los resultados comunicados por los pacientes eran favorables, que el procedimiento era muy bien tolerado, que las puntuaciones de dolor eran bajas y que los pacientes estaban muy satisfechos con el tratamiento.30 Una ventaja del procedimiento de EVSA es que el catéter es diminuto y muy flexible (Figura 5); el diámetro del catéter de vapor de la SVS (1,2 mm) es casi un 50% más pequeño que el catéter utilizado para la ARF segmentaria (2,33 mm). La flexibilidad del catéter de vapor puede facilitar la colocación en los vasos más tortuosos y las venas perforantes, que a veces son de difícil acceso con los catéteres más rígidos utilizados para la ARF y las fibras de vidrio rígidas utilizadas para la EVLA. Por lo tanto, incluso los afluentes de las venas pueden tratarse con la EVSA. El vapor se libera desde dos pequeñas zonas en la punta del catéter, lo que permite tratar cualquier longitud de vena. El vapor se libera bajo presión y, por tanto, se dispersa en una distancia de al menos 2 cm. Esto puede suponer una ventaja adicional en el tratamiento de venas perforantes cortas y segmentos cortos de afluentes serpenteantes.
La principal limitación de la ablación con vapor es la falta de pruebas; hasta la fecha sólo se han publicado tres informes sobre la ablación con vapor.30-32 El otro problema es que la ablación con vapor aún no está reembolsada, lo que limitará el número de procedimientos realizados y, por tanto, dificultará aún más la obtención de mediciones de resultados. Se necesitan estudios comparativos más amplios para comparar la eficacia a largo plazo y la relación riesgo-beneficio de la ablación con vapor con las técnicas endovenosas existentes.
DISCUSIÓN
El «patrón oro» para el tratamiento de las venas safenas insuficientes ha sido la ligadura más la extirpación durante los últimos 100 años. Esta situación ha cambiado en la última década con la introducción de las técnicas de ablación térmica endovenosa. Las técnicas de EVTA se realizan siempre bajo la guía del dúplex y están demostrando ser muy eficaces, con altas tasas de éxito en el seguimiento a corto plazo. Dado que la eficacia de los tratamientos EVTA actuales es excelente (>90%), los efectos secundarios son leves y las complicaciones graves son raras, cualquier procedimiento EVTA nuevo debería tener al menos el mismo rendimiento o, preferiblemente, algunas ventajas sobre las técnicas existentes. La hipótesis es que la EVSA será al menos tan eficaz como la EVLA o la RFA. Las ventajas del vapor sobre los otros procedimientos de ablación pueden ser una mejor tolerancia por parte de los pacientes; un procedimiento más seguro, más rápido y más fácil; costes más bajos; y facilidad de uso para las venas perforantes y tributarias. Los estudios futuros deberán comparar los distintos tratamientos endovenosos en términos de eficacia y resultados comunicados por los pacientes. También es necesario seguir trabajando para tratar de responder a las preguntas restantes sobre el mecanismo de funcionamiento exacto de los diferentes tratamientos EVTA. En la era de la evaluación de la tecnología sanitaria y los análisis de rentabilidad, los costes relacionados con el tratamiento serán cada vez más importantes y esto seguirá siendo una cuestión crucial en el futuro.
Dos características que podrían ser ventajosas (en comparación con la EVLA) son que la EVSA se realiza con un volumen muy pequeño de agua estéril (aproximadamente 2 mL por vena tratada) y que la temperatura es relativamente constante, con un máximo de 120°C. El catéter de vapor se introduce directamente a través de la aguja de punción, sin necesidad de un alambre guía o una vaina, lo que resulta en un procedimiento fácil y seguro. Sólo se ha publicado una serie de casos sobre la ablación con vapor, que mostró que los resultados comunicados por los pacientes eran favorables, que el procedimiento era muy bien tolerado, que las puntuaciones de dolor eran bajas y que los pacientes estaban muy satisfechos con el tratamiento.30 Una ventaja del procedimiento de EVSA es que el catéter es diminuto y muy flexible (Figura 5); el diámetro del catéter de vapor de la SVS (1,2 mm) es casi un 50% más pequeño que el catéter utilizado para la ARF segmentaria (2,33 mm). La flexibilidad del catéter de vapor puede facilitar la colocación en los vasos más tortuosos y las venas perforantes, que a veces son de difícil acceso con los catéteres más rígidos utilizados para la ARF y las fibras de vidrio rígidas utilizadas para la EVLA. Por lo tanto, incluso los afluentes de las venas pueden tratarse con la EVSA. El vapor se libera desde dos pequeñas zonas en la punta del catéter, lo que permite tratar cualquier longitud de vena. El vapor se libera bajo presión y, por tanto, se dispersa en una distancia de al menos 2 cm. Esto puede suponer una ventaja adicional en el tratamiento de venas perforantes cortas y segmentos cortos de afluentes serpenteantes.
La principal limitación de la ablación con vapor es la falta de pruebas; hasta la fecha sólo se han publicado tres informes sobre la ablación con vapor.30-32 El otro problema es que la ablación con vapor aún no está reembolsada, lo que limitará el número de procedimientos realizados y, por tanto, dificultará aún más la obtención de mediciones de resultados. Se necesitan estudios comparativos más amplios para comparar la eficacia a largo plazo y la relación riesgo-beneficio de la ablación con vapor con las técnicas endovenosas existentes.
DISCUSIÓN
El «patrón oro» para el tratamiento de las venas safenas insuficientes ha sido la ligadura más la extirpación durante los últimos 100 años. Esta situación ha cambiado en la última década con la introducción de las técnicas de ablación térmica endovenosa. Las técnicas de EVTA se realizan siempre bajo la guía del dúplex y están demostrando ser muy eficaces, con altas tasas de éxito en el seguimiento a corto plazo. Dado que la eficacia de los tratamientos EVTA actuales es excelente (>90%), los efectos secundarios son leves y las complicaciones graves son raras, cualquier procedimiento EVTA nuevo debería tener al menos el mismo rendimiento o, preferiblemente, algunas ventajas sobre las técnicas existentes. La hipótesis es que la EVSA será al menos tan eficaz como la EVLA o la RFA. Las ventajas del vapor sobre los otros procedimientos de ablación pueden ser una mejor tolerancia por parte de los pacientes; un procedimiento más seguro, más rápido y más fácil; costes más bajos; y facilidad de uso para las venas perforantes y tributarias. Los estudios futuros deberán comparar los distintos tratamientos endovenosos en términos de eficacia y resultados comunicados por los pacientes. También es necesario seguir trabajando para tratar de responder a las preguntas restantes sobre el mecanismo de funcionamiento exacto de los diferentes tratamientos EVTA. En la era de la evaluación de la tecnología sanitaria y los análisis de rentabilidad, los costes relacionados con el tratamiento serán cada vez más importantes y esto seguirá siendo una cuestión crucial en el futuro.
1. Evans CJ, Fowkes FG, Ruckley CV, Lee AJ. Prevalencia de venas varicosas e insuficiencia venosa crónica en hombres y mujeres de la población general: Edinburgh Vein Study. J Epidemiol Community Health. 1999;53:149-153.
2. Kurz X, Kahn SR, Abenhaim L, et al. Chronic venous disorders of the leg: epidemiology, outcomes, diagnosis and management. Resumen de un informe basado en la evidencia del grupo de trabajo VEINES. Estudios epidemiológicos y económicos sobre la insuficiencia venosa. Int Angiol. 1999;18:83-102.
3. Abramson JH, Hopp C, Epstein LM. The epidemiology of varicose veins. Una encuesta en el oeste de Jerusalén. J Epidemiol Community Health. 1981;35:213-217.
4. Brand FN, Dannenberg AL, Abbott RD, Kannel WB. The epidemiology of varicose veins: the Framingham Study. Am J Prev Med. 1988;4:96-101.
5. Magnusson MB, Nelzen O, Risberg B, Sivertsson R. A colour Doppler ultrasound study of venous reflux in patients with chronic leg ulcers. Eur J Vasc Endovasc Surg. 2001;21:353-360.
6. De Maeseneer M. The endovenous revolution. Br J Surg. 2011;98:1037- 1038.
7. Van Den Bos R, Arends L, Kockaert M, Neumann M, Nijsten T..Endovenous therapies of lower extremity varicosities: a meta-analysis. J Vasc Surg. 2009;49:230-239.
8. Goldman MP. Closure of the greater saphenous vein with endoluminal radiofrequency thermal heating of the vein wall in combination with ambulatory phlebectomy: preliminary 6-month follow-up. Dermatol Surg. 2000;26:452-456.
9. Goldman MP, Mauricio M, Rao J. Cierre intravascular con láser de 1320 nm de la vena safena mayor: un estudio de seguimiento de 6 a 12 meses. Dermatol Surg. 2004;30:1380-1385.
10. Proebstle TM, Herdemann S. Early results and feasibility of incompetent perforator vein ablation by endovenous laser treatment. Dermatol Surg. 2007;33:162-168.
11. Bush RG, Hammond K. Treatment of incompetent vein of Giacomini (thigh extension branch). Ann Vasc Surg. 2007;21:245-248.
12. Navarro L, Min RJ, Bone C. Endovenous laser: a new minimally invasive method of treatment for varicose veins-preliminary observations using an 810 nm diode laser. Dermatol Surg. 2001;27:117-122.
13. Min RJ, Zimmet SE, Isaacs MN, Forrestal MD. Endovenous laser treatment of the incompetent greater saphenous vein. J Vasc Interv Radiol. 2001;12:1167-1171.
14. Rasmussen LH, Lawaetz M, Bjoern L, Vennits B, Blemings A, Eklof B. Randomized clinical trial comparing endovenous laser ablation, radiofrequency ablation, foam sclerotherapy and surgical stripping for great saphenous varicose veins. Br J Surg. 2011;98:1079-1087.
15. Kichari JR, Salomonsz R, Postema RR. . Ned Tijdschr Geneeskd. 2008;152:1387-1390.
16. Doganci S, Demirkilic U. Comparison of 980 nm laser and bare-tip fibre with 1470 nm laser and radial fibre in the treatment of great saphenous vein varicosities: a prospective randomised clinical trial. Eur J Vasc Endovasc Surg. 2010;40:254-259.
17. Schmedt CG, Sroka R, Steckmeier S, et al. Investigation on radiofrequency and laser (980 nm) effects after endoluminal treatment of saphenous vein insufficiency in an ex-vivo model. Eur J Vasc Endovasc Surg. 2006;32:318- 325.
18. Zikorus AW, Mirizzi MS. Evaluation of setpoint temperature and pullback speed on vein adventitial temperature during endovenous radiofrequency energy delivery in an in-vitro model. Vasc Endovascular Surg. 2004;38:167- 174.
19. Sitio web de VNUS. http://www.vnus.com (último acceso: 4 de agosto de 2008).
20. Weiss RA, Weiss MA. Controlled radiofrequency endovenous occlusion using a unique radiofrequency catheter under duplex guidance to eliminate saphenous varicose vein reflux: a 2-year follow-up. Dermatol Surg. 2002;28:38-42.
21. Proebstle TM, Vago B, Alm J, Göckeritz O, Lebard C, Pichot O. Treatment of the incompetent great saphenous vein by endovenous radiofrequency powered segmental thermal ablation: first clinical experience. Vasc Surg. 2008;47:151-156.
22. Sybrandy JE, Wittens CH. Initial experiences in endovenous treatment of saphenous vein reflux. J Vasc Surg. 2002;36:1207-1212.
23. Goldman MP, Amiry S. Closure of the greater saphenous vein with endoluminal radiofrequency thermal heating of the vein wall in combination with ambulatory phlebectomy: 50 patients with more than 6-month follow-up. Dermatol Surg. 2002;28:29-31.
24. Manfrini S, Gasbarro V, Danielsson G, et al. Endovenous management of saphenous vein reflux. Grupo de estudio del tratamiento endovenoso del reflujo. J Vasc Surg. 2000;32:330-342.
25. Chandler JG, Pichot O, Sessa C, Schuller-Petrovi’c S, Osse FJ, Bergan JJ. Definición del papel de la ligadura extendida de la unión safenofemoral: un estudio comparativo prospectivo. J Vasc Surg. 2000;32:941-953.
26. Merchant RF, Pichot O; Closure Study Group. Resultados a largo plazo de la obliteración por radiofrecuencia endovenosa del reflujo safeno como tratamiento de la insuficiencia venosa superficial. J Vasc Surg. 2005;42:502- 509.
27. Shepherd AC, Gohel MS, Lim CS, Hamish M, Davies AH. Pain following 980-nm endovenous laser ablation and segmental radiofrequency ablation for varicose veins: a prospective observational study. Vasc Endovascular Surg. 2010;44:212-216.
28. Proebstle TM, Alm J, Gockeritz O, et al. Three-year European follow-up of endovenous radiofrequency-powered segmental thermal ablation of the great saphenous vein with or without treatment of calf varicosities. J Vasc Surg. 2011;54:146-152.
29. Weiss RA. Comparación de la radiofrecuencia endovenosa frente a la oclusión con láser de diodo de 810 nm de grandes venas en un modelo animal. Dermatol Surg. 2002;28:56-61.
30. van den Bos RR, Milleret R, Neumann M, Nijsten T. Proof-of-principle study of steam ablation as novel thermal therapy for saphenous varicose veins. J Vasc Surg. 2010;53:181-186.
31. Milleret R, Mehier H, Llopinet A, et al. Oblitération veineuse par vapeur à haute température. Phlebologie. 2008;61:223-226.
32. van Ruijven PW, van den Bos RR, Alazard LM, van der Geld CW, Nijsten T. Temperature measurements for dose-finding in steam ablation. J Vasc Surg. 2011;53:1454-1456.