Ablation thermique endoveineuse des varices : forces et faiblesses
Télécharger ce numéro Retour au sommaire
Les Pays-Bas
ABSTRACT
L’ablation endoveineuse est une méthode fréquemment utilisée pour traiter les varices. L’ablation au laser endoveineux est la technique la plus fréquemment utilisée, suivie par l’ablation par radiofréquence. Les traitements thermiques endoveineux chauffent la veine, ce qui entraîne une occlusion thrombotique et finalement une fibrose de la paroi veineuse. L’ablation endoveineuse à la vapeur est une nouvelle technique qui n’a pas encore été étudiée de manière approfondie. Dans cet article, les procédures, les points forts et les points faibles des traitements d’ablation thermique endoveineuse actuellement disponibles sont discutés.
INTRODUCTION
Le traitement endoveineux est actuellement l’une des méthodes les plus fréquemment utilisées pour traiter les varices. Les varices sont des manifestations de la maladie veineuse chronique (MVC), qui peut entraîner de graves complications. La maladie veineuse chronique est une affection courante. La prévalence des varices est estimée entre 2 % et 40 %.1-4 La prévalence des ulcères veineux de jambe, stade ultime de la MCV, est beaucoup plus faible. Il est très difficile, voire impossible, de prédire quels patients atteints de varices développeront un ulcère de jambe. Néanmoins, il a été estimé qu’environ la moitié des ulcères de jambe veineux sont le résultat d’une insuffisance veineuse superficielle.5 Le coût du traitement des ulcères de jambe est très élevé ; le traitement des varices, qui peut réduire l’incidence des ulcères de jambe de 50%, est donc susceptible d’être rentable.
Le traitement des varices peut grossièrement être divisé en quatre catégories : la thérapie par compression, le traitement chirurgical, la sclérothérapie et l’ablation thermique endoveineuse. La ligature chirurgicale de la jonction avec ou sans stripping a été la norme de soins dans le traitement des grandes et petites veines saphènes insuffisantes depuis plus de 100 ans.
Au cours de la dernière décennie, les procédures d’ablation thermique endoveineuse (EVTA) sont devenues la thérapie la plus fréquemment utilisée pour les varices saphènes, en particulier dans les pays où le remboursement de la procédure a été introduit. Ces techniques mini-invasives répondent à la demande de modalités de traitement esthétiquement supérieures, moins invasives et plus efficaces. Introduites il y a seulement 10 ans, ces techniques ont radicalement changé le traitement des varices.6 Les techniques EVTA actuellement disponibles sont : l’ablation au laser endoveineux (EVLA), l’ablation par radiofréquence (RFA) et l’ablation à la vapeur endoveineuse. L’avantage de l’EVTA est qu’elle est peu invasive et peut facilement être réalisée sous anesthésie locale tumescente, sans nécessiter d’anesthésie générale ou rachidienne. De plus, selon une méta-analyse des différentes techniques de traitement des varices, les taux de récidive sont plus faibles après une EVTA qu’après une chirurgie classique.7
Les premières procédures d’EVTA ont été réalisées par RFA avec le système VNUS® Closure Plus.8 L’EVLA a été développée peu après et est rapidement devenue la méthode d’EVTA la plus fréquemment utilisée dans le monde. Au cours des dernières années, deux nouveaux systèmes RFA ont été introduits : VNUS Closure Fast (RFA segmentaire) et la thermothérapie induite par radiofréquence (RFITT). La dernière technique d’ablation thermique utilise de la vapeur à une température de 120°C. Dans les paragraphes suivants, les différentes techniques d’EVTA seront décrites et leurs forces et faiblesses explorées.
ABLATION LASER ENDOUEUSE
L’EVLA peut être réalisée sous anesthésie locale tumescente en ambulatoire. L’accès veineux est obtenu par ponction avec une aiguille ou une canule 16F ou 18F sous guidage échographique. Le plus souvent, on pénètre dans la grande veine saphène (GSV) au niveau du genou et dans la petite veine saphène (SSV) à mi-mollet. Une fois l’entrée dans la veine établie, un fil guide est passé à travers l’aiguille dans la veine jusqu’au niveau de la jonction avec le système veineux profond. Si la veine est trop tortueuse, si elle a un petit diamètre (en raison d’un spasme) et de grandes branches latérales, ou si elle contient des segments thrombotiques ou scléreux (après une thrombose veineuse superficielle ou un traitement antérieur), l’avancement du fil peut être difficile et la prudence est de mise en raison du risque accru de perforation et d’événements emboliques. Après avoir vérifié la position du fil-guide par échographie, l’aiguille est retirée et une petite incision cutanée de 3 mm est pratiquée. Une gaine d’introduction est placée sur le fil guide et est positionnée quelques centimètres sous la jonction. Par la suite, la fibre laser (dont le diamètre varie de 200 à 600 μm) est introduite après avoir retiré le fil guide. Dans certains ensembles laser, il n’y a pas de fil guide et la gaine est directement introduite par une canule. Dans d’autres kits laser, la fibre laser se trouve déjà à l’intérieur de la gaine. Une étape cruciale de la procédure EVLA est le positionnement de l’extrémité de la fibre laser à 1 à 2 cm distalement de la jonction sous guidage échographique, en vue longitudinale (Figure 1). Environ 250 à 500 ml (selon la longueur de la veine traitée) d’anesthésie tumescente sont administrés dans l’espace périveineux, toujours sous guidage échographique à l’aide d’une seringue ou d’une pompe à perfusion mécanique (Figure 2). L’anesthésie tumescente est justifiée car elle réduit la douleur, refroidit le tissu périveineux et diminue le diamètre veineux. Après l’activation, le protocole peut utiliser un recul laser continu (généralement à environ 3-5 mm/s, selon la puissance et la longueur d’onde ; avec le laser 1320 nm, une vitesse de recul de 1 mm/s est couramment utilisée)9 ou un recul pulsé, avec pour objectif d’administrer environ 30 à 60 J/cm. Des bandages compressifs ou des bas médicaux élastiques (20-30 mm Hg à la cheville) sont indiqués pendant une semaine après le traitement.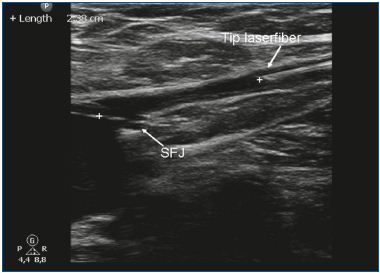
Figure 1. L’extrémité de la fibre laser est positionnée 1 à 2 cm sous la
jonction saphéno-fémorale (JSF).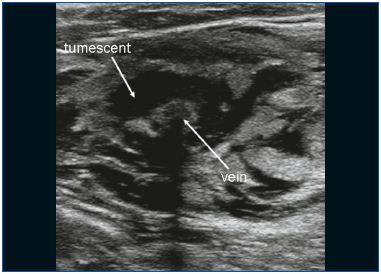
Figure 2. Une anesthésie tumescente est administrée autour de la veine.
L’EVLA peut être utilisé pour traiter les VGS et les VSS insuffisantes. En raison de la rigidité et de la taille des dispositifs à usage unique, les veines saphènes linéaires d’un diamètre de 5 mm ou plus sont idéales pour l’EVLA (figure 3). L’EVLA peut également être utilisé pour l’ablation de la veine saphène accessoire antérieure ou de la veine saphène accessoire postérieure (souvent en association avec une veine de Giacomini), et des veines perforantes.10-11 L’EVLA est le traitement endothermique le moins coûteux. Aux Pays-Bas, le laser jetable le moins cher coûte environ 120 euros. Un autre avantage de l’EVLA est que la quantité d’énergie délivrée peut être modifiée. En ajustant la vitesse de recul, la puissance, ou les deux, la quantité totale d’énergie délivrée par centimètre peut être modifiée. Pour les petites veines, on utilise seulement 20 J/cm, alors qu’une énergie plus élevée (c’est-à-dire 60 J/cm) peut être utilisée pour traiter les grosses veines. De toutes les techniques d’ablation thermique, l’EVLA est la plus étudiée dans la littérature médicale. Les premières grandes séries de cas ont rapporté des taux de réussite élevés12-13 et de nombreuses séries ont suivi avec des résultats comparables. En 2009, nous avons publié une méta-analyse sur les différents traitements des varices saphènes et montré que l’EVLA avait le taux de réussite le plus élevé, soit 93 % après 5 ans de suivi. L’EVLA était significativement plus efficace que le stripping, la RFA et la sclérothérapie à la mousse guidée par ultrasons.7 Un vaste essai clinique randomisé réalisé récemment par Rasmussen et al14 a montré que l’EVLA, la RFA et le stripping (sous anesthésie tumescente) étaient tous aussi efficaces. La RFA était associée à un rétablissement plus rapide et à moins de douleur postopératoire que l’EVLA et le stripping.14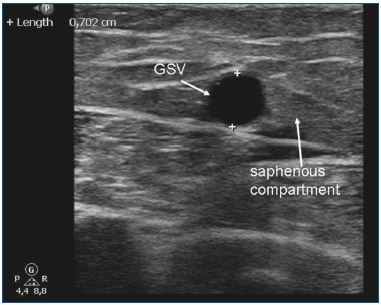
Figure 3. La grande veine saphène (GSV) dans le compartiment
saphène.
Certaines difficultés techniques peuvent survenir lors d’une procédure EVLA, même entre des mains expérimentées. Lors du traitement de varices récurrentes, la prudence est de mise car l’introduction de la fibre laser peut être difficile. Dans les veines très tortueuses, l’introduction du fil guide peut être difficile et la perforation de la veine est possible. Un autre inconvénient de certains sets EVLA est que l’introduction ne se fait pas en une seule étape, mais nécessite plusieurs étapes consécutives (introduction du fil guide, de la gaine, puis de la fibre laser). Chaque étape supplémentaire augmente le risque de commettre des erreurs. Certaines complications ont été décrites comme dépendant des produits jetables, par exemple un fil-guide restant à l’intérieur du corps après la fin de la procédure EVLA.15 Ces complications sont généralement graves et pourraient être évitées si la procédure pouvait être réalisée avec un seul produit jetable au lieu de trois. Les effets secondaires de la procédure EVLA sont généralement légers. L’étude systématique de toutes les publications sur EVLA a montré que les effets secondaires les plus fréquents étaient les ecchymoses et la douleur, avec ou sans induration (100%). D’autres effets secondaires moins fréquents comprenaient : des brûlures cutanées (
ABLATION PAR RADIOFREQUENCE
Plusieurs systèmes d’ablation par radiofréquence existent. Les premières procédures d’ARF ont été réalisées avec le système VNUS® Closure Plus.8 Au cours des dernières années, deux nouveaux systèmes d’ARF ont été introduits : VNUS® Closure Fast (RFA segmentaire) et la thermothérapie induite par radiofréquence (RFITT). L’ARF segmentaire est actuellement la méthode la plus populaire.
Procédure L’accès à la VGS est obtenu avec une aiguille de calibre 16 sous guidage échographique, généralement au niveau ou en dessous du genou ou au point le plus distal du reflux. La VSS est généralement ponctionnée au milieu du mollet. Le cathéter Closure (VNUS Medical Technologies, Inc, Sunnyvale, Californie) est positionné à 2 cm distalement de la jonction sous visualisation échographique longitudinale. Avec le système Closure Plus, un brassard ou un bandage peut être utilisé pour exprimer le sang de la veine. Les petites électrodes situées à l’extrémité du cathéter « parapluie » sont en contact direct avec la paroi veineuse et émettent une haute énergie de radiofréquence (régulée par la puissance, l’impédance et le temps) qui est générée par un générateur de radiofréquence (VNUS Medical Technologies, Inc). La radiofréquence chauffe les tissus locaux jusqu’à 85°C à 90°C au niveau du contact direct, la chaleur étant conduite vers des plans tissulaires plus profonds, ce qui provoque une rétraction du collagène, une dénudation de l’endothélium et une oblitération de la lumière veineuse17. La vitesse de retrait du cathéter est de 3 cm/min (le temps total de retrait est de 20 min en moyenne pour la VGS entre la jonction saphéno-fémorale et le niveau du genou, mais peut être plus rapide à des températures plus élevées).18
L’ARF segmentaire (Closure Fast) comporte un segment distal thérapeutique de 7 cm qui chauffe à 120°C.19 Cette technique est beaucoup plus rapide que la technique Closure Plus et peut être réalisée sous anesthésie locale tumescente en ambulatoire. Comme pour l’EVLA, une anesthésie tumescente périveineuse est appliquée pour optimiser le contact avec la surface et pour diminuer la douleur et le risque de dysesthésie.20 Selon la méthodologie décrite dans le premier rapport sur l’ARF segmentaire, une compression externe fournie par la sonde à ultrasons et une compression manuelle sont recommandées pendant le traitement pour améliorer le contact du cathéter avec la paroi de la veine.21 Les 7 premiers cm de veine sont traités avec deux cycles de chaleur (20 s chacun). Le cathéter est ensuite repositionné sur le segment adjacent, guidé par des marqueurs de tige par pas de 6,5 cm pour permettre un chevauchement de 5 mm des segments de veine chauffés. La durée totale du traitement est beaucoup plus courte avec l’ARF segmentaire qu’avec le système Closure Plus et ne dure généralement que 2 à 3 minutes. Des bandages compressifs ou des bas de contention élastiques médicaux sont indiqués pendant 1 semaine après le traitement.
Depuis 2000, plusieurs séries de cas publiées ont montré que l’ARF peut être utilisée avec succès pour traiter les varices saphènes.8, 22-25 La première série de cas à long terme, importante et monocentrique a rapporté que l’ARF était efficace dans environ 90 % des 140 membres après 2 ans20. Une étude distincte a rapporté des taux de réussite de 83%-88% après un suivi de 5 ans.26 Notre méta-analyse a montré que l’EFR (en utilisant Closure Plus) avait un taux de réussite de 88%, ce qui était inférieur au taux de réussite de l’EVLA.6
L’EFR segmentaire n’a pas été incluse dans l’analyse, car à l’époque aucune étude n’était disponible. Cependant, il y a maintenant quelques publications sur l’EFAR segmentaire avec des résultats prometteurs. La première série de cas de 252 VGS traitées a rapporté un taux d’occlusion de 99,6 %,21 et deux autres essais ont démontré des taux de réussite >90 %.27,28 Le principal avantage de l’EFAR segmentaire est probablement qu’elle entraîne moins de douleur postopératoire que l’EVLA. On pense que cela est lié à la température maximale plus basse qui est atteinte pendant l’ACR, et à l’absence de perforations de la paroi veineuse.27 Un autre avantage de l’ACR segmentaire est qu’il s’agit d’une procédure standardisée et que l’introduction du cathéter est effectuée en une seule étape. Cela peut réduire le risque de complications liées à l’élimination.
D’une part, la standardisation d’une procédure est un avantage. D’autre part, il peut ne pas être possible de traiter certains cas « spéciaux ». Avec l’ARF segmentaire, il est impossible de traiter des veines d’une longueur inférieure à 7 cm, bien que cela puisse changer avec l’introduction récente d’un nouveau cathéter avec un segment chauffant de 3 cm. Dans certains cas (par exemple, chez les patients présentant des branches latérales ou de petites parties tortueuses de varices), il peut également être souhaitable de modifier l’apport d’énergie, mais avec l’ACR segmentaire, il n’est pas possible de traiter les veines à une température autre que celle qui est prédéfinie. En raison de la température relativement basse qui est atteinte pendant l’ACR segmentaire, le mécanisme de travail est la dénaturation du collagène et le rétrécissement de la paroi de la veine.17 Cela diffère de l’EVLA dans lequel une carbonisation et une destruction plus rigoureuse de la paroi de la veine sont également rapportées.29 L’efficacité à long terme de l’ARF segmentaire n’a pas encore été étudiée et ne deviendra claire qu’après la réalisation d’une étude randomisée comparant l’EVLA et l’ARF segmentaire avec un suivi à long terme.
Figure 4. La vapeur est éjectée de deux zones à l’extrémité du cathéter.
ABLATION À LA VAPEUR
L’ablation endoveineuse à la vapeur (EVSA) est une nouvelle méthode d’ablation veineuse thermique qui fonctionne en chauffant la structure veineuse avec de la vapeur à une température maximale de 120°C (figure 4). La procédure est très similaire à l’EVLA et peut être réalisée sous anesthésie locale tumescente en ambulatoire. La veine est ponctionnée avec une aiguille de calibre 16 ou une canule sous guidage échographique. La VGS est généralement ponctionnée au site distal du reflux, au niveau du genou ou juste au-dessus, car l’accès est facile à cet endroit et le risque de lésion nerveuse est faible. La VSS est généralement ponctionnée à mi-chemin ou à un endroit situé dans le tiers distal du mollet, en fonction du diamètre de la veine et de l’étendue du reflux. Après avoir ponctionné la veine, le cathéter à vapeur (1,2 mm de diamètre) est passé à travers l’aiguille creuse dans la veine et l’extrémité échogène du cathéter est ensuite soigneusement positionnée à 3 cm de la jonction, sous guidage échographique. Il s’agit là encore de l’étape la plus importante de la procédure. Environ 250 à 500 ml (selon la longueur de la veine traitée) d’anesthésie tumescente sont administrés dans l’espace périveineux sous guidage échographique. L’anesthésie tumescente est nécessaire pour réduire la douleur, refroidir le tissu périveineux et diminuer le diamètre veineux. Après activation, le cathéter libère de petites « bouffées » de vapeur et est retiré progressivement. Lors de la première activation, à 3 cm sous la jonction saphéno-fémorale ou saphénopoplitée, quatre bouffées de vapeur doivent être administrées, tout en exerçant une légère pression manuelle sur la jonction. Plus loin le long de la veine, deux ou trois bouffées de vapeur peuvent être administrées à 1 cm d’intervalle en fonction du diamètre de la veine. Pour les 4 premiers centimètres du traitement, il faut continuer à exercer une compression manuelle sur la jonction car la vapeur peut atteindre plusieurs centimètres au-delà de l’extrémité du cathéter. Après la procédure, il est conseillé aux patients de porter des bas de compression élastiques médicaux à hauteur de la cuisse (plage de pression 25-35 mm Hg) pendant 1 semaine et de se mobiliser immédiatement après le traitement.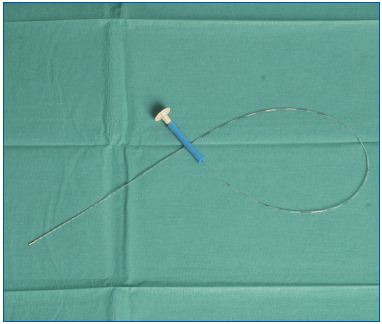
Figure 5. Le cathéter à vapeur flexible a un petit diamètre.
Deux caractéristiques qui pourraient être avantageuses (par rapport à l’EVLA) sont que l’EVSA est réalisée avec un très petit volume d’eau stérile (environ 2 ml par veine traitée) et que la température est relativement constante, avec un maximum de 120°C. Le cathéter à vapeur est introduit directement par l’aiguille de ponction, sans qu’il soit nécessaire d’utiliser un fil guide ou une gaine, ce qui rend la procédure facile et sûre. Une seule série de cas d’ablation à la vapeur a été publiée, qui a montré que les résultats rapportés par les patients étaient favorables, que la procédure était très bien tolérée, que les scores de douleur étaient faibles et que les patients étaient très satisfaits du traitement.30 Un avantage de la procédure EVSA est que le cathéter est minuscule et très flexible (Figure 5) ; le diamètre du cathéter à vapeur SVS (1,2 mm) est presque 50 % plus petit que le cathéter utilisé pour l’ARF segmentaire (2,33 mm). La flexibilité du cathéter à vapeur peut faciliter le placement dans des vaisseaux plus tortueux et des veines perforantes, qui sont parfois difficiles à atteindre avec les cathéters plus rigides utilisés pour la RFA et les fibres de verre rigides utilisées pour l’EVLA. Même les veines affluentes peuvent donc être traitées par EVSA. La vapeur est libérée à partir de deux petites zones situées à l’extrémité du cathéter, ce qui permet de traiter n’importe quelle longueur de veine. La vapeur est libérée sous pression et se disperse donc sur une distance d’au moins 2 cm. Cela peut présenter un avantage supplémentaire dans le traitement des veines perforantes courtes et des segments courts des affluents sinueux.
La principale limite de l’ablation à la vapeur est le manque de preuves ; seuls trois rapports sur l’ablation à la vapeur ont été publiés à ce jour.30-32 L’autre problème est que l’ablation à la vapeur n’est pas encore remboursée, ce qui limitera le nombre de procédures effectuées et rendra donc les mesures des résultats encore plus difficiles à obtenir. Des études comparatives de plus grande envergure sont nécessaires pour comparer l’efficacité à long terme et le rapport risque-bénéfice de l’ablation à la vapeur avec ceux des techniques endoveineuses existantes.
DISCUSSION
Le « gold standard » pour le traitement des veines saphènes insuffisantes a été la ligature plus le stripping pendant les 100 dernières années. Cette situation a changé au cours de la dernière décennie avec l’introduction des techniques d’ablation thermique endoveineuse. Les techniques EVTA sont toujours réalisées sous guidage duplex et s’avèrent très efficaces avec des taux de réussite élevés lors du suivi à court terme. Comme l’efficacité des traitements EVTA actuels est excellente (>90%), que les effets secondaires sont légers et que les complications graves sont rares, toute nouvelle procédure EVTA devrait au moins présenter des performances égales ou, de préférence, certains avantages par rapport aux techniques existantes. L’hypothèse est que l’EVSA sera au moins aussi efficace que l’EVLA ou l’ARF. Les avantages de la vapeur par rapport aux autres procédures d’ablation peuvent être une meilleure tolérance du patient, une procédure plus sûre, plus rapide et plus facile, des coûts moins élevés et une facilité d’utilisation pour les veines perforantes et les affluents. Les études futures devraient comparer les différents traitements endoveineux en termes d’efficacité et de résultats rapportés par les patients. Des travaux supplémentaires sont également nécessaires pour tenter de répondre aux questions restantes sur le mécanisme de fonctionnement exact des différents traitements EVTA. À l’ère de l’évaluation des technologies de la santé et des analyses coût-efficacité, les coûts liés au traitement deviendront de plus en plus importants et cela restera une question cruciale à l’avenir.
Deux caractéristiques qui pourraient être avantageuses (par rapport à l’EVLA) sont que l’EVSA est réalisée avec un très petit volume d’eau stérile (environ 2 ml par veine traitée) et que la température est relativement constante, avec un maximum de 120°C. Le cathéter à vapeur est introduit directement par l’aiguille de ponction, sans qu’il soit nécessaire d’utiliser un fil guide ou une gaine, ce qui rend la procédure facile et sûre. Une seule série de cas d’ablation à la vapeur a été publiée, qui a montré que les résultats rapportés par les patients étaient favorables, que la procédure était très bien tolérée, que les scores de douleur étaient faibles et que les patients étaient très satisfaits du traitement.30 Un avantage de la procédure EVSA est que le cathéter est minuscule et très flexible (Figure 5) ; le diamètre du cathéter à vapeur SVS (1,2 mm) est presque 50 % plus petit que le cathéter utilisé pour l’ARF segmentaire (2,33 mm). La flexibilité du cathéter à vapeur peut faciliter le placement dans des vaisseaux plus tortueux et des veines perforantes, qui sont parfois difficiles à atteindre avec les cathéters plus rigides utilisés pour la RFA et les fibres de verre rigides utilisées pour l’EVLA. Même les veines affluentes peuvent donc être traitées par EVSA. La vapeur est libérée à partir de deux petites zones situées à l’extrémité du cathéter, ce qui permet de traiter n’importe quelle longueur de veine. La vapeur est libérée sous pression et se disperse donc sur une distance d’au moins 2 cm. Cela peut présenter un avantage supplémentaire dans le traitement des veines perforantes courtes et des segments courts des affluents sinueux.
La principale limite de l’ablation à la vapeur est le manque de preuves ; seuls trois rapports sur l’ablation à la vapeur ont été publiés à ce jour.30-32 L’autre problème est que l’ablation à la vapeur n’est pas encore remboursée, ce qui limitera le nombre de procédures effectuées et rendra donc les mesures des résultats encore plus difficiles à obtenir. Des études comparatives de plus grande envergure sont nécessaires pour comparer l’efficacité à long terme et le rapport risque-bénéfice de l’ablation à la vapeur avec ceux des techniques endoveineuses existantes.
DISCUSSION
Le « gold standard » pour le traitement des veines saphènes insuffisantes a été la ligature plus le stripping pendant les 100 dernières années. Cette situation a changé au cours de la dernière décennie avec l’introduction des techniques d’ablation thermique endoveineuse. Les techniques EVTA sont toujours réalisées sous guidage duplex et s’avèrent très efficaces avec des taux de réussite élevés lors du suivi à court terme. Comme l’efficacité des traitements EVTA actuels est excellente (>90%), que les effets secondaires sont légers et que les complications graves sont rares, toute nouvelle procédure EVTA devrait au moins présenter des performances égales ou, de préférence, certains avantages par rapport aux techniques existantes. L’hypothèse est que l’EVSA sera au moins aussi efficace que l’EVLA ou l’ARF. Les avantages de la vapeur par rapport aux autres procédures d’ablation peuvent être une meilleure tolérance du patient, une procédure plus sûre, plus rapide et plus facile, des coûts moins élevés et une facilité d’utilisation pour les veines perforantes et les affluents. Les études futures devraient comparer les différents traitements endoveineux en termes d’efficacité et de résultats rapportés par les patients. Des travaux supplémentaires sont également nécessaires pour tenter de répondre aux questions restantes sur le mécanisme de fonctionnement exact des différents traitements EVTA. À l’ère de l’évaluation des technologies de la santé et des analyses coût-efficacité, les coûts liés au traitement deviendront de plus en plus importants et cela restera une question cruciale à l’avenir.
1. Evans CJ, Fowkes FG, Ruckley CV, Lee AJ. Prévalence des varices et de l’insuffisance veineuse chronique chez les hommes et les femmes dans la population générale : Edinburgh Vein Study. J Epidemiol Community Health. 1999;53:149-153.
2. Kurz X, Kahn SR, Abenhaim L, et al. Chronic venous disorders of the leg : epidemiology, outcomes, diagnosis and management. Résumé d’un rapport fondé sur des données probantes du groupe de travail VEINES. Études épidémiologiques et économiques sur l’insuffisance veineuse. Int Angiol. 1999;18:83-102.
3 Abramson JH, Hopp C, Epstein LM. The epidemiology of varicose veins. A survey in western Jerusalem. J Epidemiol Community Health. 1981;35:213-217.
4 Brand FN, Dannenberg AL, Abbott RD, Kannel WB. The epidemiology of varicose veins : the Framingham Study. Am J Prev Med. 1988;4:96-101.
5. Magnusson MB, Nelzen O, Risberg B, Sivertsson R. A colour Doppler ultrasound study of venous reflux in patients with chronic leg ulcers. Eur J Vasc Endovasc Surg. 2001;21:353-360.
6. De Maeseneer M. The endovenous revolution. Br J Surg. 2011;98:1037- 1038.
7. Van Den Bos R, Arends L, Kockaert M, Neumann M, Nijsten T..Thérapies endoveineuses des varicosités des membres inférieurs : une méta-analyse. J Vasc Surg. 2009;49:230-239.
8. Goldman MP. Closure of the greater saphenous vein with endoluminal radiofrequency thermal heating of the vein wall in combination with ambulatory phlebectomy : preliminary 6-month follow-up. Dermatol Surg. 2000;26:452-456.
9. Goldman MP, Mauricio M, Rao J. Intravascular 1320-nm laser closure of the great saphenous vein : a 6- to 12- month follow-up study. Dermatol Surg. 2004;30:1380-1385.
10. Proebstle TM, Herdemann S. Early results and feasibility of incompetent perforator vein ablation by endovenous laser treatment. Dermatol Surg. 2007;33:162-168.
11. Bush RG, Hammond K. Treatment of incompetent vein of Giacomini (thigh extension branch). Ann Vasc Surg. 2007;21:245-248.
12. Navarro L, Min RJ, Bone C. Endovenous laser : a new minimally invasive method of treatment for varicose veins-preliminary observations using an 810 nm diode laser. Dermatol Surg. 2001;27:117-122.
13. Min RJ, Zimmet SE, Isaacs MN, Forrestal MD. Traitement au laser endoveineux de la grande veine saphène incompétente. J Vasc Interv Radiol. 2001;12:1167-1171.
14. Rasmussen LH, Lawaetz M, Bjoern L, Vennits B, Blemings A, Eklof B. Randomized clinical trial comparing endovenous laser ablation, radiofrequency ablation, foam sclerotherapy and surgical stripping for great saphenous varicose veins. Br J Surg. 2011;98:1079-1087.
15. Kichari JR, Salomonsz R, Postema RR . . Ned Tijdschr Geneeskd. 2008;152:1387-1390.
16. Doganci S, Demirkilic U. Comparaison du laser 980 nm et de la fibre à pointe nue avec le laser 1470 nm et la fibre radiale dans le traitement des varicosités de la grande veine saphène : un essai clinique prospectif randomisé. Eur J Vasc Endovasc Surg. 2010;40:254-259.
17. Schmedt CG, Sroka R, Steckmeier S, et al. Investigation sur les effets de la radiofréquence et du laser (980 nm) après traitement endoluminal de l’insuffisance de la veine saphène dans un modèle ex-vivo. Eur J Vasc Endovasc Surg. 2006;32:318- 325.
18. Zikorus AW, Mirizzi MS. Évaluation de la température de consigne et de la vitesse de retrait sur la température adventielle de la veine pendant la délivrance d’énergie par radiofréquence endoveineuse dans un modèle in-vitro. Vasc Endovascular Surg. 2004;38:167- 174.
19. Site web du VNUS. http://www.vnus.com (dernière consultation le 4 août 2008).
20. Weiss RA, Weiss MA. Controlled radiofrequency endovenous occlusion using a unique radiofrequency catheter under duplex guidance to eliminate saphenous varicose vein reflux : a 2-year follow-up. Dermatol Surg. 2002;28:38-42.
21. Proebstle TM, Vago B, Alm J, Göckeritz O, Lebard C, Pichot O. Traitement de la grande veine saphène incompétente par ablation thermique segmentaire alimentée par radiofréquence endoveineuse : première expérience clinique. Vasc Surg. 2008;47:151-156.
22. Sybrandy JE, Wittens CH. Expériences initiales dans le traitement endoveineux du reflux de la veine saphène. J Vasc Surg. 2002;36:1207-1212.
23. Goldman MP, Amiry S. Closure of the greater saphenous vein with endoluminal radiofrequency thermal heating of the vein wall in combination with ambulatory phlebectomy : 50 patients with more than 6-month follow-up. Dermatol Surg. 2002;28:29-31.
24. Manfrini S, Gasbarro V, Danielsson G, et al. Endovenous management of saphenous vein reflux. Endovenous Reflux Management Study Group. J Vasc Surg. 2000;32:330-342.
25. Chandler JG, Pichot O, Sessa C, Schuller-Petrovi’c S, Osse FJ, Bergan JJ. Définir le rôle de la ligature étendue de la jonction saphéno-fémorale : une étude comparative prospective. J Vasc Surg. 2000;32:941-953.
26. Merchant RF, Pichot O ; Closure Study Group. Résultats à long terme de l’oblitération par radiofréquence endoveineuse du reflux saphène comme traitement de l’insuffisance veineuse superficielle. J Vasc Surg. 2005;42:502- 509.
27. Shepherd AC, Gohel MS, Lim CS, Hamish M, Davies AH. Pain following 980-nm endovenous laser ablation and segmental radiofrequency ablation for varicose veins : a prospective observational study. Vasc Endovascular Surg. 2010;44:212-216.
28. Proebstle TM, Alm J, Gockeritz O, et al. Suivi européen de trois ans d’ablation thermique segmentaire par radiofréquence endoveineuse de la grande veine saphène avec ou sans traitement des varicosités du mollet. J Vasc Surg. 2011;54:146-152.
29. Weiss RA. Comparaison entre la radiofréquence endoveineuse et l’occlusion par laser à diode de 810 nm des grandes veines dans un modèle animal. Dermatol Surg. 2002;28:56-61.
30. van den Bos RR, Milleret R, Neumann M, Nijsten T. Proof-of-principle study of steam ablation as novel thermal therapy for saphenous varicose veins. J Vasc Surg. 2010;53:181-186.
31. Milleret R, Mehier H, Llopinet A, et al. Oblitération veineuse par vapeur à haute température. Phlébologie. 2008;61:223-226.
32. van Ruijven PW, van den Bos RR, Alazard LM, van der Geld CW, Nijsten T. Temperature measurements for dose-finding in steam ablation. J Vasc Surg. 2011;53:1454-1456.