アパシーは、意識レベルの低下、認知障害、または感情的苦痛に起因しない意欲の低下と定義されている1。 うつ病は、涙ぐみ、悲しみ、不安、焦燥感、不眠、食欲不振、無価値感や絶望感、繰り返し起こる死の考えなどで証明される大きな感情的苦痛を伴う2。 DSM-IV2やHamilton Rating Scale for Depression(Ham-D)3など、従来のうつ病の診断法や測定法では、アパシーはうつ病の一側面として扱われているが、患者によっては異なる治療法を必要とする識別可能な臨床構成要素である可能性がある4-7。 その結果、アパシーと抑うつの関係は診断群によって異なることがわかった。 アパシーと抑うつの関係は診断群間で異なっていたが、アパシーと抑うつの絶対値には大きな差があり、診断群内では有意に相関していた。 アルツハイマー病では、アパシーが高く、抑うつ度が低いことが多く、左脳梗塞や大うつ病では、アパシーが低く、抑うつ度が高いことが多かった。 右脳卒中患者は、この2つの症状が同じレベルである唯一のグループであり、アパシーと抑うつが相関しない唯一のグループであった。
神経変性疾患は、明らかな脳の病理を生み出し、神経精神症状を伴うことが多いため、アパシーとうつ病の研究に役立ちます。 過去の2つの研究で、私たちは、前頭側頭型認知症(FTD)および進行性核上性麻痺(PSP)の患者は、アパシーがより重く、抑うつが相対的に少ないことで、AD患者と区別できることを発見しました9,11。
METHODS
Subjects
4つのアカデミックセンターで合計154名の患者が受診した。
AD患者30人とFTD患者28人が、University of California at Los Angeles、University of California at Los Angeles-Harbor Medical Center、West Los Angeles Veterans Affairs Medical Centerの認知症クリニックを受診しました。 前頭側頭型認知症は、LundとManchesterのグループが作成した基準に基づいて診断されました16。
パーキンソン病(PD)患者40名は、on-off症候群、難治性の振戦、最大量の抗PD薬投与時の徐脈などの理由で、パリドート手術を受けるために、カリフォルニア大学ロサンゼルス校の運動障害クリニックに紹介されました。 患者は、2人の神経内科医と1人の神経外科医によってスクリーニングされました。
米国国立神経疾患・脳卒中研究所(NINDS)の外来で受診した22名のPSP患者については、これまでに報告されています11。
カリフォルニア大学サンディエゴ校の専門クリニックに来院した34人のハンチントン病(HD)患者は、全員が典型的な振り付け型運動障害を持ち、さらにHDを持つ第一度近親者が少なくとも1人いました。
患者は、慢性精神疾患、頭部外傷、脳血管障害、記述されている以外の錐体外路障害、ビタミン欠乏症、甲状腺機能低下症、梅毒、その他の医学的疾患の有無を確認されました。 HD、PSP、PDのすべての患者が、DSM-IVの認知症の基準を満たすほどの記憶障害を持っているわけではないが、臨床診断で定義された変性脳疾患を持っていた。 我々は、認知症のレベルではなく、アパシーと抑うつの関係に焦点を当てた。
評価
行動データは、NPIを用いた介護者インタビューで収集した。 妄想、幻覚、焦燥、抑うつ、不安、多幸感、無気力、抑制、過敏、異常な運動行動(歩調を合わせる、物思いにふける、強迫観念など)など、痴呆症で起こる10の行動を評価するものです。 頻度評価(1~4)に重症度評価(1~3)を乗じて各行動のサブスケールスコアを算出し、サブスケールスコアの合計でNPIスコアを算出します。 また、症状がない場合を0点、ある場合を1点以上とした分析方法も用いられました。
無気力下位尺度には、興味を失っている、やる気がない、自発的でない、愛情がない、熱心でない、感情がない、新しいことをすることに関心がないなどの項目がある。 抑うつ下位尺度には、「悲しい」、「憂鬱」、「涙もろい」、「元気がない」、「失敗したように感じる」、「将来に絶望する」、「重荷に感じる」、「死を願う」などの項目があります。
認知機能は、Mini-Mental State Examination(MMSE)19で評価しました。
データ解析
この研究の2つの中心的な課題は、1)これらの2つの症状が互いにどのように関係しているか、2)異なる認知症症候群間でその関係が一貫しているかどうか、でした。 NPIサブスケールの10項目すべてとMMSEスコアの合計値について、スピアマン相関を求めた。 5つの認知症グループと合計のグループでそれぞれ別のマトリックスを作成した。 抑うつと無気力の重症度の群間差を調べるために、下位尺度スコアの平均値に対するKruskal-Wallis一元配置分散分析(ANOVA)を用いた。
結果
154名の臨床的特徴を表1に示した。 FTD群とHD群ではほぼ同数の男女がいましたが、AD群では女性が多く、PD群とPSP群ではどちらも男性が多かったです。 AD群はFTD、PD、PSP群に比べて平均で約10歳、HD群に比べて約30歳年上であった。 MMSEスコアは、AD群とFTD群で同程度であり、これら2群のMMSEスコアは、PD群、HD群、PSP群よりも10ポイント低かった。
アパシーと抑うつの重症度は、群間で有意に異なっていた(表1)。 Kruskal-Wallis型一元配置分散分析を用いて、NPIサブスケールの平均値を群間で比較した。
無気力・抑うつの頻度と2つの症状の関係は、診断群によって異なっていた。 多くのAD患者、さらにはFTDとPSPの患者が、うつ症状を伴わないアパシーを有していたのに対し、PDとHDの患者の多くはアパシーを伴わないうつ症状を有していた。 すべての診断群において、どちらか一方の症状を持つ患者が両方の症状を持つ患者よりも多かった。 アパシーと抑うつの格差は、特にPDとPSPの患者で顕著であった。 PD患者では、アパシーのみの患者は少なく(n=2;5%)、うつ病のみの患者(11;28%)やうつ病とアパシーの組み合わせの患者(11;28%)と比較して、PSP患者では、うつ病の患者は少ないが、アパシーの頻度が高かった。 PSP患者22名のうち、17名(77%)はアパシーのみ11、1名はうつ病、3名はうつ病+アパシーであった(表1)。
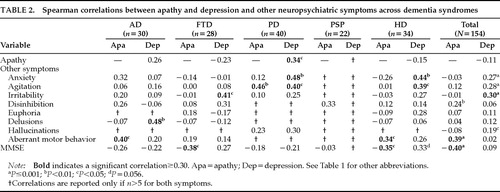
認知症患者を合わせたサンプルでは、アパシーはうつ病と相関しなかった(r=-0.11, P=0.18)。 FTD群(r=-0.23、P=0.23)とHD群(r=-0.15、P=0.40)では有意ではない負の相関があり、AD群(r=0.26、P=0.16)では有意ではない正の相関があった。 PD群は、両症状の間に有意な相関を示した唯一の認知症群であった(r=0.34, P=0.03; Table 2)。
NPIは、アパシーと抑うつに加えて、8つの精神神経症状を測定する。
NPIは、アパシーと抑うつに加えて、8つの精神神経症状を測定します。 全サンプルでは、アパシーは抑制および異常な運動行動と相関し、抑うつは不安、焦燥、過敏性、幻覚と相関した(表2)。
アパシーは、MMSEで測定される認知機能の低下と相関していた(r=-0.40, P<0.0001)、FTD群(r=-0.38、P<0.05)、HD群(r=-0.35、P<0.05)であった。 AD群とPD群では、アパシーの増加に伴い認知機能が低下する傾向が見られ、PSP群ではアパシーと認知機能の間に相関は見られなかった。
うつ病は、MMSEスコアとの有意な相関はなかった。 ADとPDでは、うつ病と認知機能の低下との間に有意ではない傾向が見られた。
考察
アパシーは神経変性疾患に多く見られ、5,9-13、本研究は、アパシーとうつ病を独立した臨床現象として取り上げた数少ない先行研究の結果を支持し、発展させたものである。 多くの先行研究で用いられているHam-Dとは異なり、NPIのうつ病サブスケールにはアパシーに関連する項目はなく、アパシーサブスケールにもうつ病に関連する質問はない。 我々は、5つの神経変性疾患を持つ154名の患者において、アパシーとうつ病の間には相関がないことを見出した。 さらに、この2つの症状は他の精神神経症状と異なった形で関連していた。 アパシーは抑制や異常な運動行動と関連し、うつ病は不安、焦燥、過敏、幻覚と関連していた。 無気力と抑制は、互いに相反する行動のように思えるが、どちらも前頭葉系を介しており、特にFTD患者では頻繁に一緒に見られる。 また、管理困難や機能的能力の低下につながる問題行動は、主に前頭葉の機能障害に関連している可能性があり、過去の研究では、アパシーがこれらの症状と関連していることが明らかになっている21,22
この研究および過去の研究では、アパシーは、ADおよびPDにおいて、(MMSEで測定される)認知機能障害の増加と有意に相関していたが、PSP11やHDでは相関していなかった22。 うつ病とより重度の認知機能障害との間に関連性があるとする研究もあるが24、そうでない研究もある。25 我々は、全サンプルにおいても、個々の疾患においても、うつ病と認知機能との間に一貫した関連性は見いだせなかった。
アパシーとうつ病の関係は、疾患特異的なものであると思われる。
アパシーと抑うつの関係は、疾患特異的なものであり、AD、FTD、PSPではアパシーが多く、かつ重度であったのに対し、PD、HDでは抑うつが多く、かつ重度であった。 PSPでは、アパシーの頻度と程度が最も高く、抑うつ度は最も低かった。
アパシーとうつ病に関連する局所機能障害の解剖学的局在はかなり重複しているようである。 うつ病を伴うパーキンソン病では、下前頭皮質28や内側前頭皮質でのグルコース代謝の低下が認められる29。 AD患者のアパシーは、ある研究では前頭側頭葉低灌流、別の研究では右側頭頂低灌流と相関していた23。 アパシーは最近になって注目されるようになったが、関連する構造のネットワークを介して、いくつかの形態のアパシーが存在する可能性がある。
うつ病とアパシーの重複が報告されているのは、アパシーの項目を含むうつ病の尺度を使用していることが原因かもしれない。
うつ病と無気力の重複が報告されていますが、これはうつ病の検査項目に無気力の項目が含まれているためです。 セロトニン作動性薬剤は、頻繁にうつ病を緩和するが、アパシーを増加させる可能性がある。一方、ドーパミン作動性薬剤は、アパシーを緩和する34,35が、抗うつ剤としては効果がない。ADのようなアセチルコリン欠乏性疾患では、コリン作動性薬剤がアパシーの緩和に有用であるが、気分には影響しない36。
本研究の限界と長所を認識する必要がある。
本研究の限界と長所を認識しておく必要があります。第一に、これらのデータを収集する際には行動評価が主な目的でしたが、ここで提示された特定の仮説は前向きに述べられたものではなく、分析は事後的なものです。 第3に、PD、HD、PSPの患者では、認知機能障害が有意に少なく、このことが、我々が疾患特異的であるとした差異の一部を説明する可能性がある。 第4に、向精神薬はアパチーや抑うつを引き起こす可能性があり、患者の一部が向精神薬を服用していないことを保証することはできないが、これらの評価は一般的に薬物療法前の初診時に行われた。
本研究では、神経変性疾患の大規模な患者群が存在し、病気の臨床的・病理学的表現に幅広いバリエーションがあることで、神経経路の異なる障害がある場合のアパシーとうつ病の関係について結論を出すことができるという点が強みとなっています。 さらに、2つの構成要素を分離した、信頼性と妥当性のある尺度を使用することで、意味のある比較が可能になりました。
我々は、アパシーは神経変性疾患では一般的であり、うつ病とは分離可能であると結論づけました。
神経変性疾患では無気力は一般的であり、うつ病とは切り離して考えることができる。 無気力はうつ病に起因するものではなく、うつ病の診断は悲しみや無力感、絶望感、無価値感などの症状に基づいて行われるべきである。
ACKNOWLEDGMENTS
このプロジェクトはDepartment of Veterans Affairs Neuroscience Fellowship, National Institute on Aging Alzheimer’s Disease Center grant (AG10123), and the Sidell-Kagan Research Fundによってサポートされました。
TABLE 1.
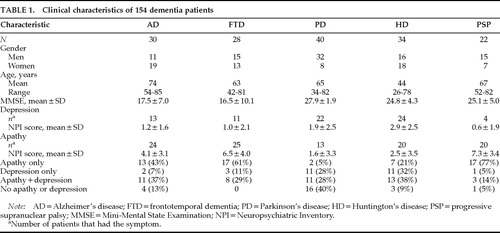
TABLE 2.
1. Marin RS: Differential diagnosis and classification of apathy. Am J Psychiatry 1990; 147:22-30Crossref, Medline, Google Scholar
2.米国精神医学会: アメリカ精神医学会:精神疾患の診断・統計マニュアル、第4版。 ワシントンDC、アメリカ精神医学会、1994Google Scholar
3.Hamilton M: A rating scale for depression. J Neurol Neurosurg Psychiatry 1960; 23:56-62Crossref, Medline, Google Scholar
4.Marin RS, Firinciogullari S, Biedrzycki RC: アパシーと抑うつの尺度間の収束の原因。 J Affect Disord 1993; 28:117-124Crossref, Medline, Google Scholar
5. Starkstein SE, Mayberg HS, Preziosi TJ, et al: Reliability, validity, and clinical correlates of apathy in Parkinson’s disease. J Neuropsychiatry Clin Neurosci 1992; 4:134-139Link, Google Scholar
6. Marin RS: Apathy: a neuropsychiatric syndrome. J Neuropsychiatry Clin Neurosci 1991; 3:243-254Link, Google Scholar
7. Marin RS, Firinciogullari S, Biedrzycki RC: アパシーと抑うつの関係におけるグループの違い。 J Nerv Ment Dis 1994; 182:235-239Crossref, Medline, Google Scholar
8. Marin RS, Biedrzycki RC, Firinciogullari S: Reliability and validity of the apathy evaluation scale. Psychiatry Res 1991; 38:143-162Crossref, Medline, Google Scholar
9. Levy ML, Miller BL, Cummings JL, et al: Alzheimer disease and frontotemporal dementias: behavioral distinctions. Arch Neurol 1996; 53:687-690Crossref, Medline, Google Scholar
10. Mega MS, Cummings JL, Fiorello T, et al: The spectrum of behavioral changes in Alzheimer’s disease. Neurology 1996; 46:130-135Crossref, Medline, Google Scholar
11. リトバンI、メガMS、カミングスJL、他:進行性核上性麻痺の精神神経学的側面。 Neurology 1996; 47:1184-1189Crossref, Medline, Google Scholar
12. Bozzola FG, Gorelick PB, Freels S: アルツハイマー病におけるパーソナリティの変化. Arch Neurol 1992; 49:297-300Crossref, Medline, Google Scholar
13. Devanand DP, Brockington CD, Moody BJ, et al: Behavioral syndromes in Alzheimer’s disease. International Psychogeriatrics 1992; 4(suppl)2:161-184Google Scholar
14. 認知症における精神病理の包括的な評価を目的とした神経心理学的検査(Neuropsychiatric Inventory)。 Neurology 1994; 44:2308-2314Crossref, Medline, Google Scholar
15. McKhann G, Drachman D, Folstein M, et al: Clinical diagnosis of Alzheimer’s disease: Report of the NINCDS-ADRDA work group under the auspices of Department of Health and Human Services Task Force on Alzheimer’s Disease. Neurology 1984; 34:939-944Crossref, Medline, Google Scholar
16. Brun A, Englund B, Gustafson L, et al: Consensus statement: 16. Brun A, Englund B, Gustafson L, et al: Consensus statement: Clinical and neuropathological criteria for frontotemporal dementia: the Lund and Manchester groups. J Neurol Neurosurg Psychiatry 1994; 57:416-418Crossref, Medline, Google Scholar
17. Litvan I, Agid Y, Jankovic J, et al: 進行性核上性麻痺(Steele-Richardson-Olszewski症候群)の診断のための臨床基準の精度:NINDS-SPSP国際ワークショップの報告。 Neurology 1996; 47:1-9Crossref, Medline, Google Scholar
18. Blin J, Baron JC, Dubois B, et al: Positron emission tomography study in progressive supranuclear palsy. 脳の低代謝パターンと臨床代謝の相関関係。 Arch Neurol 1990; 47:747-752Crossref, Medline, Google Scholar
19. このような場合には、患者の認知状態を臨床家が評価するための実用的な方法である「ミニメンタルステート」を用います。 J Psychiatr Res 1975; 12:189-198Crossref, Medline, Google Scholar
20. Starkstein SE, Fedoroff JP, Price TR, et al: Apathy following cerebrovascular lesions. Stroke 1993; 24:1625-1630Crossref, Medline, Google Scholar
21. アルツハイマー病におけるアパシーと洞察力の喪失:SPECT画像による研究. J Neuropsychiatry Clin Neurosci 1996; 8:41-46Link, Google Scholar
22. Paulsen JS, Stout JC, DeLaPena J, et al: Frontal behavioral syndromes in cortical and subcortical dementia. Assessment 1996; 3:327-337Crossref, Google Scholar
23. Craig AH, Cummings JL, Fairbanks L, et al: Cerebral blood flow correlates of apathy in Alzheimer disease. Arch Neurol 1996; 53:1116-1120Crossref, Medline, Google Scholar
24. Cooper JK, Mungas D, Weiler PG: Alzheimer’s diseaseにおける認知状態と異常行動の関係. J Am Geriatr Soc 1990; 38:867-870Crossref, Medline, Google Scholar
25. Sultzer DL, Levin HS, Mahler ME, et al: Assessment of cognitive, psychiatric, and behavioral disturbances in dementia patients: the Neurobehavioral Rating Scale. J Am Geriatr Soc 1992; 40:549-555Crossref, Medline, Google Scholar
26. Starkstein SE, Robinson RG: Depression in cerebrovascular disease, in Depression in Neurologic Disease, edited by Starkstein SE, Robinson RG. Baltimore, Johns Hopkins University Press, 1993, pp 28-49Google Scholar
27. Baxter LR, Schwartz JM, Phelps ME, et al: 3つのタイプのうつ病に共通する前頭前野のグルコース代謝の低下。 Arch Gen Psychiatry 1989; 46:243-250Crossref, Medline, Google Scholar
28. Mayberg HS, Starkstein SE, Sadzot B, et al: パーキンソン病のうつ病患者における下前頭葉の選択的な代謝低下。 Ann Neurol 1990; 28:57-64Crossref, Medline, Google Scholar
29. Ring HA, Bench CJ, Trimble MR, et al: Depression in Parkinson’s disease: a positron emission study. Br J Psychiatry 1994; 165:333-339Crossref, Medline, Google Scholar
30. Mayberg HS: Neuroimaging studies of depression in neurologic disease, in Depression in Neurologic Disease, edited by Starkstein SE, Robinson RG. Baltimore, Johns Hopkins University Press, 1993, pp 186-216Google Scholar
31. Cummings JL: Frontal-subcortical circuits and human behavior. Arch Neurol 1993; 50:873-880Crossref, Medline, Google Scholar
32. Duffy JD: The neural substrates of motivation. Psychiatric Annals 1997; 27:24-29Crossref, Google Scholar
33. Marin RS: Apathy: concept, syndrome, neural mechanism, and treatment. Seminars in Clinical Neuropsychiatry 1996; 1:304-314Medline, Google Scholar
34. Marin RS, Fogel BS, Hawkins J, et al: Apathy: a treatable syndrome. J Neuropsychiatry Clin Neurosci 1995; 7:23-30Link, Google Scholar
35. 渡辺MD、Martin EM、DeLeon OA、他:皮質下梗塞後のアパシーに対するメチルフェニデート治療が成功しました。 J Neuropsychiatry Clin Neurosci 1995; 7:502-504Link, Google Scholar
36. Kaufer DI, Cummings JL, Christine D: アルツハイマー病の行動症状に対するtacrineの効果:非盲検試験。 J Geriatr Psychiatry Neurol 1996; 9:1-6Crossref, Medline, Google Scholar
37. Logsdon RG, Teri L: Depression in Alzheimer’s Disease Patients: Caregivers as surrogate reporters. J Am Geriatr Soc 1995; 43:150-155Crossref, Medline, Google Scholar